不同营养条件对羊肚菌菌核形成的影响*
董永强,李元慧,田果廷,郝加敏,王艳琼,王 鹏,刘庆洪**
(1.中国农业大学园艺学院蔬菜系,北京 100094;2.云南省农业科学院生物技术与种质资源研究所,云南 昆明 650221)
羊肚菌(Morchella esculenta)隶属于子囊菌门(Ascomycota),是一种世界公认的名贵野生食(药)用菌,常发生于春末夏初[1]。由于其生活史过程与营养特征复杂[1-5],羊肚菌菌丝需在适宜的水分和温度条件下,菌核才能萌发形成子实体[6]。
早在1904年Molliard首次报道了羊肚菌的生活史中有菌核的存在,但是当时并未意识到菌核在羊肚菌生活史中的重要性[7]。直到Ower在特殊培养基中培养菌核,并用菌核诱导出子实体,才首次正确认识到菌核在羊肚菌生活史中的重要意义[8]。Buscot认为,羊肚菌在人工培养条件下能产生2种菌核:一种形成时间较早并分布在培养基边缘,称为簇集菌核;另一种形成时间较晚并分散分布在培养基中,称为分散菌核[4]。本次试验中,除了出现此二种菌核以外,还存在一种簇集在培养皿中心、即接种点周围的菌核分布形式。
鉴于羊肚菌菌丝发育及菌核形成条件在生产中的重要性,本试验对此进行了初步的探讨,以期对羊肚菌的生产提供一定的基础。
1 材料与方法
1.1 菌株
羊肚菌菌株来自于中国农业大学药用及食用真菌研究室。
1.2 仪器与试剂
超净工作台(YT-CJ-1D),北京亚泰科隆仪器技术有限公司;电热恒温培养箱(HT-400B),上海赫田科学仪器有限公司。马铃薯葡萄糖琼脂培养基,购自北京奥博星生物技术有限责任公司;蔗糖、(NH4)2SO4、 NH4Cl、 KNO3、 NH4HCO3、 KH2PO4、 甘氨酸、甘露醇、麦芽糖、葡萄糖和乳糖等均为分析纯,购自国药集团;蛋白胨、淀粉和酵母提取物购自国药集团。
1.3 培养基处理
以PDA培养基为基础,在其中添加不同的添加物,添加物不考虑PDA培养基原有成分。各种碳源添加物的浓度为10 g·L-1,分别是葡萄糖、α-乳糖、甘露醇、蔗糖、麦芽糖、淀粉。各种氮源添加物的浓度为 250 mg·L-1,分别是甘氨酸、NH4Cl、NH4HCO3、(NH4)2SO4、KNO3。添加物酵母提取物、蛋白胨的浓度为10 g·L-1。添加物KH2PO4,其浓度分别为 250 mg·L-1、500 mg·L-1、750 mg·L-1、1 g·L-1、2 g·L-1、5 g·L-1。以不添加任何其他物质的 PDA 培养基作为对照。
1.4 接种培养
在火焰旁使用打孔器在培养基上均匀戳孔,扎孔要完全穿透培养基。再使用火焰灼烧并冷却的镊子夹取圆柱形培养基块置于新配制的培养基中央,让其菌丝生长面接触培养基。最后培养皿使用封口膜封口,置于26℃恒温培养箱正置培养,以防止接种的培养基块掉落。
放置1 d~2 d后即可明显看到菌丝生长至新的培养基上,即可将培养皿倒置培养,直至菌核出现,且没有再生长的趋势,即可观察记录对比每组的生长情况,比较菌核长势。
2 结果分析
2.1 KH2PO4不同添加量对菌核形成的影响
KH2PO4不同添加量对菌核形成的影响见图1。
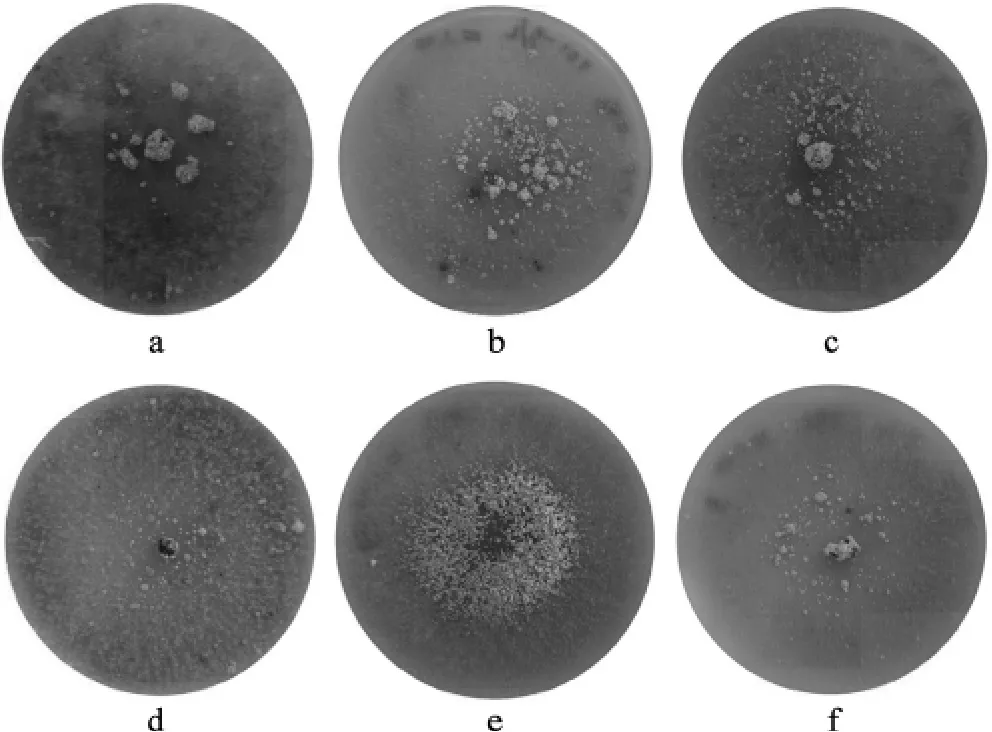
图1 KH2PO4不同添加浓度培养基上的羊肚菌菌核特征Fig.1 Chracteristics of Morchella esculenta sclerotia on medium of different concentrations of KH2PO4
由图1可见,KH2PO4添加量为1 g·L-1的培养条件,菌核为簇集菌核,但不分布在培养基边缘,集中于培养基中央,产生量相对要高,与其他培养条件比较,菌核生长量和密度明显增加。KH2PO4浓度为 250 mg·L-1、500 mg·L-1和为 750 mg·L-1时的菌核数量较少,属分散菌核形态,且菌核在培养基表面分散存在。KH2PO4浓度为2 g·L-1时,菌核数量下降,且相对不集中于培养基的中心位置。
2.2 不同碳源对菌核形成的影响
不同碳源对菌核形成的影响见图2。
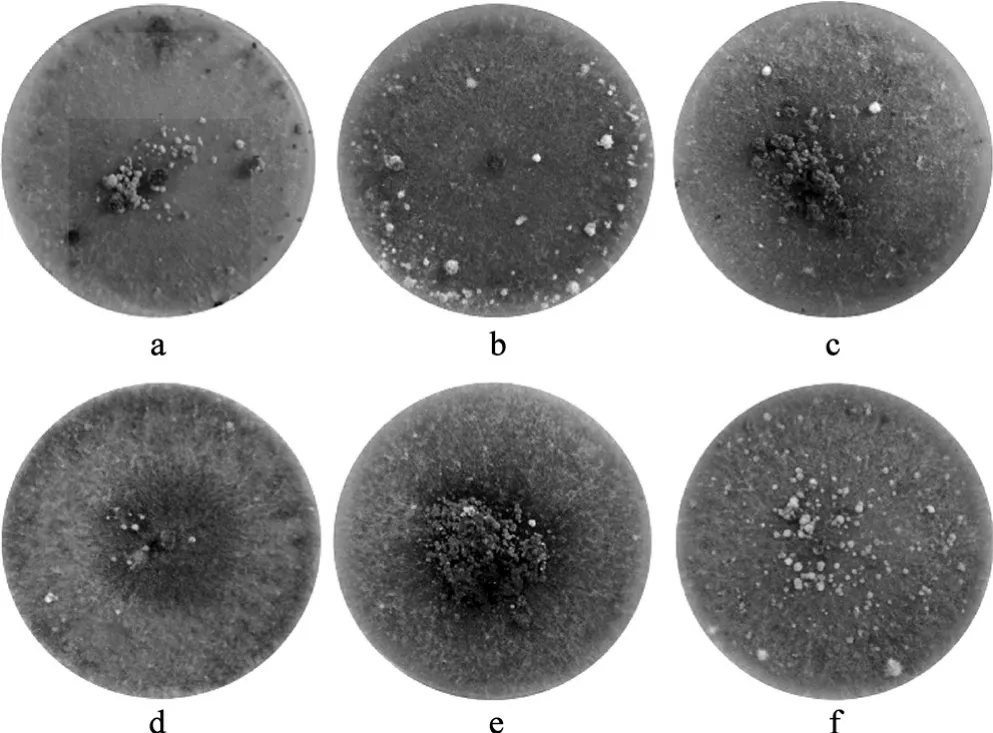
图2 不同碳源对于羊肚菌菌核形成的影响Fig.2 Effects of different carbohydrates on Morchella esculenta sclerotia
由图2可见,葡萄糖、麦芽糖、甘露醇和蔗糖作为添加碳源,菌核均呈现为中央簇集菌核,菌核个体较大,但数量未见明显增加。乳糖和淀粉作为碳源,菌核成分散菌核,产生量最大。结果显示,羊肚菌菌核形成与碳素营养的关系密切,碳水化合物的结构对菌核形成有一定的促进作用。
2.3 不同氮源对羊肚菌菌核形成的影响
添加不同氮源对羊肚菌菌核形成的影响情况见图3。
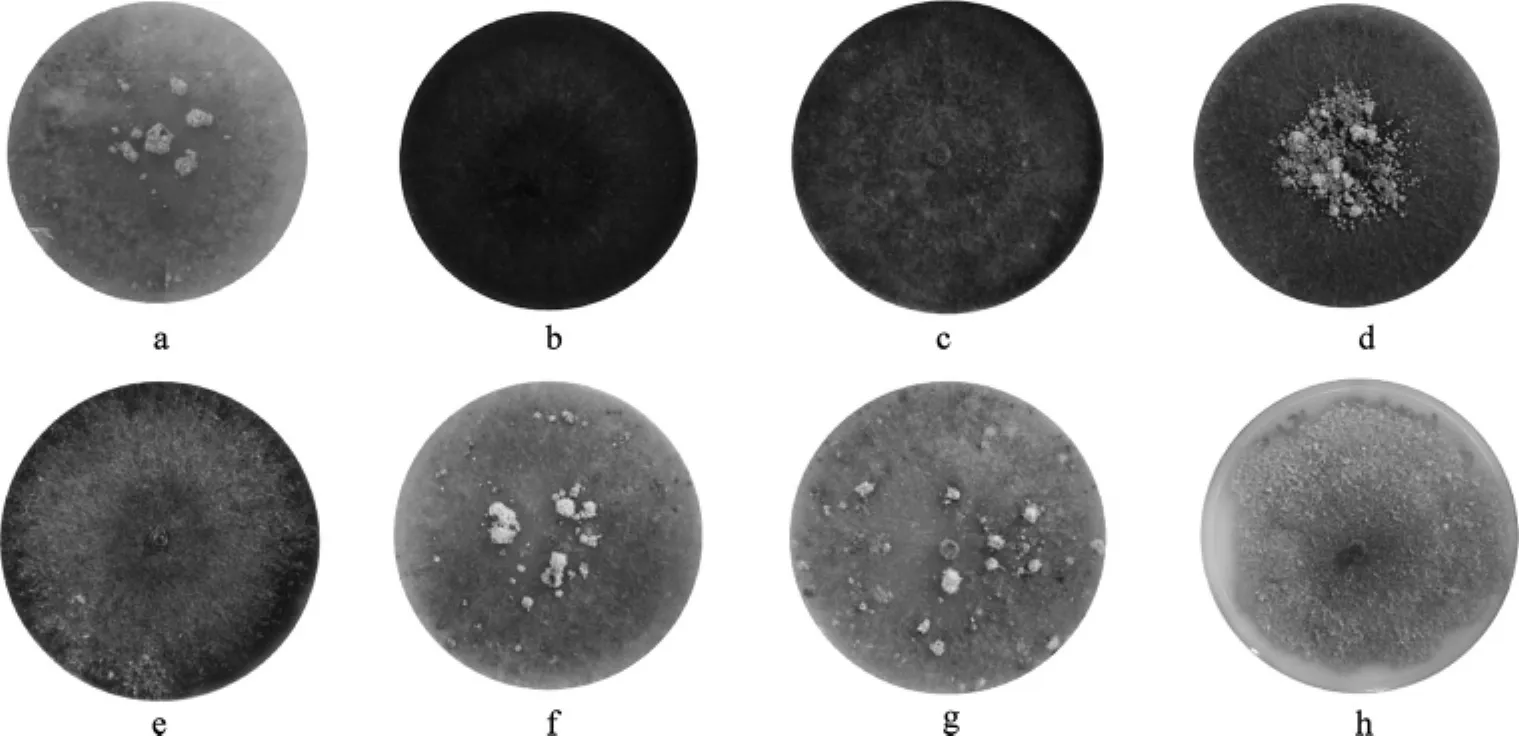
图3 不同氮源对羊肚菌菌核形成的影响Fig.3 Effects of different nitrigen on Morchella esculenta sclerotia
由图3可见,不同的氮素营养对羊肚菌菌核发生量有一定的限定关系。NH4HCO3、KNO3和甘氨酸对羊肚菌菌核形成均呈促进作用。添加NH4HCO3为氮源可促进羊肚菌中央簇集性菌核形成,KNO3和甘氨酸为氮源可促进羊肚菌形成分散性菌核。有机大分子氮素营养蛋白胨和酵母提取物对羊肚菌菌核形成有一定的抑制作用,无机氮源NH4Cl和(NH4)2SO4对菌核形成具有一定的抑制作用。
3 结论
碳素营养、氮素营养及无机化合物的添加种类,及相应的添加量对羊肚菌菌核的形成有不同的影响,直接关系到羊肚菌生产的营养要求合理配比,以及相关营养袋的配方安排[9]。
本试验发现,碳素营养中的淀粉可有效促进菌核形成,这可能与高分子碳素营养物质释放缓慢有关,羊肚菌菌核形成需要在适宜的碳素营养水平上进行。乳糖作为碳素营养可促进菌核的形成,而葡萄糖、麦芽糖和蔗糖对菌核生长的促进效应不明显,可能与乳糖中存在结合型半乳糖有直接关系。
NH4HCO3、KNO3和甘氨酸等小分子氮素营养对菌核形成均有一定的促进作用,但NH4Cl和(NH4)2SO4等小分子氮素营养对菌核形成有抑制作用,这可能与小分子氮素营养的解离与吸收方式差异有关,尤其表现在与弱酸(碳酸,H2CO3)结合的铵态氮释放效率不同的现象有某种程度的相关性[10]。有机大分子氮素营养蛋白胨和酵母提取物对羊肚菌菌核形成有一定的抑制作用,可能与菌核形成需要氮素营养的快速供给有一定的联系,而大分子氮素营养未能保证速效利用氮素营养的快速供应。
不同浓度KH2PO4在羊肚菌菌核形成过程中,表现出一定的剂量效应。低浓度时有一定的促进菌核形成的作用,但只有到1 g·L-1时才呈现出最大的促进效果。这在一定程度上反映出了KH2PO4对羊肚菌菌核形成有特定的浓度阈值。至于5 g·L-1KH2PO4不利于菌核的生长,可能缘于其浓度过高导致细胞外渗透压过高,不利于羊肚菌生长。
综上所述,不同营养因素对羊肚菌菌核形成有不同的影响,需要在栽培时特别注意相关营养因素的搭配与调节,才能更好地促进羊肚菌的生长发育。

