3-BrPA对肺癌A549/DDP细胞耐药的逆转作用研究
唐 青 胡义德
·论著·
3-BrPA对肺癌A549/DDP细胞耐药的逆转作用研究
唐青胡义德
目的探究3-BrPA对肺癌A549/DDP细胞耐药的逆转作用及其机制。方法①细胞培养: RPMI1640培养基培养肺癌A549细胞及人肺腺癌耐顺铂细胞株A549/DDP细胞;②采用CCK8及Western blot法观察3-BrPA对A549/DDP细胞的耐药逆转作用和P-糖蛋白(P-glycoprote, P-gp)的表达水平;采用流式细胞术检测不同浓度3-BrPA作用A549 /DDP细胞后细胞内罗丹明-123(Rhodamine-123,Rh123) 的蓄积情况。结果顺铂对A549细胞、A549/DDP细胞及3-BrPA作用后的A549/DDP细胞的IC50分别为6.714 μg/ml、38.99 μg/ml及12.86 μg/ml,逆转倍数为3.03,相对逆转效率为81%。3-BrPA可使A549/DDP细胞的P-gp表达下调。3-BrPA可使A549/DDP细胞内的Rh123蓄积增多并呈剂量依赖性。结论3-BrPA可逆转A549/DDP细胞对顺铂耐药,作用机制可能与其抑制P-gp的功能和表达有关。
支气管肺癌;3-BrPA;A549/DDP细胞;耐药逆转
肺癌是全球范围内病死率居于首位的恶性肿瘤,顺铂(DDP)是治疗肺癌较为有效的化疗药物之一[1]。但临床上许多肺癌患者在经历了最初的化疗之后,仍然出现复发和转移, 其失败的主要原因是肿瘤细胞产生了多药耐药(multiple drug resistance, MDR)[2]。经大量研究证实: P-糖蛋白(P-gp) 过度表达是产生MDR 的主要原因[3-4]。自从维拉帕米等第一代MDR逆转剂问世以来,已有一批针对各种MDR相关ABC转运蛋白的肿瘤MDR逆转剂相继进入临床试验阶段[4-6]。其中糖酵解己糖激酶抑制剂3-BrPA给MDR逆转剂的研究带来了一个新的热潮。近几年国外研究表明,3-BrPA是一种强烷化剂,其能通过抑制肿瘤细胞糖酵解过程中的己糖激酶,减少肿瘤细胞ATP的产生,从而导致大量肿瘤细胞凋亡[7-8]。已有文献报道3-BrPA可增敏铂类药物对耐药细胞株的杀伤作用[9-10]。因此,本实验将3-BrPA作为研究对象,探讨其对A549/DDP细胞是否具有耐药逆转作用,并观察对P-gp蛋白功能和表达的影响。
材料与方法
一、 实验材料
1. 细胞株: 人肺腺癌耐顺铂A549/DDP细胞(购于上海义森生物科技有限公司)、人肺腺癌A549细胞(本实验室前期保存)。
2. 主要试剂: RPMI1640、青霉素-链霉素双抗、胰酶(购于Hycoly公司);胎牛血清(购于Gibco公司);5 mg/ml顺铂注射液 (购于Sigma公司);3-BrPA (购于Alfa Aesar 公司);CCK8试剂盒、BCA试剂盒、SDS-PAGE 凝胶配制试剂盒(购于碧云天公司);硝酸纤维素膜(购于Millipore公司);PGP兔单克隆抗体、兔抗人GAPDH多克隆抗体(北京博奥森生物技术有限公司);山羊抗兔IgG(北京中衫金桥生物技术有限公司);ECL发光试剂盒(advansta公司)。
二、实验方法
1. 将A549细胞培养在RPMI1640培养液(含10%胎牛血清)中,将A549/DDP细胞培养在含15%胎牛血清、0.5 μg/ml顺铂(维持浓度)的RPMI1640培养液中,两种细胞置于37 ℃、 5% CO2恒温孵箱中培养。
2. CCK8实验检测: 3-BrPA对A549/DDP细胞的增殖抑制作用:用胰蛋白酶将铺满细胞培养瓶底的A549/DDP细胞消化后制成单细胞悬液接种于96孔培养板,使每孔含A549/DDP细胞约5 000个,加入培养液使得每孔终体积为200 μl。将96孔板置于37 ℃、 5% CO2恒温孵箱中培养24 h后吸除孔内废弃培养液,设置实验组和对照组。实验组分别加入3.125、6.25、12.5、25、50、100 μg/ml浓度梯度的3-BrPA,空白对照组仅加入200 μl培养液,阴性对照组仅含A549/DDP细胞的单细胞悬液200 μl。每组设三个平行复孔,再放入孵箱分别培养24 h、48 h、72 h后吸除孔内培养液,分别加入200 μl培养液和10 μl CCK8,置于37 ℃、 5% CO2培养箱中继续培养1~3 h。全自动酶标仪测定各孔450 nm处OD值,试验重复三次以上。增殖抑制率(%)=1-(实验组OD值-空白对照组OD值)/(对照组OD值-空白对照组OD值)×100%。规定生长率>90%的药物浓度为该药的非细胞毒性剂量,并作为最佳逆转耐药浓度。
3. CCK8实验检测3-BrPA对A549/DDP细胞的耐药逆转作用:将A549细胞及A549/DDP 细胞消化、离心后用培养液调整细胞数为5×104/ml。取100 μlA549/DDP细胞悬液(约5 000个细胞)加入96 孔板,每组设置三个平行复孔。将96孔板置于37 ℃、5% CO2恒温孵箱中培养24 h后吸除孔内废弃培养液,设置实验组和对照组。实验组分别先加入无毒剂量的3-BrPA后,依次加入浓度梯度为2.5,5,10,20,40 μg/ml的顺铂,同时设只加入顺铂 (浓度梯度同上)的阳性对照组;再取100 μl A549细胞悬液(约5 000个细胞)加入96孔板,加入顺铂(浓度梯度同上)和培养液。同时设置空白对照组和阴性对照组,实验重复3次以上。按CCK8实验测定450 nm处各孔吸光度OD值,取三孔平均值计算细胞增殖抑制率。通过Graphpad.prism.v5.01软件分别计算A549细胞、A549/DDP 细胞及A549/DDP 细胞加入3-BrPA后抑制率为50%时的顺铂浓度即IC50,再按照以下公式计算耐药倍数、逆转倍数及相对逆转效率。
耐药倍数RF= A549/DDP 细胞IC50/A549细胞IC50
逆转倍数RI= A549/DDP 细胞IC50/A549/DDP 细胞加入逆转剂IC50
相对逆转效率= (A549/DDP 细胞IC50-A549/DDP 细胞加入逆转剂IC50) /(A549/DDP 细胞IC50-A549细胞IC50)
4. Western blot 法检测P-gp的表达:将处于对数生长期的A549细胞、A549/DDP细胞以及3-BrPA作用48 h后的A549/DDP细胞消化离心、冰上裂解后移入EP管中用BCA法测定蛋白浓度。上样时每组取40 μg 的蛋白样品,用5% SDS-PAGE胶垂直电泳分离(浓缩胶80 V,30 min;分离胶120 V,100 min),转至PVDF膜上后,室温下封闭1 h,孵一抗(PGP、GAPDH 均1︰1 000) 4 ℃过夜; TBST洗膜每次10 min,共4次,再加入二抗(山羊抗兔IgG1︰3 000),37 ℃孵育1 h ,TBST洗膜5 min,共3次,ECL发光试剂盒显影,实验重复三次以上。
5. 流式细胞仪检测P-gp 的功能:将对数生长期的A549/DDP细胞经消化、离心后用1 640培养液制成1×106/ml 细胞悬液,取100 μlA549/DDP细胞悬液加入6孔板中,设置阴性对照组(PBS)、实验组1、2、3(3-BrPA浓度分别为6.25 μg/ml、12.5 μg/ml、25 μg/ml)每组设置三个复孔。放进37 ℃、5% CO2培养箱孵育24 h后胰酶消化,将培养细胞用PBS漂洗1次,制成单细胞悬液,37 ℃孵育30 min,每管加入终浓度达5 μg/ml的Rh123,再在37 ℃孵育40 min,以离心半径8 cm,1 500 r/min离心2 min,弃上清,用冷冻PBS重新悬浮,转移0.5 ml入流式上样管。用FACSCalibur流式细胞仪检测平均荧光强度,激发波长为488 nm,发射波长为530 nm。
三、统计学方法

结 果
一、3-BrPA对A549/DDP细胞的增殖抑制作用
CCK8实验结果显示,当3-BrPA浓度从3.125 μg/ml增加到100 μg/ml时,对A549/DDP细胞的24 h抑制率也从(1.95±2.24)%上升至(49.45 ±2.95)%,100 μg/ml的3-BrPA分别作用24 h、48 h、72 h后的抑制率为(49.45 ±2.95)%、(56.16±2.56)%、(64.05±3.06)%,说明3-BrPA能不同程度的抑制A549/DDP细胞生长,并且具有时间-剂量依赖性,即随着3-BrPA浓度和作用时间的递增,对细胞的抑制作用越来越明显,与对照组相比差异均具有统计学意义(P<0.05)(结果见表1,图1)。按上述规定6.25 μg/ml及以下浓度的3-BrPA对A549/DDP细胞无明显细胞毒性,即将浓度5 μg/ml作为3-BrPA后续工作浓度。
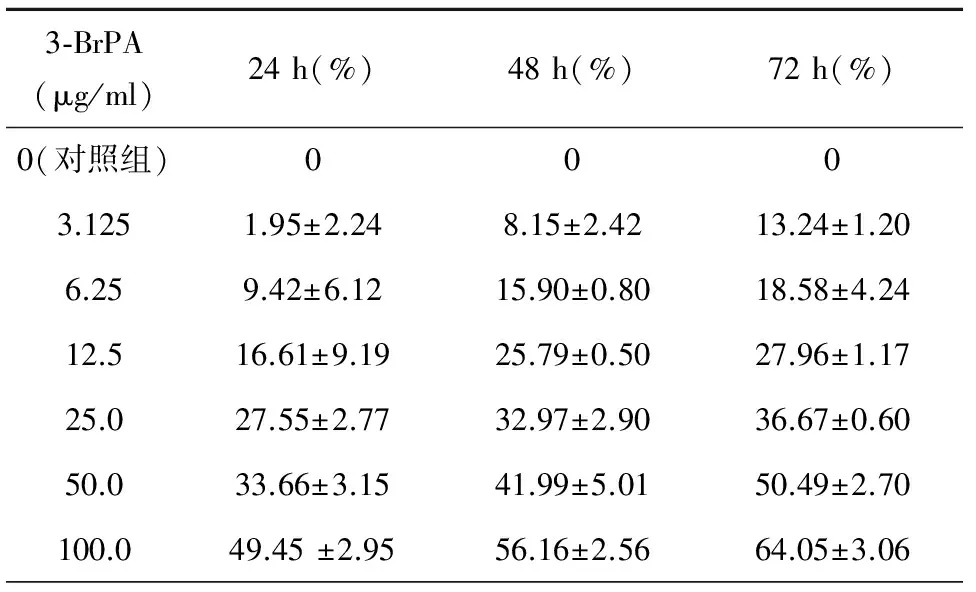
表1 3-BrPA对A549/DDP细胞增殖抑制的量效时效关系

图13-BrPA对A549/DDP细胞的增殖抑制作用
二、3-BrPA对A549/DDP细胞的耐药逆转作用
实验结果显示A549细胞及A549/DDP细胞的抑制率随顺铂浓度的增加而呈递增趋势相同浓度的顺铂对A549/DDP细胞的抑制率在加入5 μg/ml 3-BrPA干预后较干预前显著增高(P<0.05),说明3-BrPA与顺铂联用可增强顺铂的抗肿瘤作用(见表2、图2、3)。通过Graphpad.prism.5.0软件计算得到A549细胞及A549/DDP细胞的IC50分别为6.714 μg/ml、38.99 μg/ml,耐药倍数为5.81,3-BrPA作用后的A549/DDP细胞的IC50为12.86 μg/ml,耐药逆转倍数为3.03,相对逆转效率为81%。

表2 3-BrPA对A549/DDP细胞的耐药逆转作用

图2顺铂对A549细胞及A549/DDP细胞的生长抑制曲线
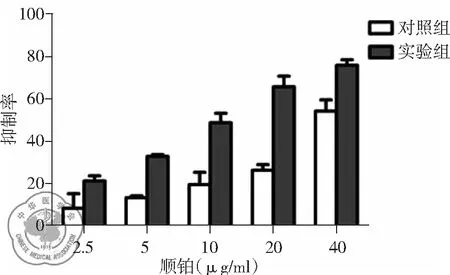
图35 μg/ml 3-BrPA对不同浓度顺铂作用下的A549/DDP细胞的增殖抑制作用
三、3-BrPA对P-gp表达的影响
P-gp是存在于肿瘤细胞膜上的一种能量依赖性药物外排泵,与抗肿瘤药物结合后通过ATP水解提供能量, 将化疗药物逆浓度梯度从胞内转运到胞外,降低细胞内药物积聚, 从而导致耐药现象的发生。本实验Western blot检测结果表明,与亲本A549细胞相比,A549/DDP细胞存在P-gp过表达现象,而在加入5 μg/ml的3-BrPA作用48 h后,P-gp表达明显降低(P<0.05),差异具有统计学意义(见图4)。

图43-BrPA对P-gp表达的影响;注:1:A549细胞 2:A549/DDP细胞 3:加入5 μg/ml 3-BrPA处理48 h后的A549/DDP细胞
四、3-BrPA对P-gp功能的影响
Rhodamine -123是一种阳离子荧光染料,也是P-gp的特异底物,P-gp能够利用水解ATP的能量,将细胞内的Rh123泵出细胞外,降低Rh123的胞内蓄积,因此可通过检测肿瘤细胞内Rh123 荧光强度的变化来反应细胞表面P-gp的功能[11]。流式结果显示与阴性对照组相比,加入3-BrPA作用后的三个组平均荧光强度(MFI)均有所增强,并且具有剂量依赖性(见图5)。说明3-BrPA可降低P-gp功能,减少Rh123外排,增加Rh123胞内蓄积。
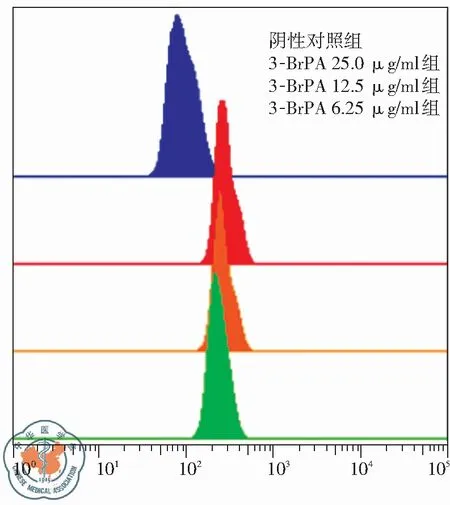
图5不同浓度3-BrPA对A549/DDP细胞内Rh123蓄积的影响
讨 论
肺癌是发病率和病死率较高的恶性肿瘤,目前最主要的治疗方式仍是以化疗为主,但影响化疗疗效并导致化疗失败的关键在于肿瘤细胞产生的耐药性。1976年Juliano首先发现P-gp与肿瘤细胞MDR有关。P-gp是依赖ATP的膜转运蛋白,P-gp与药物结合,ATP水解后所释放的能量使药物转运出细胞外,从而导致细胞内药物浓度下降,同时可通过主动转运将细胞内的毒性药物移到胞外,细胞由此产生耐药性[12-15]。维拉帕米是目前公认的耐药逆转剂,其通过影响P-gp功能,抑制细胞内药物转运出细胞外而达到逆转耐药的作用[16-17],但因其有效剂量下的毒副作用严重而在临床运用中受到了限制。因此寻找到一种高效低毒的耐药逆转剂已成为肿瘤化疗领域的新思路。
本实验结果显示,3-BrPA能明显抑制A549/DDP细胞生长,并且随着3-BrPA浓度的逐渐增高和作用时间的延长,A549/DDP细胞的存活率也逐渐降低,说明3-BrPA是一种有效的肿瘤抑制药物。与对照组相比,顺铂对A549/DDP细胞的抑制作用在加入逆转浓度的3-BrPA后明显增强,IC50由38.99 μg/ml降到12.86 μg/ml,耐药逆转倍数为3.03。由此可见,3-BrPA在自身发挥抗肿瘤作用抑制肺癌细胞生长的同时,还能作为一种有效的化疗增敏药物,逆转肺癌细胞的耐药性。Western blot检测结果显示,加入3-BrPA后的A549/DDP细胞的P-gp表达明显降低,说明3-BrPA可下调P-gp表达,从而逆转耐药。同时流式细胞检测结果显示,3-BrPA可增强Rh123在细胞内的蓄积,并且3-BrPA浓度越大,Rh123在细胞内的蓄积量越大。由此提示,3-BrPA逆转A549/DDP细胞耐药性的机制可能与抑制P-gp表达、降低P-gp功能有关。
综上所述, 本研究证实了3-BrPA在低毒剂量下确实具有抑制肺癌细胞增殖并部分逆转肺癌细胞耐药的作用,并初步阐明了3-BrPA逆转耐药的机制是通过抑制P-gp表达和降低P-gp功能而发挥逆转作用。这为今后3-BrPA作为一种新型的肿瘤MDR逆转剂提供了理论依据。不过因3-BrPA自身存在的安全性、稳定性、靶向性等问题决定了其克服肿瘤MDR真正进入临床应用所需的时间。但相信随着以上问题的逐一解决,3-BrPA可能会成为一个具有巨大应用价值的肿瘤耐药逆转剂。
1钱桂生. 肺癌不同病理类型发病率的变化情况及原因[J/CD]. 中华肺部疾病杂志: 电子版, 2011, 4(1): 1-6.
2尹丽慧, 叶爱芳, 熊术道, 等. 苦瓜蛋白对K562/A02耐药逆转作用的研究[J]. 2009, 33(4): 475-477.
3Silva R, Vilas-BoasV, Carmo H, et al. Modulation of P-glycoprotein efflux pump: induction and activation as a therapeutic strategy [J]. Pharmacol Ther, 2015, 149: 1-123.
4Li XQ, Wang L, Lei Y, et al. Reversal of P-gp and BCRP-mediated MDR by tariquidar derivativesuropean [J]. Eur J Med Chem, 2015, 101: 560-572.
5Wang YJ, Kathawala RJ, Zhang YK, et al. Motesanib (AMG706), a potent multikinase inhibitor, antagonizes multidrug resistance by inhibiting the efflux activity of the ABCB1 [J]. Biochem Pharmacol, 2010, 90(4): 367-378.
6Pusztai L, Wagner P, Ibrahim N, et al. Phase Ⅱ study of tariquidar,a selective Pglycoprotein inhibitor, in patients with chemotherapy-resistant, advanced breast carcinoma[J]. Cancer, 2005, 104(4): 682-691.
7吴弄, 邓媛媛, 徐俊, 等. 3-溴丙酮酸肿瘤多药耐药逆转剂的研究进展[J]. 华西药学杂志, 2013, 28(4): 421-424.
8Pedersen PL.3-Bromopyruvate (3BP) a fast acting, promising, powerful,specific, and effective“small molecule”anti-cancer agent taken from labside to bedside:introduction to a special issue[J]. J Bioenerg Biomembr, 2012, 44(1): 1-6.
9Schaefer NG, Geschwind JF, Engles J, et al. Systemic administration of 3-bromopyruvate in treating disseminated aggressive lymphoma [J]. Transl Res, 2012, 159(1): 51-57.
10Ihrlund LS, Hernlund E, Khan O, et al. 3-Bromopyruvate as inhibitor tumour cell energy metabolism and chemopotentiator of platinum drugs[J]. Mol Oncol, 2008, 2(1): 94-101.
11Berndtsson M, Hägg M, Panaretakis T, et al. Acute apoptosis by cisplatin requires induction of reactive oxygen species but is not associated with damage to nuclear DNA[J]. Int J Can, 2007, 120(1): 175-180.
12姚成才, 涂远荣, 杜好信, 等. 榄香烯乳剂对肺癌A549/DDP细胞株耐药逆转作用及其机制[J]. 现代肿瘤医学, 2013, 21(12): 2670-2673.
13Zhou J, Liu M, Aneja R, et al. Reversal of P-glycoprotein-mediated multidrug resistance in cancer cells by the c-Jun NH2-terminalkinase[J]. Cancer Res, 2006, 66(1): 445-452.
14Lelong-Rebel IH, Cardarelli CO. Differential phosphorylation patterns of P-glycoprotein reconstituted into a proteoliposome system: insightinto additional unconventional phosphorylation sites[J]. Anticancer Res, 2005, 25( 6B): 3925-3935.
15Gottesman MM, Fojo T, Bates SE. Multidrug resistance in cancer: role of ATP-dependent transporters[J]. Nat Rev Cancer, 2002, 2(1): 48-58.
16杨晓丹, 王丹, 孙红坤, 等. 胃癌细胞和胃癌多药耐药细胞中P-gp及GST的表达[J]. 胃肠病学和肝病学杂志, 2011, 20(9):792-795.
17Baek JS, Cho CW, et al. Controlled release and reversal of multidrug resistance by co-encapsulation of paclitaxel and verapamil in solid lipid nanoparticles[J]. Int J Pharm, 2015, 478 (2): 617-624.
(本文编辑:王亚南)
唐青,胡义德. 3-BrPA对肺癌A549/DDP细胞耐药的逆转作用研究[J/CD]. 中华肺部疾病杂志: 电子版, 2016, 9(2): 145-149.
Experimental study of 3-BrPA on reversing multidrug resistance of human lung cancer cell line A549/DDP
TangQing,HuYide.
DepartmentofOncology,XinqiaoHospital,ThirdMilitaryMedicalUniversity,Chongqing400037,ChinaCorrespondingauthor:HuYide,Email:huyide_mit@aliyun.com
ObjectiveTo preliminarily explore the reversal effect of 3-BrPA on multidrug resistance of lung cancer cell line A549/DDP and to study its potential mechanism. Methods①Cell culture: The human lung adenocarcinoma cell line A549 and cisplatin-resistant cell line A549/DDP cells were grown in RPMI1640 medium; ②CCK8 and Western blot were used to observe the reversal effect of 3-BrPA on cisplatin-resistant cell line A549/DDP cells and the expression of P-gp. Flow cytometric technology was used to detect different concentrations of 3-BrPA on A549/DDP cells by measuring Rh123 mean fluorescence intensity (MFI). Results The IC50 of cisplatin to A549 cells, A549/DDP cells and A549/DDP cells after 3-BrPA added were 6.714 μg/ml, 38.99 μg/ml and 20.2 μg/ml, respectively. The reversal ratio was 3.03 and the relative reversal efficiency was 81% as compared to A549 cells; The 3-BrPA can make the expression of P-gp on A549/DDP cells dropped. The result of FCM shows that 3-BrPA can increase the accumulation of Rh123 on A549/DDP cells in a dose-dependent manner. Conclusions3-BrPA can reverse the drug resistance on A549/DDP cell line to cis-platinum in a certain extent, which may be attributed to down regulating of P-gp expression.
Bronchus lung cancer;3-BrPA;Cisplatin-resistant cell line A549/DDP cells;Resistance reversal
10.3877/cma.j.issn.1674-6902.2016.02.007
国家自然科学基金资助项目(81372340)
400037 重庆,第三军医大学新桥医院肿瘤研究所
胡义德,Email: huyide_mit@aliyun.com
R734.2
A
2015-09-10)

