侵袭性肺曲霉病的研究进展
陈先华 郝 飞
·综述·
侵袭性肺曲霉病的研究进展
陈先华郝飞
曲霉菌;侵袭性肺曲霉病;实验室诊断
侵袭性肺曲霉病(invasive pulmonary aspergillosis, IPA)是指曲霉菌菌丝生长侵入肺实质而引起的感染性疾病;其最常见的感染患者为恶性血液病以及实体器官和造血干细胞移植的患者[1]。由于烟曲霉菌的血培养通常显阴性,并且通过支气管肺泡灌洗从下呼吸道取样来进行曲霉菌的培养通常不够灵敏,所以IPA的诊断比较复杂。近年来,非培养的诊断方法不断发展起来,包括成像检查,PCR技术,抗原检测等[2]。虽然欧洲癌症治疗与研究组织(European Organisation for the Research Treatment of Cancer )及美国真菌病研究工作组(US Mycoses Study Group)均制定了侵袭性真菌感染和诊断的标准[3];我国2006 年中华内科杂志编辑委员会也制订了《侵袭性肺部真菌感染的诊断标准与治疗原则( 草案) 》,但临床检验并没有完全按照这些标准来执行[4]。为提高IPA的早期诊断水平,现结合国内外文献资料复习并讨论近年来IPA早期诊断的研究热点,旨在确定一个有利于对于肺部IPA疾病的针对性治疗以及改善治疗效果的诊断策略,而不是一味地进行经验治疗。
一、概述
1. 病因学:IPA最常见的病原体为烟曲霉菌(A. fumigatus),为环境中常见的霉菌,由于其孢子较小,较易侵犯肺实质,亦会累及胸膜、气管以及细支气管;此外,机体37 ℃的体温也为其生长提供了良好的条件[5]。
2. 流行病学:侵袭性曲霉病可以引起免疫功能低下患者的严重机会感染,尤其是发生在中性粒细胞水平降低的患者中,体外研究显示中性粒细胞具有杀死曲霉菌的作用,中性粒细胞减少的患者肺部具有较高的侵袭性曲霉病感染的风险,包括慢性阻塞性肺病的患者、严重肝病患者及重症监护的患者,以及感染H1N1病毒的患者和手术患者[6]。HIV感染患者感染曲霉病的风险较低,由于其免疫缺陷表现在CD4细胞,其基本不参与曲霉菌的发病过程,但是也有艾滋病患者发生侵袭性曲霉病的报道。慢性肉芽肿的患者具有发生一种特异性的IPA的风险,主要表现为爆发性的肺炎。近年来,也有对IPA的易感性进行的研究。缺乏甘露糖结合凝集素的人群,或者该凝集素突变的人群可能有更高的IPA的发病风险[7]。
3. 预后:近20年来,IPA患者的治疗效果有了较大的进展。在1990年,异体造血干细胞移植患者由于IPA的病死率高达94%,但在2009年的统计显示,造血干细胞移植的患者12周的病死率约为35%。欧洲的一个关于恶性血液病患者的临床试验显示,患者12周的病死率为42%,并且在2004年至2009年间有较大幅度的降低[8]。一项关于儿童的IPA患者的研究显示,3年的生存率为55%[9]。但是,IPA所致的死亡仍旧是影响患者短期以及长期生存率的重要因素。在患有急性骨髓性白血病的患者中进行的研究显示,曲霉菌感染患者的2年生存率为14%,而未感染的患者2年生存率为32%[10]。美国的一项研究显示,曲霉菌感染的患者与未感染的患者相比,具有明显更高的病死率,花费更多的治疗费用,同时治疗时间明显延长[11]。
4. 诊断:IPA患者的症状和体征表现均非特异性,并且通常在临床治疗中,由于患者发热可能会经验性地给予抗菌药物治疗,治疗效果不明显。炎症反应的生物标志物如C-反应蛋白或降钙素的表现也非特异性,但可用于检测确诊的IPA患者的治疗效果。对于IPA的比较具有特异性的诊断方式包括:成像、直接显微镜检、组织病理学检查、病原培养、抗原检测以及DNA检测。常见的诊断方式及其优劣,见表1。
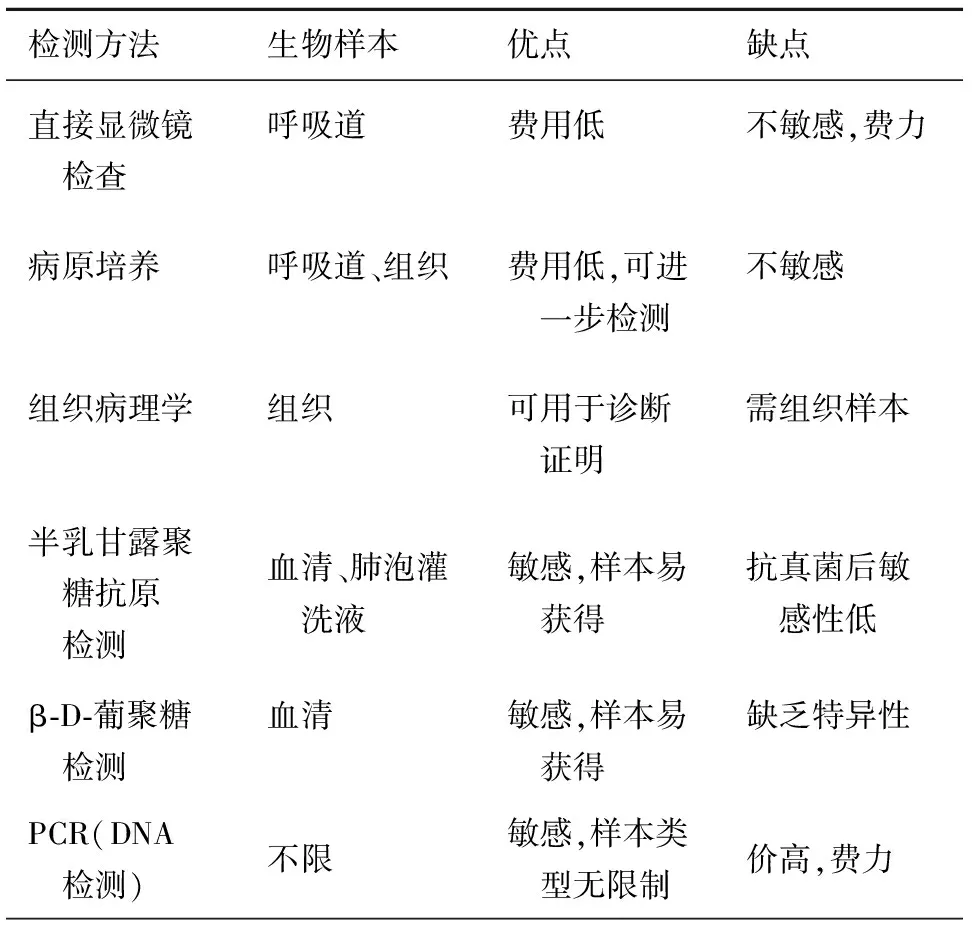
表1 常见的侵袭性曲霉病的实验室诊断方法
有研究评价了采用胸部高分辨率CT断层扫描的诊断方法具有较好的特异性,目前,该方法已经成为疑似IPA患者的重要检测手段。更重要的是,该方法中晕轮信号对于识别侵入血管壁的曲霉菌具有较好的特异性,其他的信号如树芽状、节段组合结构显示可能与呼吸道疾病有关[12]。但是,有研究对患有侵袭性曲霉病患者或者非淋巴瘤的70例患者进行了研究,显示单纯依靠CT成像进行IPA的诊断是很困难的,因其不具有足够的敏感性和特异性[13]。
每一种疾病的诊断都会遇到一个问题,那就是新的标记物出现以后,怎么与旧的标记物进行比较。对于IPA的诊断,仍然存在这样的问题,并且限制了半乳甘露聚糖检测这一以往常用于诊断IPA的方法在血清样本检测中的应用。目前,该方法可能只能用于检测少数患者的支气管肺泡灌洗液,并且该疾病的诊断还必须有活组织培养或者活检的阳性结果。
二、IPA诊断方法
1. 直接显微镜检查:诊断IPA最简单的方法之一为采用适当的标本进行直接显微镜检查。但是这种方法缺乏特异性,由于曲霉属真菌很少在体内产生孢子,并且采用这种方法看到的菌丝不能反映真菌的数量。文献报道此方法的灵敏度在0%~90%[14],差异之大可能与试验方法不同有关,特别是有的方法可能用到了荧光增白剂。
2. 组织病理学检查:采用活检或者尸检材料进行组织病理学检查可为是否存在侵袭性的真菌感染提供诊断证据。由于从组织切片中根据菌丝鉴别真菌的种类是很困难的,因此还需要通过曲霉菌的培养,获得阳性的结果,才能进行侵袭性曲霉病的诊断。组织病理学检查对于诊断侵袭性真菌病是很有价值的,但是在大多数情况下,特别是在肺部发生侵袭性真菌感染的时候,可能由于患者血小板计数太低或者一些其他的相关风险,通过胸廓穿刺活检是属于禁忌的。在一项病例系列研究中,只有40%的患者采用了支气管肺活组织检查,在其组织中检测到了真菌菌丝,其他的患者均由于血清培养阳性或者半乳甘露聚糖抗原检测阳性而诊断为侵袭性曲霉病。通过组织切片检查,曲霉属真菌的菌丝是非常窄的,直径一般在1~3 μm,很难和其他的一些真菌进行区别。有研究采用免疫组化标记的方法来对固定组织切片中的真菌细胞进行鉴别,但是鉴于其技术上的要求,并且很少有临床的样本材料采用这样的方法进行分析,因此很难对这种方法在临床检验过程中进行普及。在还没有对组织样本进行培养的情况下,采用PCR的方法来进行固定组织样本中菌丝的鉴别还是很有用的[15]。
3. 培养:在采用半乳甘露聚糖抗原检测以及PCR等特异性较好的实验室检查之前,通过临床样本的培养获得阳性的结果是传统进行侵袭性曲霉病的诊断方法。样本的阳性培养产物也可以用于一些其他的检测,比如药敏试验。从技术层面上来看,大多数的曲霉菌的生长都比较快,在多数的微生物培养介质及血琼脂中都能很好的生长。有研究显示把孵育的时间从2d延长至5d可以增加17%的培养数量[16]。由于进行病原的培养比较简单并且花费很低,有研究报道了一种可以增强该方法的灵敏度,并可以快速并且特异性地检测洋地黄固定的曲霉菌菌落的方法。通常通过对菌落以及其显微形态学的检查,来对培养的曲霉属真菌进行鉴别是比较容易的。近年来,一些新的非典型的曲霉属真菌得到确定,并且对其DNA序列也进行了测定。
4. 半乳甘露聚糖抗原检测:半乳甘露聚糖是一种碳水化合物分子,具有一个由甘露糖残基组成的骨架,该残基具有β1-5连接的呋喃半乳糖残基。在1992年,就有研究报道了对该分子进行检测的方法,该方法采用了一种单克隆抗体EB-A2,它可以与4个呋喃半乳糖残基特异性的结合,从而进行半乳甘露聚糖的检测[17]。通常在中性粒细胞减少的血液病或者造血干细胞移植的患者中都可以从血清中检测到半乳甘露聚糖,通过高分辨的CT可以检测到曲霉菌侵入了血管,也进一步证明了只有侵入血管后才会有半乳甘露聚糖的释放。相反,在慢性肉芽肿患者中,侵袭性曲霉病的特征主要表现在肺脓肿,通常会限制霉菌侵入血管,因此血清半乳甘露聚糖检测的结果一般是阴性。对动物模型以及侵袭性曲霉病患者的研究均显示,葡聚糖在血清中有较高水平的分布,血清葡聚糖检测是侵袭性曲霉病诊断的一个较好的标记物。有研究采用本法检测了30个怀疑患有侵袭性曲霉病的患者,63%的患者检测结果均为阳性,而对照组73%的患者为阴性[18]。但是患有其他真菌感染的患者采用本法检测也可能为阳性,包括假丝酵母菌、镰刀菌属、枝顶孢属、肺囊虫病以及荚膜组织胞浆菌等[19]。因此,葡聚糖是IPA检测的一个不具有较好特异性的标记物。
5. 曲霉菌DNA检测:在1988年聚合酶链反应(PCR)发明后不久,已有研究报道如何从样本中进行DNA的提取,并且通过PCR的方法进行曲霉菌DNA的检测,从而对动物模型或者患者进行疾病的诊断[20]。但是,对于定植和感染的区别限制了该方法的使用。1997年,有人从中性粒细胞减少的血液病患者血液中进行了DNA的提取,并且对13例患有侵袭性曲霉病的患者,采用斑点印迹法进行全真菌引物探测曲霉菌DNA,并对大亚基rRNA进行了扩增[21],其后该技术得到了广泛的关注和发展。但是,由于目前不同的研究文献中采用的DNA的提取方法,PCR方法,以及产物的检测方法各有不同,缺乏标准化以及各种不同方法的比较,因此还没有商业的标准化的PCR检测试剂盒,导致DNA检测方法还没能列入欧洲癌症治疗研究组织(EORTC)对IPA感染的诊断标准中[22]。
6. 其他侵袭性曲霉病的生物标记物:近年来,见有一些新的检测方法报道。新近一种测定只有在霉菌生长的时候才会产生的细胞外的糖蛋白抗原检测方法,被称之为测流装置,该方法对采用半乳甘露聚糖和葡聚糖检测诊断为侵袭性曲霉病的患者进行检测时,显示出较好的特异性。另外采用侵袭性曲霉病的豚鼠模型进行研究,显示胞外糖蛋白抗原作为标记物要早于半乳甘露聚糖和葡聚糖出现[23]。其他建议作为标记物的烟曲霉抗原包括存在于生长的霉菌表面的Cf2和细胞壁相关抗原,胶毒素及其衍生物[24]。
曲霉菌的血清抗体可作为侵袭性曲霉病的一种诊断方法,但是,在免疫功能低下的患者中,对曲霉菌感染的抗体应答一般比较差。但对于非中性粒细胞减少患者的诊断,以及患者在清髓性化疗以及干细胞移植之前,对于抗体的检查是非常有用的[25]。在非免疫功能低下的患者,如COPD患者,对曲霉菌的抗体应答可能是比较有意义的。
对IPA患者进行呼吸测试临床已有使用。最近的一项研究显示,在2例患者的测试中成功检测到2-正戊基呋喃,推测这种新的方法可能为诊断IPA提供新的证据并且有关这种超低介入的研究方法值得进一步试验研究[26]。
近年来,多种研究措施和方法都在努力地想要实现肺部IPA的准确鉴别和诊断,以此在患者治疗方案中获益。在曲霉病诊断和治疗中也有了较大的进步,但是其与疾病相关的病死率并没有成比例的减少[27]。在免疫功能低下的高风险患者中,特别是那些中性粒细胞减少的患者,虽然目前对其疾病特点有了一定的了解,并对慢性肺病患者的IPA的诊断和治疗也采用了特殊的方法[28]。但并不能减少中性粒细胞低于正常水平患者的死亡率。对于IPA诊断方法的研究仍是一个挑战,但有理由相信随着对曲霉菌菌体抗原成分和结构特性研究的发展,其临床的诊断和治疗将得到不断的改进。
1Erjavec Z, Kluin-Nelemans H, Verweij PE. Trends in invasive fungal infections, with emphasis on invasive aspergillosis[J]. Clin Microbiol Infect, 2009, 15(7): 625-633.
2Thornton C R. Detection of invasive aspergillosis[J]. Adv in Appl Microbiol, 2010, 70: 187-216.
3Ascioglu S, Rex JH, De Pauw B, et al. Defining opportunistic invasive fungal infections in immunocompromised patients with cancer and hematopoietic stem cell transplants: an international consensus[J]. Clin Infect Dis, 2002, 34(1): 7-14.
4Avni T, Levy I, Sprecher H, et al. Diagnostic accuracy of PCR alone compared to galactomannan in bronchoalveolar lavage fluid for diagnosis of invasive pulmonary aspergillosis: a systematic review[J]. J Clin Microbiol, 2012, 50(11): 3652-3658.
5Pitt JI. The current role of aspergillus and penicillium in human and animal health[J]. J Med Vet Mycol, 1994, 32(S1): 17-32.
6Marr KA, Carter RA, Boeckh M, et al. Invasive aspergillosis in allogeneic stem cell transplant recipients: changes in epidemiology and risk factors[J]. Blood, 2002, 100(13): 4358-4366.
7Lambourne J, Agranoff D, Herbrecht R, et al. Association of mannosebinding lectin deficiency with acute invasive aspergillosis in immunocompromised patients[J]. Clin Infect Dis, 2009, 49(10): 1486-1491.
8Nicolle MC, Bénet T, Thiebaut A, et al. Invasive aspergillosis in patients with hematologic malignancies: incidence and description of 127 cases enrolled in a single institution prospective survey from 2004 to 2009[J]. Haematologica, 2011, 96(11): 1685-1691.
9Cakir FB, Cakir E, Berrak SG, et al. Invasive respiratory aspergillosis is a treatable disease with early diagnosis and aggressive therapy[J]. Pediatr Hematol Oncol, 2010, 27(6): 422-434.
10Michallet M, Bénet T, Sobh M, et al. Invasive aspergillosis: an important risk factor on the short-and long-term survival of acute myeloid leukemia (AML) patients[J]. Eur J Clin Microbiol Infect Dis, 2012, 31(6): 991-997.
11Kim A, Nicolau DP, Kuti JL. Hospital costs and outcomes among intravenous antifungal therapies for patients with invasive aspergillosis in the United States[J]. Mycoses, 2011, 54(5): e301-e312.
12Hidalgo A, Parody R, Martino R, et al. Correlation between high-resolution computed tomography and galactomannan antigenemia in adult hematologic patients at risk for invasive aspergillosis[J]. Eur J Radiol, 2009, 71(1): 55-60.
13Kawel N, Schorer GM, Desbiolles L, et al. Discrimination between invasive pulmonary aspergillosis and pulmonary lymphoma using CT[J]. Eur J Radiol, 2011, 77(3): 417-425.
14Denning DW, Park S, Lass-Florl C, et al. High-frequency triazole resistance found in nonculturableAspergillusfumigatus from lungs of patients with chronic fungal disease[J]. Clin Infect Dis, 2011, 52(9): 1123-1129.
16Mortensen KL, Johansen HK, Fuursted K, et al. A prospective survey of aspergillus spp. in respiratory tract samples: prevalence, clinical impact and antifungal susceptibility[J]. Eur J Clin Microbiol Infect Dis, 2011, 30(11): 1355-1363.
17Stynen D, Sarfati J, Goris A, et al. Rat monoclonal antibodies against aspergillus galactomannan[J]. Infect Immun, 1992, 60(6): 2237-2245.
18Kami M, Tanaka Y, Kanda Y, et al. Computed tomographic scan of the chest, latex agglutination test and plasma (1AE3)-beta-D-glucan assay in early diagnosis of invasive pulmonary aspergillosis: a prospective study of 215 patients[J]. Haematologica, 2000, 85(7): 745-752.
19Persat F, Ranque S, Derouin F, et al. Contribution of the (1→3)-β-d-glucan assay for diagnosis of invasive fungal infections[J]. J Clinical Microbiology, 2008, 46(3): 1009-1013.
20Tang CM, Holden DW, Aufauyre-Brown A, et al. The detection of Aspergillus spp. by the polymerase chain reaction and its evaluation in bronchoalveolar lavage fluid[J]. Am Rev Respir Dis, 1993, 148(5): 1313-1317.
21Einsele H, Hebart H, Roller G, et al. Detection and identification of fungal pathogens in blood by using molecular probes[J]. J Clin Microbiol, 1997, 35(6): 1353-1360.
22De Pauw B, Walsh TJ, Donnelly JP, et al. Revised definitions of invasive fungal disease from the European organization for research and treatment of cancer/invasive fungal infections cooperative group and the national institute of allergy and infectious diseases mycoses study group (EORTC/MSG) consensus group[J]. Clin Infect Dis, 2008, 46(12): 1813-1821.
23Schütte M, Thullier P, Pelat T, et al. Identification of a putative Crf splice variant and generation of recombinant antibodies for the specific detection of aspergillus fumigatus[J]. PLoS One, 2009, 4(8): e6625.
24Neustadt M, Costina V, Kupfahl C, et al. Characterization and identification of proteases secreted by Aspergillus fumigatus using free flow electrophoresis and MS[J]. Electrophoresis, 2009, 30(12): 2142-2150.
25Shi LN, Li FQ, Lu JF, et al. Antibody specific to thioredoxin reductase as a new biomarker for serodiagnosis of invasive aspergillosis in non-neutropenic patients[J]. Clin Chim Acta, 2012, 413(9-10): 938-943.
26Chambers ST, Scott-Thomas A, Epton M. Developments in novel breath tests for bacterial and fungal pulmonary infection[J]. Curr Opin in Pulm Med, 2012, 18(3): 228-232.
27Dodds Ashley E, Drew R, Johnson M, et al. Cost of invasive fungal infections in the era of new diagnostics and expanded treatment options[J]. Pharmacotherapy, 2012, 32(10): 890-901.
28Aquino VR, Nagel F, Andreolla HF, et al. The performance of real-time PCR, galactomannan, and fungal culture in the diagnosis of invasive aspergillosis in ventilated patients with chronic obstructive pulmonary disease (COPD)[J]. Mycopathologia, 2012, 174(2): 163-169.
(本文编辑:张大春)
陈先华,郝飞. 侵袭性肺曲霉病的研究进展[J/CD]. 中华肺部疾病杂志: 电子版, 2016, 9(2): 201-203.
10.3877/cma.j.issn.1674-6902.2016.02.022
国家自然科学基金资助项目(81271753)
400038 重庆,第三军医大学西南医院皮肤科
陈先华,Email:chenxianhua137@sina.com
R563
A
2016-01-09)

