吸烟对健康人小气道功能和血清炎症标志物影响的研究
徐 英 高 滨 崔晓媛 张 敏 陈晓英 崔翰文
·短篇论著·
吸烟对健康人小气道功能和血清炎症标志物影响的研究
徐英高滨崔晓媛张敏陈晓英崔翰文
香烟烟雾;小气道;C反应蛋白;白介素-8
约三分之一的吸烟者没有咳嗽、咳痰、气短及气喘症状,肺通气功能测定也无异常,即所谓的“正常吸烟者”[1]。“正常吸烟者”很容易发展为慢性阻塞性肺疾病(chronic obstructive pulmonary disease, COPD)人群。吸烟者中的25%会发展为典型的COPD患者,这些易感个体由气道疾病进展到有症状的COPD约需要20年或数十年[2-3]。本研究旨在探讨这部分人群是否已出现肺功能和血清血炎症标志物异常,倡导尽早戒烟。
资料与方法
一、研究资料
选择2013年1月至2014年7月来我院体检的公务员。纳入标准为:男性、40~60岁、体质量指数18~30 kg/m2;心电图无明显ST段改变;血常规、胸片检查正常;肺功能测定结果FEV1>80%预计值,FEV1/FVC>70%。健康的吸烟人群为实验组、选同等条件非吸烟者30名为对照组,两组间年龄、体质量差异无统计学意义(P>0.05)。所有入选者均签署知情同意书。根据世界卫生组织标准每天吸烟1支以上,连续吸烟1年以上者定义为吸烟者,把每天吸烟的支数乘以吸烟年限称为吸烟指数。吸烟指数400~1 200。排除标准包括:有慢性疾病史如支气管炎、高血压病、糖尿病、冠心病、脑梗死、代谢性疾病、肿瘤;COPD和哮喘患者。
二、 研究方法
应用德国康迅powercube-Diff肺功能仪。软件版本:Version:8.5G Release 3(17.11.2008 12:48) PwCNTL 1.27。1 000 ml标准容积定标筒。由肺功能检查室专人操作,每次操作前均重新定标,受试者每人至少做三次,取最好的一次结果记录数据。检查指标包括:呼气峰流速(peak expiratory flow, PEF),肺活量位的最大呼气流速(MEF75、MEF50、MEF25)。所有观察对象均记录部分肺通气指标:用力肺活量(forced vital capacity, FVC)、第一秒用力呼气容积(forced expiratory volume in one second, FEV1)、第一秒用力呼气容积与用力肺活量之比(FEV1/FVC)。全部小气道指标:PEF、MEF75、MEF50、MEF25、最大呼气中期流速(maximum midexpiratory flow, MMEF)。非COPD者入组。所有受试者一个月内均无呼吸道感染以及用药史。
清晨采空腹静脉血2管各5 ml,第1管用酶联免疫吸附法检测血白介素-8(IL-8)浓度,试剂盒为深圳达科生物工程有限公司按照说明书操作;第2管用免疫散射比浊法检测C反应蛋白(C-reactive protein, CRP)浓度、应用德国全自动生化分析仪检测扫描打印保存结果。
三、统计学处理

结 果
一、肺功能检查结果
吸烟与非吸烟组比较,FVC非吸烟组4.0837±0.23255 L、吸烟组3.9877±0.18256 L;FEV1非吸烟组3.5487±0.08541 L、吸烟组3.5127±0.12643 L。差异均无统计学意义。两组小气道各项指标中:MEF75非吸烟组6.5373±0.50233 L/s,吸烟组5.4323±0.63096 L/s;MEF50非吸烟组5.6643±0.71145 L/s,吸烟组4.4897±0.46152 L/s;MEF25非吸烟组2.5630±0.45953 L/s,吸烟组1.5300±0.31154 L/s;PEF非吸烟组6.6823±0.34705 L/s,吸烟组5.0963±0.45093 L/s。吸烟组与非吸烟组对比,所有指标均明显下降,其中MEF50、MEF25、PEF两组差异有统计学意义(P<0.05),见表1。
二、血清CRP、IL-8测定结果
非吸烟组血CRP浓度1.311±0.21951 mg/L,吸烟组血CRP浓度4.5083±0.71586 mg/L。吸烟组明显高于非吸烟组,差异有统计学意义(P<0.05)。非吸烟组血IL-8浓度6.6190±0.99734 pg/ml,吸烟组血IL-8浓度10.4190±1.63838 pg/ml。吸烟组明显高于非吸烟组,差异有统计学意义(P<0.05)。
讨 论
烟草于15世纪从美洲引入欧洲,自此向全世界蔓延。16世纪传入我国,并很快流行于全国各地。香烟具有多种象征作用,世界各国上至国家元首下至普通百姓,吸烟者越来越多,年龄越来越年轻化。吸烟和二手烟烟雾暴露导致呼吸道损伤, 引起多种疾病, 包括气流受限为特征的慢性气道炎症性疾病:COPD和支气管哮喘。研究发现,吸烟加速哮喘和COPD人群肺功能下降,增加死亡率,并且使症状恶化。香烟烟雾暴露改变哮喘过程中炎症细胞的角色。吸烟使炎性细胞因子如IL-2、4、8等产量增加、即吸烟导致炎症因子释放[4]。吸烟也可致哮喘人群小气道关闭[5]。我们在临床工作中发现,吸烟多年的人不一定就会得COPD,吸烟的人只有一部分进展为COPD患者,一部分吸烟者肺功能尚未达到COPD,但是小气道功能下降,尤其表现为MEF50,MEF25和PEF降低。可能的原因包括小气道解剖特点是分支多、截面积大、气流阻力小、烟雾在此处流速慢,黏膜与有害物质接触时间长,先引起了小气道的损伤。本次研究入选人群FVC、FEV1、FEV1/FVC均在正常范围。但是吸烟组与非吸烟组对比,反映小气道功能的指标有下降,包括MEF75,MEF50,MEF25和PEF,其中MEF50、MEF25以及PEF 在两组的差异有统计学意义(P<0.05)。
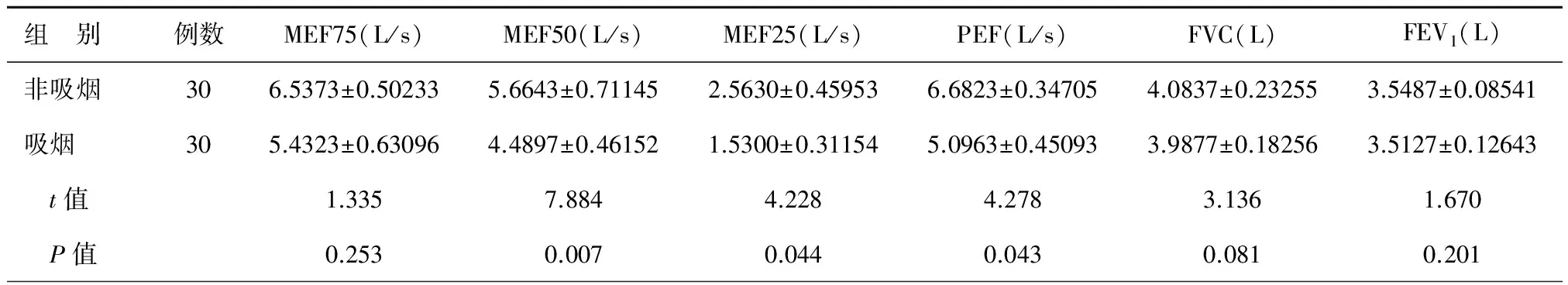
表1 吸烟与非吸烟组的肺功能测定比较
Radic等[6]研究了吸烟对肺功能的影响,追踪调查了一组16~30岁的年轻哮喘人群,发现吸烟早期出现MEF50、MEF25下降,随着吸烟量增加、吸烟时间延长,反应大气道和小气道的指标均明显下降。充分论证了吸烟引起气道炎症,导致肺功能下降,早期表现为小气道功能降低,随着逐年吸烟,大气道功能下降,气道炎症进展,气流受限为不可逆性。上皮细胞是防御异物的第一道防线,Nadigel等[7]研究比较了COPD和健康人群气管支气管上皮细胞对于香烟烟雾刺激后细胞内的反应变化,将香烟冷凝物预处理24 h后,应用酶联法和免疫印记方法检测IL-8产物Toll样受体4(Toll-like receptor 4, TLR4)表达结果,发现正常人气道上皮细胞内IL-8产物以剂量依赖方式增加,对香烟有反应,但是COPD者上皮细胞没有出现显著不同,并且与正常人对比、香烟刺激后IL-8产物要低得多,即香烟刺激后TLR4表达没有变化。此结果提示健康人与COPD人群对于香烟的反应是不同的, COPD人群气道上皮细胞显示出抑制IL-8的释放,COPD人群的气道上皮细胞对于异物刺激的反应是下降的。此项研究结果提示健康人烟雾刺激后气道IL-8释放,与我们的研究结果一致。有关吸烟对血中炎症因子的影响,Zhang等[8]研究IL-17和IL-8在不同分级COPD人群的水平,纳入了73例老年COPD患者和31例健康志愿者。检测痰和血中IL-17和IL-8水平;以及不同细胞的数量。结果发现,重度COPD患者痰中IL-8水平升高,而IL-17水平下降,并且大鼠COPD模型香烟刺激六周后出现BALF中IL-8水平升高。Arnson等[9]研究了香烟烟雾对于免疫、炎症和自身免疫的影响,认为吸烟能促进多种促炎性因子生成包括IL-8。Yin等[10]研究表明吸烟增加体内体外支气管上皮细胞中IL-8、白三烯B4(leukotriene B4, LTB4)和TLR4表达水平,增加支气管上皮细胞促炎活性,最终导致气道炎症。
Kelishadi 等[11]研究了大气颗粒物质(particulate matter, PM)和被动吸烟对反映健康儿童内皮功能紊乱的生物标志物的影响。研究于2011年在伊斯法罕进行,共纳入100个孩子。测定血清CRP及一氧化氮(nitric oxide, NO)浓度。结果显示,生活在高度污染区域的比那些在低污染区域孩子的CRP的浓度显著升高。这一发现表明,被动吸烟和可吸入颗粒物高浓度都能导致血清CRP浓度升高,这是导致血CRP升高的两个独立因素。MMPs和CRP与COPD发病有关联。墨西哥学者研究了FEV1与金属蛋白酶1、7、9(matrix metalloproteinases 1 ,7,9,MMPs1、7、9)和CRP在慢性阻塞性肺病生物燃料和香烟烟雾暴露中的反向关联性[12]。该研究目的是确定生物燃料和吸烟(TS)对COPD人群血MMPs和CRP浓度的影响。分为燃料相关COPD组(n=40)、吸烟相关COPD (n=40)组和健康不吸烟妇女组(NS,n=40),分别检测肺功能水平,MMP-7、MMP-9、MMP-9 / TIMP-1和CRP浓度。观测CRP血浆浓度和FEV1。结果发现生物燃料组FEV1下降越明显血CRP浓度越高,与吸烟引起的系统性炎症类似,即吸烟和生物燃料均可导致血CRP浓度升高引起炎症反应。Ohsawa等[13]认为血中CRP 水平与每天吸烟数量之间是否有量效关系还不确切;血中CRP水平与戒烟时间长短的关系也不确切。故应用方差分析比较了1 926例40~69 岁男性血CRP 几何平均水平。结果显示CRP(mg/L)几何平均水平在三组中显著不同:非吸烟组0.41;正在吸烟组0.57;戒烟组0.48。证实了吸烟引起血CPR 水平升高,但与每天吸烟量无关。Asthana等[14]研究了主动吸烟者吸烟强度和戒烟对炎症标志物的影响,该研究结论认为吸烟引起CRP 升高,均和我们的研究结果一致。
全世界的吸烟大国包括中国、印度、美国等。我国是发展中国家、目前大力发展经济,烟草业是国家和地方纳税大户,能够支撑财政,目前缺乏专门有力的法律法规去约束烟草企业的生产和宣传,公众对吸烟的危害普遍缺乏正确认识、存在严重的思想与观念上的误区,对于二手烟的危害更是知之甚少。医护工作者根本没有足够的时间和精力反复向患者以及家属宣讲吸烟对健康的害处。现在我国已经开始全社会开展戒烟活动;医院开设戒烟门诊;公共场所限制吸烟;并研制了协助戒烟的药物,但是远离烟草危害尚任重道远。国外学者让豚鼠使用鼻吸烟,每天暴露在香烟烟雾暴露系统4个月和8个月[15];对照组被暴露在香烟烟雾中4个月后戒烟4个月。结果提示吸烟使气道壁存在明显的炎症细胞浸润、杯状细胞化生、平滑细胞肥大、结缔组织增生、管腔狭窄、黏膜溃疡。并且吸烟能导致支气管平滑肌痉挛、管腔狭窄闭塞,使管腔狭窄进一步加重;然而戒烟可以使气道部分恢复正常结构。Hastie等[16]认为吸烟者CRP 水平升高,但戒烟后CRP水平也并没有立即降至正常,提示CRP 升高不是烟雾刺激的直接原因而更可能是组织损伤导致的炎症刺激。我们的研究发现吸烟导致气道炎症、尽管研究中的吸烟者尚不能构成诊断为COPD,但是已经出现小气道功能下降和血IL-8、CRP浓度升高,所以应提倡尽早戒烟。此项研究样本量偏小,并且为单中心研究,因为在实验开展过程中筛选入组人群时、我们发现吸烟但是同时不患慢性疾病的中年男性非常少,导致能入组人数很少,即吸烟的非COPD男性多数有其他慢性疾病、此现象值得进一步研究和思考。
1梁毅, 钟小宁. 戒烟对慢性阻塞性肺疾病肺组织结构和炎症反应的影响[J]. 国际呼吸杂志, 2006, 26(3): 196-198.
2任成山, 钱桂生. 慢性阻塞性肺疾病发病机制研究现状与展望[J/CD]. 中华肺部疾病杂志: 电子版, 2009, 2(2): 104-115.
3Sohal SS, Mahmood QM, Walters HE. Clinical significance of epithelial mesenchymal transition (EMT) in chronic obstructive pulmonary disease (COPD): potential target for prevention of airway fibrosis and lung cancer[J]. Clin Translat Med, 2014, 3(1):33.
4Tamimi A, Serdarevic D, Hanania NA. The effects of cigarette smoke on airway inflammation in asthma and COPD: Therapeutic implications[J]. Respir Med, 2011, 106(3): 319-328.
5Kanazawa H, Kyoh S, Tochino Y, et al. Potential role of pentosidine on susceptibility to small airway closure in elderly and smoking asthma[J]. Respir Med, 2014, 108(5): 709-715.
6Radic S, Zivkovic Z, Erdeljan N, et al. influence of smoking habit on respiratory function in young asthmatics:follow-up study from 16-30 years of age [J]. Srp Arh Celok Lek, 2006, 134(suppl 2): 100-103.
7Nadigel J, Audusseau S, Baglole CJ. IL-8 production in response to cigarette smoke is decreased in epithelial cells from COPD patients[J]. Pulmonary Pharmacology & Therapeutics, 2013, 26(5): 596-602.
8Zhang X, Zheng H, Zhang H. Increased interleukin (IL)-8 and decreased IL-17 production in chronic obstructive pulmonary disease (COPD) provoked by cigarette smoke[J]. Cytokine, 2011:56 (3): 717-725.
9Arnson Y, Shoenfeld Y, Amital H. Effects of tobacco smoke on immunity,inflammation and autoimmunity[J]. J Autoimmun, 2010, 34(3): J258-J265.
10Yin Y, Hou G, Li ER, et al. Regulation of cigarette smoke-induced toll-like receptor 4 expression by peroxisome proliferator-activated receptor gamma agonists in bronchial epithelial cells[J]. Respirology, 2013, 18(suppl 3): 30-39.
11Kelishadi R, Hashemi M, Javanmard SH, Effect of particulate air pollution and passive smoking on surrogate biomarkers of endothelial dysfunction in healthy children[J]. Paediatr Int Child Health, 2014, 34(3): 165-169.
13Ohsawa M, Okayama A, Nakamura M, et al. CRP levels are elevated in smokersbut unrelated to the number of cigarettes and are decreased by long-term smokingcessation in male smokers[J]. Preventive Medicine, 2005, 41(2): 651-656.
14Asthana A, Johnson HM, Piper ME, et al. Effects of smoking intensity and cessation on inflammatory markers in a large cohort of active smokers[J] . American Heart Journal, 2010, 160(3): 458-463.
15Wright JL,Churt A. Smoking cessation decreases the number of metaplastic secretory cells in the small airways of the Guinea pig[J]. Inhat Toxicol, 2002, 14(11): 1153-1159.
16Hastie CE, Haw S, Pell JP. Impact of smoking cessation and lifetime exposure on C-reactive protein[J]. Nicotine & Tobacco Research, 2008, 10(4): 637-642.
(本文编辑:黄红稷)
徐英,高滨,崔晓媛,等. 吸烟对健康人小气道功能和血清炎症标志物影响的研究[J/CD]. 中华肺部疾病杂志: 电子版, 2016, 9(2): 185-187.
10.3877/cma.j.issn.1674-6902.2016.02.016
黑龙江省应用技术研究与发展计划项目(GZ13C004)
150000 哈尔滨,黑龙江省医院呼吸内科
高滨,Email: harbingaobin2008@163.com
R563
B
2015-05-05)

