运动干预对阿尔茨海默病模型大鼠记忆能力及神经元AMPK信号分子和自噬的影响
郭春阳,刘 涛,李 明
1. 河南大学 学生体质健康研究所,河南 开封 475001; 2. 西安体育学院 健康科学系,西安 710068
运动干预对阿尔茨海默病模型大鼠记忆能力及神经元AMPK信号分子和自噬的影响
郭春阳1,刘 涛2,李 明1
1. 河南大学 学生体质健康研究所,河南 开封 475001; 2. 西安体育学院 健康科学系,西安 710068
〔目的〕 探讨运动干预对阿尔茨海默病模型大鼠记忆能力及神经元AMPK信号分子和自噬的影响。〔方法〕 将60只雄性SD大鼠随机分为正常对照组、运动对照组、AD模型对照组、AD模型训练组。在立体定位仪下向大鼠两侧海马注射Aβ25-35制造AD模型。实验结束后,通过Morris水迷宫检测各组大鼠学习记忆能力,用Nissl法检测海马神经元存活状态;通过免疫荧光染色检测磷酸化AMPK表达;用Western blot法检测P-AMPK、LC3I、LC3II及Beclin-1的表达。〔结果〕 与AD模型对照组相比较,AD模型训练组大鼠的逃避潜伏期明显减少,穿越平台区域次数明显增加(P<0.01);AD模型训练组大鼠的CAI区海马神经元形态较AD模型对照组改善明显,神经元数目显著增加 (P<0.05);P-AMPK在AD模型训练组大鼠的表达明显增强,且主要在胞浆表达;与AD模型对照组相比,AD模型训练组大鼠的P-AMPK和Beclin-1的蛋白表达都明显增强(P<0.01),LC3II/LC3I比值明显增加(P<0.01)。〔结论〕 8周的跑台运动可明显改善AD模型大鼠的记忆能力、减少AD模型大鼠海马CAI区神经元损伤数量。其机制可能是8周运动训练激活AD模型大鼠海马神经元AMPK通路和自噬,进而保护神经元。
腺苷酸活化蛋白激酶; 阿尔茨海默病; 自噬; 运动
阿尔茨海默病(Alzheimer’s disease,AD)又称老年性痴呆,是一种与年龄相关的神经退行性疾病。AD会使患者遭受严重的痛苦,包括进行性记忆功能障碍,出现异常心理和行为症状,丧失独立生活能力等。AD的主要病理特征是以海马区神经元减少,β-淀粉样蛋白(β-amyloid,Aβ)异常折叠在神经元外形成的老年斑和Tau蛋白过度磷酸化在神经元内形成的神经纤维缠结为主,尤其是Aβ对神经元的毒性是其主要的致病因素之一[1]。以往的研究表明,适宜负荷的运动训练对防治AD有一定的效应[2]。流行病学调查研究认为,长期适宜负荷的体育锻炼可以明显改善AD患者的认知功能和生活自理能力。AD动物模型研究表明,对AD模型大鼠进行转笼、跑台等训练可改善其学习记忆能力,缓解AD脑组织病理学现象[3-4]。因此,适宜负荷的运动被认为是非药物干预AD的有效策略。但是,目前运动干预AD脑功能确切的细胞分子机制还不明确。腺苷酸活化蛋白激酶(Adenosine 5-monophosphate-activated protein kinase,AMPK)是生物能量代谢调节的关键分子,被称为机体的“能量感受器”,对ATP/AMP浓度变化、糖代谢及各种生长因子、饥饿、运动等刺激都非常敏感。已有研究表明,大脑能量代谢紊乱与AD的神经退行性病变密切相关,并且可能与早期认知功能障碍有关。所以,人们认为AMPK是干预AD的一种新的靶分子[5]。近年来,一种新的细胞死亡方式——自噬(autophagy),引起研究者广泛的注意,通过自噬途径可以降解功能障碍的细胞器和/或异常折叠的蛋白质,在维持细胞稳态方面发挥重要作用。研究表明,AMPK在细胞营养缺乏、能量降低、氧化应激时可激活自噬,其激活自噬途径主要是通过抑制哺乳动物雷帕霉素靶蛋白(mammalian target of rapamycin,mTOR)信号通路来实现的[6]。已有研究表明,激活AMPK可以降低神经元Aβ的产生,这种作用受多种机制介导,如白藜芦醇可以通过激活AMPK通路引发自噬,进而保护AD神经元[7]。但运动对AD神经元AMPK通路的影响及AMPK与神经元自噬的关系,目前研究还很少,其机制有待于进一步阐明。
本研究拟提出如下假说:适宜负荷的运动可激活AD脑组织AMPK信号分子和AD神经元自噬,从而保护AD神经元,改善大鼠的记忆能力。在此假说下,本文建立β-淀粉样蛋白海马区注射致AD大鼠运动干预模型,进而探讨运动对海马神经元AMPK信号分子及自噬的影响,可能为研究探索AD发病机制和治疗方案开辟新的思路。
1 实验材料与方法
1.1实验对象与分组
雄性2月龄SD大鼠50只,体重(206±12)g,由西安交通大学医学院动物实验中心提供(许可证号:SCXK(陕)2007-003)。国家标准啮齿类动物饲料喂养,自由饮食饮水。动物饲养环境:室温(24±1)℃,湿度30%~60%,自然光照。实验前,随机将大鼠分为4组:正常对照组(Normal Control Group,NC组),10只;运动对照组(Exercise Control Group,EC组),10只;AD模型对照组(Alzheimer Control Group,AC组),15只;AD模型训练组(Alzheimer Exercise Group,AE组),15只。
1.2实验造模
以大鼠海马区注射凝聚态Aβ25-35作为AD动物模型,可以较好地建立大鼠的AD记忆障碍模型。
NC组大鼠,按常规饲养,自由活动。
AC组和AE组大鼠,用2%戊巴比妥钠(40 mg/kg)腹腔注射麻醉;麻醉后固定于立体定位仪上,切开皮肤,找到前囟位置,参考大鼠图谱海马CAI所在部位体表投影位置,以电钻钻开一骨窗,将微量注射器固定在立体定位仪上,左右两侧各缓慢均匀注入5μl凝聚态Aβ25-35;完毕,留针5 min,然后缓慢撤针,术后缝合皮肤[8],常规饲养,青霉素肌注每日1次共5天,以防止感染。造模过程中AC组大鼠死亡4只,AE组大鼠死亡3只。造模结束后,AE组大鼠进行跑台训练,共8周。在本实验中,参照Bedford跑台训练方案[9]加以改动,因为(60%~70%)VO2max可以看做是中等负荷训练,但本实验对象是AD造模大鼠,体力较正常大鼠弱,所以我们在65% VO2max跑速的基础上将跑台速度下调,最终定为15 m/min,并在实验中通过观察大鼠的毛色、饮食、粪便、体重及运动能力来确定,确保大鼠不会出现疲劳症状。训练方案为:第1周,跑速10 m/min,30 min/d,6 d/周,周日休息;第2~4周,跑速15 m/min,45 min/d,6 d/周,周日休息;第5~8周,跑速15 m/min,60 min/d,6 d/周,周日休息。
EC组大鼠常规饲养,训练方案同AE组,也持续8周。
在训练期,AE组和EC组各有2只大鼠非正常死亡。
1.3SD大鼠行为学测试
Morris水迷宫是英国心理学家Morris于20世纪80年代初设计并应用于脑学习、记忆机制研究的一种实验手段,在AD研究中的应用非常普遍。实验前一天,将大鼠放入水中自由游泳2 min,使其熟悉迷宫环境。在实验第9周,采用Morris水迷宫检测各组大鼠定位航行和空间探索行为能力,判断各组大鼠学习记忆和空间记忆的认知能力:①定位航行实验,共5 d,将大鼠从标记的4个入水点依次朝向池壁轻轻放入水中,记录大鼠在120 s内寻找到并爬上平台所用时间,即逃避潜伏期;②空间探索实验,撤除平台,将大鼠放入水池中,记录大鼠在120 s内在平台所放置的目标象限停留时间和穿越平台所在区域的次数。
1.4海马CAI区Nissle染色
水迷宫测试结束后24 h,用10%的水合氯醛(30 mg/kg)腹腔注射麻醉大鼠,经升主动脉灌注肝素化的生理盐水250 mL,继4%多聚甲醛500 mL灌注。取海马置4%多聚甲醛溶液中后固定24 h,先后移入含20%、30%梯度蔗糖的新鲜固定液(4 ℃)中;待其沉底,恒冷箱切片机做冠状冷冻切片,片厚20μm;切片裱于经多聚赖氨酸处理过的玻片上,室温干燥;切片入蒸馏水,从70%酒精开始逐级上行至无水酒精脱脂,每级约2 min,再下行返回各级酒精;每级约2 min,最后入蒸馏水10 min×2;0.5%甲苯胺蓝(60 ℃)浸染60 min;水洗,梯度酒精分化、脱水;二甲苯透明,中性树脂封片,显微镜下观察。采用Image-pro Plus 6.0软件计数阳性染色像素总和,采用阳性染色像素计数总和反映脑片内存活的神经细胞。
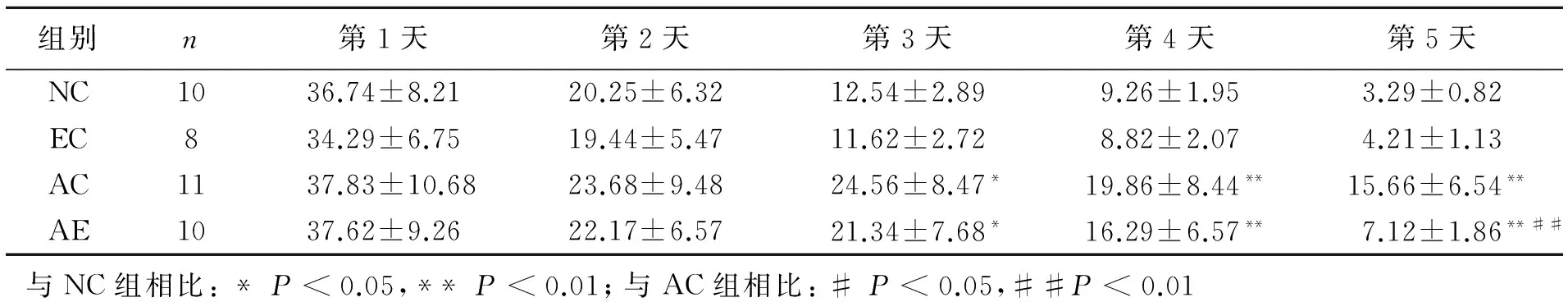
表1 各组SD大鼠Morris水迷宫逃避潜伏期(单位:s)
1.5海马CAI区P-AMPK免疫荧光染色
取材同上,石蜡切片,常规脱蜡至水。3%的H2O2去离子水孵育30 min, PBS清洗,抗原修复后血清封闭室温30 nin,倾去,勿洗。 滴加一抗(P-AMPK, 1∶400),4 ℃过夜。PBS冲洗,3 min×5次。滴加荧光二抗(羊抗兔CY3,1∶200),室温摇床孵育1 h,PBS洗脱,甘油封片,荧光显微镜下进行观察拍照。
1.6Western Blot 检测
实验结束24 h后,10%水合氯醛( 30 mg/kg) 腹腔注射麻醉大鼠,迅速断头取脑。切取海马置于预冷的细胞裂解液中,充分匀浆后冰上静置30 min;沸水中煮5 min,冰上冷却5 min,以12 000 r/min转速于4 ℃离心30 min;弃沉淀,留上清液。取小部分上清液用BCA法测定蛋白浓度,剩余上清液分装后置-80 ℃冰箱中待用。等量蛋白样品(50 μg)经12.5%的SDS聚丙烯酰胺凝胶电泳分离后,电转移至PVDF膜上。经5%脱脂奶粉室温下封闭1 h,分别用兔多抗P-AMPK(Thr172)、Beclin-1(1∶2 000)、鼠单抗LC3I/II(1∶2 000)、兔单抗β-action(1∶1 000)室温孵育1 h后,4 ℃过夜;TBST洗膜10 min×3次,分别加入相应的HRP结合的羊抗兔、羊抗鼠IgG (1∶2 000)室温孵育1 h;TBST洗10 min×3次,加入ECL发光液1 min后于暗室内进行胶片曝光、显影、定影、晾干。实验重复3次,β-action作为内参照,以目的条带与内参的吸光度比值表示蛋白表达,应用Bandscan.5.0进行分析。
1.7统计学分析

2 实验结果
2.1SD大鼠行为学测试结果
2.1.1各组SD大鼠定位航行实验结果
如表1所示,定位航行实验结果显示,各组大鼠的Morris水迷宫逃避潜伏期随实验时间的增加都有下降的趋势。在实验的第3、4、5天,AC组和AE组逃避潜伏期与NC组比较,明显增加(P<0.05,P<0.01),表明这两组大鼠空间记忆能力显著下降。在实验的第5天,AE组逃避潜伏期与AC组比较,明显降低(P<0.01),表明AE组大鼠的空间记忆能力较AC组要显著增强。
2.1.2各组SD大鼠空间探索成绩比较
各组大鼠的Morris水迷宫空间探索实验成绩如表2所示。与NC组相比,AC组在目标象限停留的时间明显降低(P<0.01),穿越原平台位置次数也显著减少(P<0.01),表明AC组大鼠的空间探索能力与NC组相比明显减弱。与AC组比较,AE组在目标象限停留的时间明显变长(P<0.05),穿越原平台位置的次数也显著增加(P<0.01),表明AE组大鼠的空间探索能力与AC组比较有显著提高。
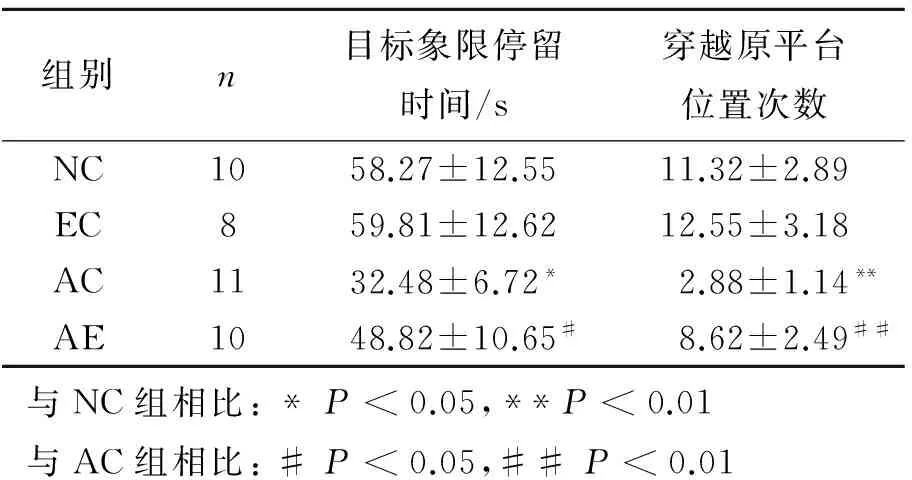
表2 各组SD大鼠Morris水迷宫空间探索实验成绩
2.2SD大鼠海马CAI区神经元Nissle染色结果
Nissle染色结果如图1所示:NC组与EC组神经元饱满,细胞边界清晰,细胞排列紧密,尼氏小体染色均匀,细胞核无固缩现象;AC组神经元排列稀疏,细胞边界模糊,细胞核出现大量固缩(见白色箭头),尼氏小体着色不匀,部分细胞已解体;AE组神经元部分细胞核也出现固缩,但尼氏小体较AC组着色相对均匀,细胞排列也较清晰、紧密。

图1 各组SD大鼠海马CA1区Nissle染色图
对神经元尼氏体染色阳性细胞的计数结果见表3:AC组CAI区海马神经元数目较NC组显著减少(P<0.01),AE组神经元数目较NC组也显著减少(P<0.05),但AE组较AC组神经元数目显著增加(P<0.05)。此结果表明,AE组神经元形态及存活数量较AC组明显改善。

表3 各组海马CAI区神经元计数(个)
2.3大鼠海马CA1区P-AMPK免疫荧光染色结果
对海马CAI区神经元P-AMPK进行免疫荧光染色,胞浆红染为P-AMPK阳性细胞,结果如图2所示:P-AMPK在AE组表达明显增强,且主要在胞浆表达,而在AC组P-AMPK表达很弱,NC组、EC组P-AMPK表达介于二者之间。此结果表明,AE组海马神经元P-AMPK被激活。

图2 各组SD大鼠海马CAI区P-AMPK免疫荧光染色图
2.4Western Blot检测结果
Western Blot检测结果(见图3、图4、图5)显示:与NC组比较,AC组P-AMPK蛋白表达明显降低(P<0.01),AE组P-AMPK表达较NC组和AC组明显增强(P<0.01)。此结果与荧光染色结果相同。AE组LC3II/LC3I比值较NC组和AC组明显增强(P<0.01),其余三组LC3II/LC3I比值无显著性差异。与NC组相比,EC组和AE组Beclin-1蛋白表达明显增强(P<0.01),AC组Beclin-1蛋白表达明显降低(P<0.01);与AC组相比,AE组Beclin-1蛋白表达明显增强(P<0.01)。

图3 SD大鼠海马P-AMPK蛋白相对表达量

图4 SD大鼠海马LC3II/LC3I蛋白相对表达量

图5 SD大鼠海马Beclin-1蛋白相对表达量
3 讨论
3.1跑台训练对AD模型大鼠记忆和神经元病理改变的影响
AD作为一种病理机制尚未完全明确的神经退行性疾病,是神经学科研究的热点之一,目前还无有效的治疗手段。在AD的非药物治疗方案中,运动干预由于其有效性和经济性受到广泛关注。
流行病学调查显示,对一定人群的AD患者给予不同负荷的运动刺激后发现,经常参与体育运动的老年人患老年性痴呆的危险较低,中等负荷的体育运动可以防止老年人认知功能下降,改善AD 患者的认知功能[10-11]。通过建立AD动物模型,并进行一定强度的运动干预也表明[12],运动可以改善AD动物模型的记忆功能。
近年来的研究表明,适宜负荷的运动训练对AD大鼠模型的学习记忆能力有不同程度的提高。Wang等[13]的研究证明,通过脑室内注射Aβ制作的AD大鼠模型给予12 d的转笼训练后,Y型迷宫成绩明显提高,神经元丢失和突触数目减少都明显缓解。Kang等[14]也证实,海马区注射Aβ的AD大鼠模型经过跑台训练后,旋臂水迷宫的学习记忆能力明显提高。选择一种合适的运动干预方案对AD的干预治疗是至关重要的,针对AD病人一般年龄偏高,体力较差,只适合参与轻度或中等负荷的体力活动。因此,在本实验中我们对AD大鼠的运动干预方案选择中等负荷的跑台训练。
我们借鉴前人的研究方案,通过大鼠海马区注射凝聚态Aβ25-35建立AD大鼠模型,发现AD大鼠的逃避潜伏期与正常大鼠相比明显变长,目标象限的停留时间和穿越平台次数与正常大鼠比较也明显变短和变少。这些结果都表明AD大鼠的近期记忆能力下降明显,也与我们前面的研究结果类似[15],说明本次造模在行为学上是成功的。
进一步,我们观察到经过8周的跑台运动训练后发现,AD大鼠行为学指标明显改善,其学习记忆能力得到显著提高,这表明本实验选取的运动强度和负荷可以改善AD大鼠的学习记忆能力。AD患者不但有渐进性记忆障碍,还有非常明显的病理学改变,除经典的老年斑外,还有突触丢失和神经元丢失,而海马区被认为是与学习记忆关系最为密切的脑功能区,海马神经元丢失引起的细胞突触减少是记忆功能下降的病理基础。
在本实验中,我们观察到AD大鼠海马CAI区神经元受损严重,表现为尼氏小体着色不均匀,核固缩等凋亡现象,以致神经元丢失,而AD训练组大鼠的海马CAI区尼氏小体形态与AD模型组比较明显改善,AD训练组神经元存活数量也明显多于AD模型组。这表明,适宜负荷的运动刺激可以改善神经元的生存环境、促进神经元的活性。但适宜运动的刺激如何保护AD神经元的丢失,是我们比较关心的问题。在本实验中,我们选择对运动刺激敏感的AMPK信号分子及与神经元丢失密切相关的细胞自噬两个点进行研究。
3.2运动对AD神经元AMPK和自噬的影响
AMPK是一个由α、β、γ三个亚基组成的蛋白激酶,其α亚基在海马神经元中的表达较高。目前普遍认为,AMPK的α亚基中苏氨酸172位点的磷酸化是AMPK活化的关键[16],而运动被认为是生理条件下对AMPK激活最为显著的因素之一[17],关于运动对AMPK信号通路的认识主要集中在骨骼肌方面。一种观点是,类似耐力运动的刺激会选择性激活AMPK通路,从而抑制mTOR的活性,减少蛋白质的合成[18]。关于运动调节AD神经元AMPK/mTOR信号通路的研究还很少,考虑到耐力训练可以激活骨骼肌AMPK信号,那么运动是否可以激活AD脑神经元AMPK信号通路?这是我们非常感兴趣的问题。
在本研究中,免疫荧光染色和蛋白定量实验都显示:与AD模型组大鼠比较,AD训练组大鼠海马神经元中磷酸化的AMPK表达明显增强, 甚至AD训练组大鼠磷酸化的AMPK表达都明显高于对照组和正常训练组大鼠。这表明,运动刺激对AD神经元AMPK的激活是非常显著的。AMPK激活后可引起一系列下游生理事件的发生,AMPK的下游信号分子很多,其中AMPK/mTOR信号通路引起的自噬可能对AD神经元的凋亡和存活产生重要影响。
自噬既是细胞的一种自杀现象,也是一种蛋白质降解机制,多是细胞处于饥饿、能量匮乏、温度升高等各种病理状态下的一种崩解。崩解产生的各种细胞碎片又能重新被细胞利用,所以自噬会消灭一些对机体造成损伤的细胞,适度的自噬可对机体起到保护作用。但自噬过度又会造成正常细胞的死亡,所以自噬是一把“双刃剑”,如何合理有效地利用细胞的自噬现象是我们寻找治疗疾病的关键。
目前,关于运动对神经元AMPK与自噬调节的文献非常匮乏,而运动通过调节AMPK与自噬对AD影响的研究还未见到。
微管相关蛋白1轻链3(microtubule associated protein 1 light chain 3,MAP1-LC3)是酵母自噬相关基因8的哺乳动物同源体,是哺乳动物细胞典型的一种自噬体标志物。在自噬状态下,LC3-I会转变为一种膜结合形式即LC3-II。因此,常用LC3-II/LC3-I比值来衡量自噬活性,其比值升高提示自噬活性加强。哺乳动物Beclin-1是酵母自噬相关基因6的同源物,Beclin-1与自噬吞噬小泡的形成初期有关,是自噬的发起者,Beclin-1也常作为自噬体形成的重要的正调节因子[19]。
在本研究中我们发现,AD训练组大鼠神经元LC3-II/LC3-I比值及Beclin-1表达较对照组和AD模型组均升高,自噬发生的标志性蛋白LC3-II和Beclin-1表达均增加。这提示本研究的运动负荷可诱导AD大鼠海马神经元自噬的产生,而在观察到LC3-II和Beclin-1表达增加的同时,我们还观察到AD训练组神经元AMPK的活化。由此可见,AD神经元AMPK的活化与神经元的自噬有着密切的关系,而活化的AMPK如何引起自噬或通过下游的何种信号通路激活自噬还有待进一步研究。
我们还发现,AD模型组大鼠的Beclin-1表达明显低于对照组。可能是本实验模型下AD大鼠海马神经元发生自噬之前,神经元已经大量死亡,而运动能强烈刺激神经元自噬体的产生,从而清除衰老及受损神经元,保护正常神经元活性,表现为训练组AD大鼠神经元存活数量明显多于AD模型组大鼠。
祖靓等[20]发现力竭运动即刻后,小鼠骨骼肌AMPK活性明显提高,细胞的自噬水平也显著增加,提出力竭运动可以通过AMPK途径显著提高骨骼肌细胞自噬水平。丁树哲等[21]认为,适宜强度的运动训练可通过上调细胞自噬水平,为细胞再生提供一定的能量与合成底物,而自噬的过度激活则会导致细胞损伤或疲劳,甚至可能诱发自噬性细胞死亡,所以运动强度的选择是激发自噬水平的关键。在AD神经元中,适度的自噬现象可减少正常神经元的丢失,已有研究表明[22],一种药物如白藜芦醇可通过激活AMPK进而提高AD神经元自噬,改善神经元的功能。姜宁等[23]也发现,早期运动训练可初步启动中脑和纹状体自噬,进而改善中脑和纹状体线粒体功能。
4 结论
本研究发现,8周的跑台运动可明显改善AD模型大鼠的记忆能力,减少AD模型大鼠海马CAI区神经元损伤数量。其机制可能是8周运动训练激活AD大鼠海马神经元AMPK通路,引起神经元自噬,进而保护神经元。
[1] Rao R V, Bredesen D E. Misfolded proteins, endoplasmic reticulum stress and neurodegeneration[J]. Curr Opin Cell Biol, 2004,16(6):653-662.
[2] Perez C A, Cancela C J M. Benefits of physical exercise for older adults with Alzheimer's disease[J]. Geriatr Nurs, 2008,29(6):384-391.
[3] Albeck D S, Sano K, Prewitt G E, et al. Mild forced treadmill exercise enhances spatial learning in the aged rat[J]. Behav Brain Res, 2006,168(2):345-348.
[4] Nichol K E, Parachikova A I, Cotman C W. Three weeks of running wheel exposure improves cognitive performance in the aged Tg2576 mouse[J]. Behav Brain Res, 2007,184(2):124-132.
[5] Liu X, Yuan H, Niu Y, et al. The role of AMPK/mTOR/S6K1 signaling axis in mediating the physiological process of exercise-induced insulin sensitization in skeletal muscle of C57BL/6 mice[J]. Biochim Biophys Acta, 2012,1822(11):1716-1726.
[6] Viana R, Aguado C, Esteban I, et al. Role of AMP-activated protein kinase in autophagy and proteasome function[J]. Biochem Biophys Res Commun, 2008,369(3):964-968.
[7] Park SJ, Ahmad F, Philp A, et al. Resveratrol ameliorates aging-related metabolic phenotypes by inhibiting cAMP phosphodiesterases[J]. Cell, 2012,148(3):421-433.
[8] 徐海伟,黎海蒂,范晓棠,等. AD大鼠模型的制备及行为学和超微结构研究[J]. 中国行为医学科学,2003,12(2):123-124.
[9] Bedford T G, Tipton C M, Wilson N C, et al. Maximum oxygen consumption of rats and its changes with various experimental procedures[J]. J Appl Physiol Respir Environ Exerc Physiol, 1979,47(6):1278-1283.
[10] Ludlow A T, Ludlow L W, Roth S M. Do telomeres adapt to physiological stress Exploring the effect of exercise on telomere length and telomere-related proteins[J]. Biomed Res Int, 2013,2013(13):60-68.
[11] Malchow B, Schmitt A, Falkai P. Physical activity in mental disorders[J]. MMW Fortschr Med, 2014,156(1):41-43.
[12] La Rue A, Felten K, Duschene K, et al. Language-enriched exercise plus socialization for older adults with dementia: translation to rural communities[J]. Semin Speech Lang, 2013,34(3):170-184.
[13] Wang Q, Xu Z, Tang J, et al. Voluntary exercise counte-racts Abeta25-35-induced memory impairment in mice[J]. Behav Brain Res, 2013, 256(2):618-625.
[14] Kang EB, Kwon IS, Koo JH, et al. Treadmill exercise represses neuronal cell death and inflammation during Abe-tainduced ER stress by regulating unfolded protein response in aged presenilin 2 mutant mice[J]. Apoptosis, 2013,18(11):1332-1347.
[15] 刘涛. 运动对内质网应激诱导阿尔茨海默病模型大鼠海马细胞凋亡的影响[J]. 体育科学,2012,32(4):72-76.
[16] Stein S C, Woods A, Jones NA, et al. The regulation of AMP-activated protein kinase by phosphorylation[J]. Biochem, 2000,345(3):437-443.
[17] Richter E A, Ruderman NB. AMPK and the biochemistry of exercise: implications for human health and disease[J]. Biochem, 2009,418(2):261-275.
[18] Chen Z P, Stephens T J, Murthy S, et al. Effect of exercise intensity on skeletal muscle AMPK signaling in humans[J]. Diabetes, 2003,52(9):2205-2212.
[19] Lee J A, Gao FB. Regulation of Abeta pathology by beclin 1: a protective role for autophagy[J]. J Clin Invest, 2008,118(6):2015-2018.
[20] 祖靓,朱荣. 力竭运动对小鼠骨骼肌细胞自噬的影响及相关调节机制研究[J]. 体育科学,2013,33(9):77-84.
[21] 钱帅伟,罗艳蕊,漆正堂,等. 细胞自噬的分子学机制及运动训练的调控作用[J]. 体育科学,2012,32(1):64-70.
[22] Vingtdeux V, Giliberto L, Zhao H, et al. AMP-activated protein kinase signaling activation by resveratrol modulates amyloid-beta peptide metabolism[J]. J Biol Chem, 2010,285(12):9100-9113.
[23] 姜宁,曹玮,宋超,等. 早期运动训练对帕金森小鼠中脑和纹状体的影响:自噬与线粒体动力学关系的研究[J]. 中国运动医学杂志,2012,31(2):134-139,128.
[责任编辑李麦产]
Effect of exercise intervention on Alzheimer’s disease model and memory and neuron of rat AMPK signaling molecules and autophagy
GUO Chunyang1, LIU Tao2, LI Ming1
1. Institute of Student Fitness and Health, Henan University, Henan Kaifeng 475001, China; 2. Department of Healthy Science, Xi’an Physical Education University, Xi’an 710068, China
〔Objective〕To investigate the effects of exercise intervention on Alzheimer’s disease model and memory and neuron of rat AMPK signaling molecules and autophagy.〔Methods〕60 male SD rats were randomly divided into normal control group, exercise group, AD control group, AD training group. Model of rathippocampus to bilateral injection of Aβ25-35manufacturing AD under stereotactic instrument. After the experiment through the test of Morris water maze learning and memory ability of rats in each group, the Nissle method for the detection of hippocampal neuron survival; immunofluorescent staining was used to detect the expression of phosphorylated AMPK expression; Western blot method to detect P-AMPK, LC3I, LC3II and Beclin-1.〔Results〕Compared with AD control group, AD training group escape latency of rats increased significantly, space exploration results significantly decreased, the decrease in the number of surviving neurons in hippocampus, the expression of P-AMPK and Beclin-1 decreased, but the ratio of LC3II/LC3I had no change; Compared with AD control group, the rats of AD training group behavior index were significantly improved, a marked increase in the number of hippocampal neuron survival the expression of P-AMPK, LC3II/LC3I, Beclin-1 and ratios were significantly increased. 〔Conclusion〕8 weeks of treadmill exercise can improve the memory ability of AD rats, reduce the number of neurons in CAI area of hippocampus injury in rats AD model. The mechanism may be the expression of exercise training for 8 weeks to activate AD neurons of rat in the phosphorylation of AMPK, then cause neuronal autophagy to protect normal neurons.
AMPK; Alzheimer’s disease; autophagy; exercise
1672-7606(2016)03-0182-07
2016-06-05
陕西省教育厅自然科学研究计划项目(2013JK0777)
郭春阳(1973-),男,河南上蔡人,博士,副教授,硕士生导师,从事运动医学教学与科研工作。
R339.1
A

