恩替卡韦分散片的质量检查及溶出度对比研究
袁 慧,徐小明,张欣欣,史 琼,程铁峰
河南大学 药学院,河南 开封 475000
恩替卡韦分散片的质量检查及溶出度对比研究

河南大学 药学院,河南 开封 475000
〔目的〕 制备恩替卡韦分散片,对自制分散片进行质量检查,并与市售恩替卡韦分散片进行体外溶出曲线比较研究。〔方法〕 以微晶纤维素为稀释剂、60 g/L PVPK30水溶液为黏合剂、PVPP为崩解剂、欧伦包衣预混液为包衣材料,制成恩替卡韦分散片,并对自制分散片进行一系列质量检查。以0.05 mol/L的磷酸二氢钠为溶出介质,用小杯法测定了自制分散片与市售分散片在介质中的溶出曲线。〔结果〕 自制恩替卡韦分散片的质量符合要求,其体外溶出度符合《中国药典》(2015 年版)的规定。〔结论〕 制备的恩替卡韦分散片外观良好、质量符合标准,比市售分散片的体外溶出略快,且制备工艺简单。
恩替卡韦;分散片;溶出度
乙肝病毒感染已经成为全球性危害,慢性乙肝可导致肝硬化、肝癌及肝功能衰竭。我国有数以亿计的乙肝患者和病毒携带者,全球每年因乙肝相关疾病的死亡人数高达百万之多[1-2]。恩替卡韦(entecavir)是一种强效选择性鸟嘌呤核苷类似物,具有显著的抗乙型肝炎病毒(HBV)的活性[3]。经证实,恩替卡韦具有显著的病毒抑制作用,几乎没有副作用且耐药性低,在慢性乙型肝炎的治疗中有很好的临床应用前景[4-5]。因恩替卡韦为难溶性药物,往往因溶出度不好而影响了体内生物利用度[6-7],所以克服其难溶性问题使其快速溶解成了至关重要的问题。考虑到分散片可以使药物快速崩解,能够解决药物溶出时间慢这一问题,且目前在国内获批的恩替卡韦的制剂不多,进口的恩替卡韦在境内的售价较高[8],我们试验制备恩替卡韦分散片,并对其进行了质量检查。
1 仪器与试药
1.1仪器
ZRC-8D智能溶出试验仪(天津创兴电子设备制定有限公司),AB204-S电子天平(瑞士梅特勒-托利多),KQ-5200DB超声波清洗器(昆山市超声仪器有限公司),ZP19压片机(上海天和制药机械厂)。
1.2试药
恩替卡韦(北京贝丽莱斯生物化学有限公司),恩替卡韦分散片(正大天晴药业集团股份有限公司),乳糖(德国美剂乐股份有限公司),微晶纤维素(MCC,湖州展望药业有限公司),交联聚乙烯吡咯烷酮(PVPP,湖州展望药业有限公司),聚乙烯吡咯烷酮(PVPK30,湖州展望药业有限公司),硬脂酸镁(湖州展望药业有限公司),欧伦薄膜包衣预混材料(温州小伦包衣技术有限公司)。
2 恩替卡韦分散片的处方工艺
采用湿法制粒。分别称取一定量的恩替卡韦、MCC、PVPP,过60目筛,采用等量递加法进行混合;加入60 g/L的PVPK30水溶液制软材,过40目筛,制湿颗粒;50 ℃烘干60 min,加入硬脂酸镁,过40目筛,整粒,压制成0.1 g片。将3 g欧伦薄膜包衣预混材料加入到18.5 g水中,制成包衣液;包衣。
3 恩替卡韦分散片的质量检查
3.1溶液的制备与波长的选择
3.1.1标准储备液的制备用电子天平精密称取恩替卡韦原料药5 mg,置50 mL的容量瓶中,用0.05 mol/L的磷酸二氢钠溶液定容至刻度;溶解混匀,得100 μg/mL的储备液。
3.1.2供试品溶液及空白辅料溶液的制备精密吸取恩替卡韦储备液1 mL,置10 mL容量瓶中;加入0.05 mol/L的磷酸二氢钠溶液(pH=6.8)适量,振摇使其溶解并稀释至刻度;摇匀,过滤即得供试品溶液。
称取不含奥氮平的空白辅料适量,同法配制成空白辅料溶液。
3.1.3波长的选择在200~400 nm波长内,对供试品溶液和空白辅料溶液进行紫外全波长扫描,结果见图1。

图1 紫外吸收光谱
由图1可知,恩替卡韦在254 nm处有最大吸收,空白辅料在254 nm处没有紫外干扰,所以用紫外分光光度法测定含量方法准确可行。
3.1.4标准曲线的绘制
用移液管精密吸取双环醇贮备液0.6,0.8,1.0,1.2,1.4,1.6 mL,置10 mL容量瓶中,用甲醇稀释成6,8,10,12,14,16 μg/mL的对照品溶液。分别按紫外分光光度法在254 nm波长处进行测定。以吸光度为纵坐标、浓度为横坐标绘制校准曲线。如图2所示,进行回归分析,得回归方程(n=5):
y=0.042 7 x-0.009 51,
R2=0.999 11。
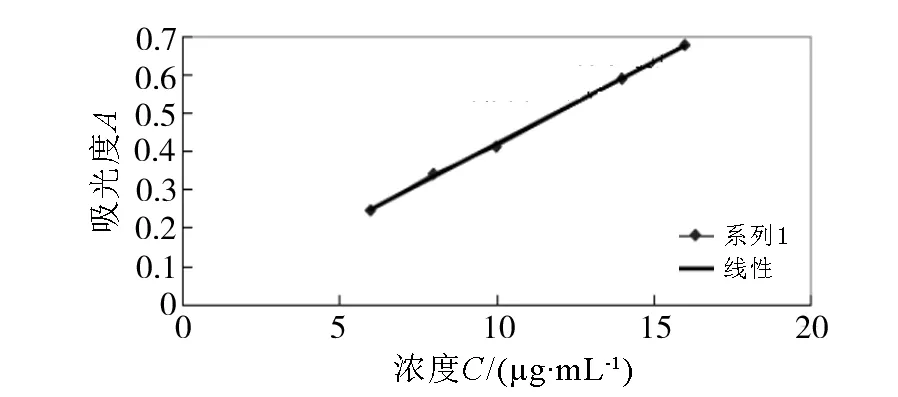
图2 恩替卡韦溶液的标准曲线
结果表明,恩替卡韦浓度在6~16 μg/mL范围内,与吸光度呈良好的线性关系。
3.2恩替卡韦分散片的物理性能检查
3.2.1分散片的外观性状自制分散片色泽均匀,完整光洁,无杂斑,无异物,有良好的外观性状。
3.2.2分散片硬度的检查用硬度测试仪进行压力考察,发现自制恩替卡韦分散片的平均压力为50 N。
3.2.3分散均匀性的检查将自制恩替卡韦分散片分别放入盛有蒸馏水和盛有磷酸二氢钠(0.05 mol/L,pH=6.8)的三角瓶中。振摇1 min,均崩解完全;振摇3 min,均能过十八目筛。结果显示,自制恩替卡韦分散片的分散均匀性符合要求,分散均匀性良好。
3.3自制分散片与市售分散片的溶出度比较
取自制的恩替卡韦分散片和某厂家生产的恩替卡韦分散片,以及恩替卡韦片,按照溶出度测定法(中国药典2015年版四部通则0931溶出度与释放度测定法第三法),以0.05 mol/L的磷酸二氢钠溶液50 mL为溶剂,转速为50 r/min,依法操作,经3,15,60 min取溶液2 mL,过滤。取续滤液,作为供试溶液[10]。按照紫外分光光度法于254 nm处测定吸光度,以60 min时作为完全溶出点,计算在取样点是分散片的溶出度,溶出曲线见图3。
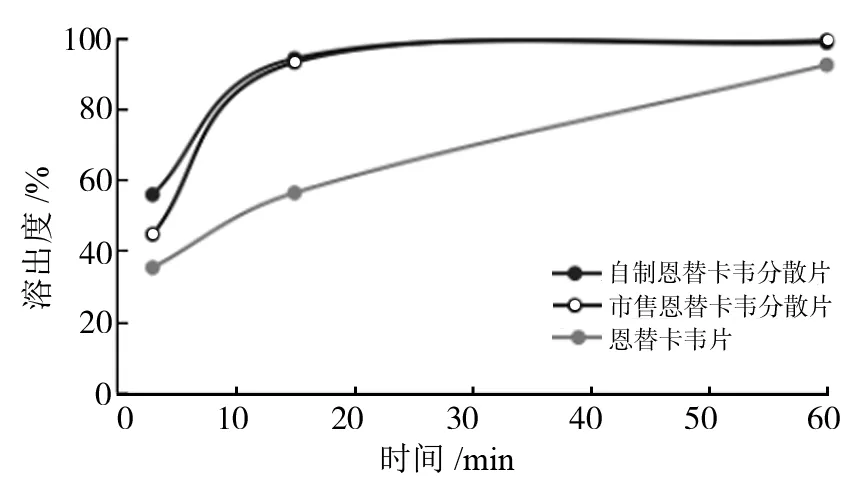
图3 自制片与市售片的溶出曲线对比
由图3可知:在3 min时,自制恩替卡韦分散片的溶出度在55%以上,比市售分散片的溶出度高约10%,比恩替卡韦普通片的溶出度高出20%左右;在15min时,自制恩替卡韦分散片的溶出度也均可达90%以上,与市售分散片的溶出度相似。
3.4自制分散片的含量均匀度检查
取自制恩替卡韦分散片,研碎,置容量瓶中,用分散介质溶解,检测其含量。经检查供试品的含量均匀度符合规定。
4 结论
恩替卡韦具有显著的抗乙型肝炎病毒活性,是一种最新抗乙肝病毒的一线药物。因其为难溶解性药物,恩替卡韦片的溶出度不好,对药物的临床使用造成的一定影响,将其制成分散片可加快药物崩解时间提高溶出速度。实验结果显示,我们自制的恩替卡韦分散片与市售恩替卡韦分散片的溶出行为相似并比市售恩替卡韦分散片的溶出速度略快,比恩替卡韦普通片的溶出速度高出许多,其一系列质量检测结果较好,符合中国药典的要求。自制恩替卡韦分散片使药物快速崩解,加快药物溶出时间,改善了难溶性药物吸收差这一问题,所以恩替卡韦分散片的研制具有其实际意义。
[1] 李荣东,乔娟,王福东,等. 抗乙肝病毒药物恩替卡韦的合成[J]. 中南药学,2008,6(3):292-295.
[2]蔡皓东,马秀云,崔振宇. 新核苷类药物治疗乙肝的研究现状及展望[J]. 药物不良反应杂志,2004,6(1):1-8.
[3] Sherman M, Yurdaydin C, Sollano J. Entecavir fortreatment of lamivudine-refractory, HBeAg-positive chronic hepatitis B[J]. Gastroenterology, 2006,130(7):2039-2049.
[4]韩晋,易毛,吴荣荣,等. 恩替卡韦分散片的处方工艺研究[J]. 中国药学杂志,2009,44(22):1718-1722.
[5] Fabien Zoulim F. Entecavir: A new treatment option for chronic hepatitis B[J]. J Clin Virol, 2006,36(1):8-12.
[6] 吴素体,李正明,韩晋,等. 恩替卡韦分散片的溶出度测定[J]. 解放军药学学报,2012,28(1):60-62.
[7] 徐文峥,严洪兵,丁强. 恩替卡韦片的制备及其体外溶出曲线研究[J]. 中国现代应用药学,2011,28(6):545-547.
[8] 王彩娟. 抗乙肝病毒药物市场前景分析[J]. 世界临床药物,2007,28(7):444-448.
[责任编辑李武营]
Study of entecavir dispersible tablets quality inspection and contrast dissolution

Henan University Institute of Pharmacy, Henan Kaifeng 475000, China
〔Objective〕To prepare entecavir dispersible tablets, make quality inspection on self-made tablets and compare the dissolution curves of self-made and market available entecavir dispersible tablets. 〔Methods〕Entecavir dispersible tablets were prepared using MCC, PVPP, PVP K30 and European Lun coating. A series of quality inspection put on entecavir dispersible tablets.The solubility of the market available entecavir tablets and self-made tablets respectively were compared in 0.05 mol/L NaH2PO4as dissolution medium. The dissolution of entecavir dispersible tablets was determined by cup method.〔Results〕The self-made entecavir dispersible tablets compliance with legal quality. The dissolution of entecavir dispersible tablets was determined by cup method. Dispersible tablets in vitro dissolution comply with the regulations of the 2015 Chinese Pharmacopoeia.〔Conclusion〕Entecavir dispersible tablets have external characteristics, conform to the standard and preparation technology is simple. The dissolution profiles of self-made entecavir tablets are faster as that of market available ones.
entecavir; dispersible tablets; dissolution
1672-7606(2016)03-0175-03
2016-04-17
河南省高等学校重点科研项目(15A360012)。
袁慧(1992- ),女,河南新郑人,硕士研究生,从事药物新剂型的研究工作。
R927.1
A
程铁峰(1972- ),男,河南兰考人,博士,副教授,从事纳米载药系统与新型制剂和新药药物动力学研究工作。

