不同成因DIC临床表现及转归与患者凝血指标和临床评分的关系
杨 婷 高清平
不同成因DIC临床表现及转归与患者凝血指标和临床评分的关系
杨婷高清平*
目的:分析不同成因弥散性血管内凝血(DIC)的临床表现及转归与患者凝血指标和临床评分的关系。方法:485例DIC患者,依据原发病分为感染组(n=208)、手术创伤组(n=94)、恶性肿瘤组(n=105)、病理产科组(n=22)、严重肝病组(n=48)和器官功能损伤组(n=8),比较各组患者临床表现和不同治疗方案(对症支持治疗、替代治疗、抗凝治疗)的临床疗效;分析不同疗效(有效、无效)DIC患者凝血酶原时间(PT)、活化部分凝血活酶时间(APTT)、纤维蛋白原(FIB)、D-二聚体(D-D)、血小板计数(PLT)和国际血栓与止血学会(ISTH)DIC显性积分分值(5分、6分、7分、8分)分布的差异,以及凝血指标和显性积分与DIC患者临床疗效的相关性。结果:不同成因DIC组患者出血、休克、器官衰竭发生率及疗效有明显差异;病理产科组出血发生率最高(72.73%),但与合计出血发生率(65.36%)差异无统计学意义(P>0.05);手术创伤组休克发生率最高(79.79%),且高于合计休克发生率(68.04%)(P<0.05);感染组器官衰竭发生率最高(95.19%),但与合计器官衰竭发生率(91.55%)差异无统计学意义(P>0.05);病理产科组治疗有效率最高(59.09%),明显高于合计有效率(25.15%)(P<0.05);严重肝病组治疗无效率最高(83.33%),但与合计无效率(74.85%)差异无统计学意义(P>0.05);恶性肿瘤组死亡率最高(52.38%),明显高于合计死亡率(41.86%)(P<0.05)。替代治疗和抗凝治疗有效率明显高于对症治疗(P<0.05),且替代治疗和抗凝治疗两者疗效差异无统计学意义(P>0.05)。治疗有效组PT、APTT及D-D低于无效组(P<0.05),FIB高于无效组(P<0.05);PT、APTT缩短及D-D降低与患者治疗有效率呈负相关(r=-0.256、-0.202、-0.116,均P<0.05)。FIB升高与患者治疗有效率呈正相关(r=0.102,P<0.05)。治疗有效组病例ISTH各级显性积分的分布显著小于治疗无效组(P<0.01),且随ISTH显性积分(6-8分)升高,治疗有效率降低,两者呈明显负相关 (r=-0.150,P<0.05)。结论:DIC转归不甚乐观,合理应用凝血指标和ISTH显性积分的监测作用对临床提高疗效和改善预后有益。
弥散性血管内凝血;凝血指标;临床评分;转归
弥散性血管内凝血(DIC)是一种复杂的临床病理综合征,主要继发于严重感染、恶性肿瘤、病理产科等,通过激活凝血系统导致纤维蛋白沉积和血栓形成,同时由于血小板和凝血因子的消耗又可能导致出血,其发生发展涉及促凝、纤溶、抗凝、炎症和内皮功能等多个环节,可表现为难以纠正的微循环障碍、多发微血管栓塞、微血管病性溶血及多部位自发性出血,临床预后亟待改善。采用凝血指标和国际血栓与止血学会(ISTH)临床评分有利于尽早发现、诊断和治疗DIC,提高治愈率。故此,本文回顾性分析不同成因DIC的临床表现、治疗特点和转归情况以及不同转归与凝血指标和ISTH显性积分的关系,为临床救治提供借鉴和参考。
1 资料与方法
1.1对象和分组
2009-06—2014-11本院收治的DIC患者485例,其中男298例,女187例,年龄4-89岁,平均52.0±18.0岁。诊断符合DIC诊断与治疗中国专家共识[1],排除因原发性疾病使用抗凝药物、严重肾病或肝功能达Child C级等患者。按不同原发疾病分为感染组(n=208),包括脓毒症、肺部感染、神经系统感染、胆道感染、腹膜炎、尿路感染、感染性心内膜炎、术后感染、流行性出血热、肾病综合征出血热、EB病毒感染及混合感染等;手术创伤组(n=94);恶性肿瘤组(n=105),包括消化道肿瘤、血液恶性肿瘤、妇科肿瘤、泌尿系肿瘤、颅内肿瘤、鼻咽癌、喉癌、肺癌及骨肉瘤;病理产科组(n=22),包括产后出血、流产、异位妊娠、前置胎盘、死胎、羊水栓塞及妊娠合并肝炎;严重肝病组(n=48)和器官功能损伤组(n=8)。比较各组临床表现特点和转归。根据不同治疗方案,分为对症支持治疗组(n=79)、替代治疗组(n=370)及抗凝治疗组(n=36),比较各治疗方案组的临床疗效。根据临床疗效分为有效组(n=122)和无效组(n=363),分析两组凝血指标的差异;ISTH评分≥5共451例,将其根据临床疗效分为有效组(n=112)和无效组(n=339),分析两组凝血指标的差异及ISTH显性积分分布(5分、6分、7分、8分)的差异。
1.2检测指标和方法
1.2.1凝血指标测定:485例DIC患者均于治疗前抽取肘静脉血6ml,其中3ml EDTA抗凝,混匀后,采用日本Sysmex公司XE2100型全自动血细胞分析仪及配套试剂进行血小板计数(PLT);另3ml枸橼酸钠抗凝,3 500r/min离心5min取血浆,采用日本Sysmex公司CA7000型全自动凝血分析仪及配套试剂检测凝血酶原时间(PT)、活化部分凝血活酶时间(APTT)、纤维蛋白原(FIB)浓度及D-二聚体(D-D)水平。所有检测均在2h内完成。
1.2.2ISTH评分:参照ISTH提出的诊断DIC的显性积分方法[2]:(1)PLT>100G/L计0分,≤100G/L计1分,≤50G/L计2分;(2) D-D<1mg/L计0分,1-3mg/L计 2分,≥3mg/L计3分[3];(3)PT较对照延长<3s计0分,≥3s计1分,≥6s计2分;(4)FIB>1.0g/L计0分,≤1.0g/L计1分。每病例总分值为上述4项评分之和,其≥5分为DIC可能,<5分不是或不确定DIC。
1.3治疗方法和临床疗效判断
1.3.1治疗方法:积极治疗原发病,如感染患者尽早合理使用抗生素;手术、创伤患者及时手术,防治术后并发症;肿瘤患者进行放、化疗或病灶切除;病理产科患者适时终止妊娠;严重肝病患者予以抗病毒、护肝治疗;器官功能损伤患者予以积极脏器保护;有活动性出血或需进行有创操作等高出血风险患者予以替代治疗,如输注血小板、新鲜冰冻血浆或普通冰冻血浆、冷沉淀及FIB等;部分DIC患者早期采用肝素或低分子肝素抗凝治疗;部分患者仅给予对症支持治疗,如抗休克、改善缺氧、纠酸碱及维持水、电解质平衡等。
1.3.2 疗效判断:参照《血液病诊断及疗效标准》[4]。痊愈:引起DIC的基础疾病治愈或病情转为稳定;DIC症状解除、体征恢复至正常或DIC前状态;实验室指标如PT、APTT、FIB、D-D及PLT等恢复至正常或DIC前水平。显效:以上三方面内容有两方面符合要求。无效: DIC症状、体征和实验室指标无好转或病情恶化、死亡。有效=痊愈+显效。
1.4统计学处理
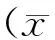
2 结 果
2.1各组DIC临床特征及疗效
各组各种临床表现发生率及疗效有明显差异,出血发生率以病理产科组最高,但均与合计出血率无统计学差异(χ2=1.532,均P>0.05);休克发生率以手术创伤组最高,显著高于合计休克发生率(χ2=5.168,P<0.05),恶性肿瘤组最低,但与合计休克发生率无统计学差异(χ2=3.285,P>0.05);器官衰竭发生率以感染组最高,但与合计器官衰竭发生率无统计学差异(χ2=2.838,P>0.05),病理产科组最低,明显低于合计器官衰竭发生率(χ2=13.404,P<0.01)。各组治疗效果以病理产科组有效率最高,显著高于合计有效率(χ2=12.406,P<0.05),严重肝病组有效率最低,但与合计有效率无统计学差异(χ2=1.706,P>0.05);死亡率以恶性肿瘤组最高,病理产科组最低,与合计死亡率差异均有统计学意义(χ2=15.357、3.886,P<0.05)。见表1。
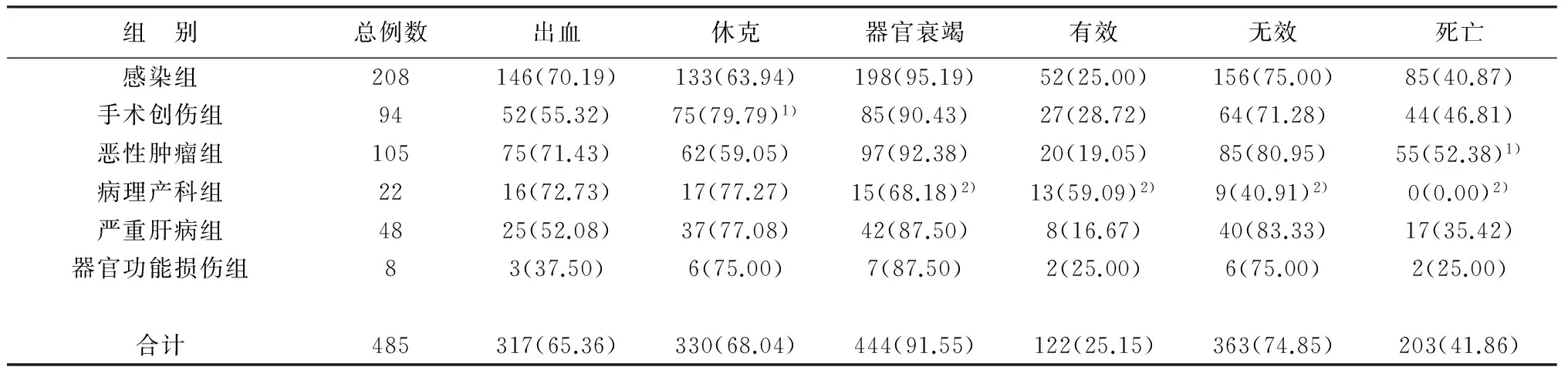
表1 各组DIC患者临床特征及疗效(n,%)
注:与合计发生率比较,1)P<0.05,2)P<0.01
2.2不同治疗方案疗效比较
485例患者中,79例仅给予对症支持治疗;370例给予替代治疗,其中14例使用血小板,53例使用血浆,1例使用冷沉淀,7例使用FIB,134例使用上述2种替代治疗,112例使用上述3种替代治疗,49例使用上述4种替代治疗;36例给予抗凝治疗,其中26例使用低分子肝素,7例使用普通肝素,3例使用上述2种肝素抗凝治疗。不同治疗方案的有效率差异有统计学意义(χ2=8.045,P<0.01),替代治疗和抗凝治疗效果明显优于对症支持治疗(χ2=7.729、3.935,P<0.05),且抗凝治疗和替代治疗有效率相当(χ2=0.001,P>0.05)。见表2。
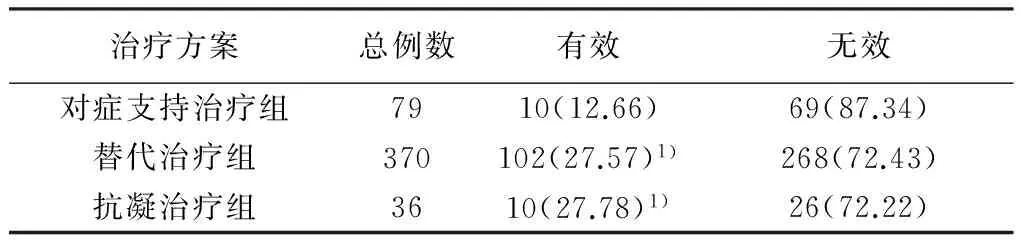
表2 不同DIC治疗方案疗效比较(n,%)
注:与对症支持治疗组比较,1)P<0.05
2.3不同预后DIC患者凝血指标水平及与治疗有效率相关性
临床治疗有效组PT、APTT和D-D低于无效组,FIB水平高于无效组(均P<0.05);两组PLT水平无显著差异(P>0.05)。相关分析显示,PT、APTT缩短,D-D降低与患者治疗有效率呈负相关(r=-0.256、-0.202和-0.116,均P<0.05),FIB升高与患者治疗有效率呈正相关(r=0.102,P<0.05)。见表3。
2.4不同预后DIC患者ISTH显性积分及与治疗有效率相关性
治疗有效组在各级显性积分分布的病例显著少于治疗无效组(P<0.01),且随ISTH显性积分(6-8分)的升高,治疗有效率降低,两者呈明显负相关(r=-0.150,P<0.05)。见表4。

表3 不同预后DIC患者凝血指标比较±s)
注:与无效组比较,1)P<0.05;2)P<0.01

表4 不同预后DIC患者ISTH显性积分比较(n,%)
注:与无效组比较,1)P<0.05
3 讨 论
DIC不是一种独立的疾病,是许多疾病的中间环节,能引发凝血功能严重异常的疾病都可能导致DIC的发生。本文结果显示感染和恶性肿瘤为DIC最常见的原发疾病,与国外的报道结果[5]一致。感染所致脓毒症常因细菌产物使患者体内组织因子合成增加而激活凝血,以及纤维蛋白溶酶原激活抑制物增加而阻止纤维蛋白溶解,导致毛细血管及小血管微血栓形成[6];恶性肿瘤细胞可产生多种促凝因子,包括组织因子和癌促凝物(一种具有因子X激活属性的半胱氨酸蛋白酶[7]),使肿瘤患者处于高凝状态,最终诱发DIC形成。
出血是DIC患者最典型的临床表现,但不同程度的器官功能衰竭更值得重视。本文有65.36%的DIC患者出现了不同程度的出血,而91.55%的DIC患者出现器官衰竭,出现休克患者为68.04%,可见器官衰竭发生率最高。而在几种原发疾病中,感染、手术创伤和恶性肿瘤患者器官衰竭发生率均>90%,感染患者更高(达95%以上),说明感染并发DIC患者基本上都表现为器官衰竭,其原因可能是感染引起的血液系统衰竭使机体处于高凝血、低纤溶状态所致[8]。而以纤溶占主导作用的病理产科,器官衰竭的发生率较低。
本研究通过对不同DIC患者采用针对性个体化治疗,结果发现病理产科组临床有效率最高(59.09%),无效患者中未出现死亡病例;而恶性肿瘤组无效患者中死亡率最高(52.38%)。分析其原因,可能是病理产科患者病情虽然发展迅速,但可通过及时终止妊娠及子宫切除,有效祛除病因;而恶性肿瘤易受DIC危险因素如年龄、疾病状态、化疗等以及其它触发因素如败血症、肝脏转移的影响,加剧血栓栓塞与出血[9],使得恶性肿瘤并发DIC病情复杂,难以控制。
本研究选取临床上普遍应用,相对客观且易于动态观察的几项指标PT、APTT、FIB、D-D和PLT进行DIC监测及其与DIC预后的分析,结果表明93.20%的DIC患者PT延长大于3s,63.71%的DIC患者APTT延长超过10s。临床治疗有效组PT和APTT较无效组显著缩短,且PT和APTT缩短与DIC治疗有效率呈负相关。有文献报道PT延长不仅提示出血风险增高,且对脓毒症DIC患者的预后具有预测作用[10、11],APTT延长可能是纤溶亢进严重程度的标志[12];还有前瞻性研究显示,DIC非幸存者APTT较幸存者显著延长[13]。均证实PT与APTT在DIC诊断及预后评估中有重要作用。FIB是急性期反应指标之一。研究表明,低水平FIB对DIC的诊断并不敏感[14];FIB水平的下降对白血病或妊娠并发DIC的诊断有一定的价值,但是在许多感染引起的DIC中FIB水平不降低[15];FIB与DIC患者预后的关系不明显[16]。本研究中,临床有效组FIB较无效组显著升高,且FIB升高与DIC治疗有效率呈正相关(出现这种差别的原因不详,有待进一步观察论证)。D-D是交联型纤维蛋白降解产物,其水平升高提示继发性纤溶亢进,一些临床重症患者D-D增高有助于提示其合并DIC[17、18]。但除了DIC,许多其它疾病如近期手术、创伤及静脉血栓等也会引起D-D升高[19],所以D-D诊断DIC特异性不如敏感性高[20、21]。在本研究中,治疗无效组患者D-D较有效组显著升高,且D-D降低与DIC治疗有效率呈负相关。可见D-D对DIC的诊断及预后评估起到重要作用。PLT减少或进行性下降是诊断DIC的敏感指标[15],PLT下降可以提示凝血酶的产生,因为凝血酶诱导血小板聚集是PLT减少的重要原因,PLT的进行性减少(即使在正常范围150-400G/L)也可能提示有凝血酶的产生;当PLT水平趋于稳定则表明凝血酶产生已停止。本文治疗无效组DIC患者PLT虽较有效组减少,但差异无统计学意义。表明单项PLT并不能反映DIC的发生发展,对预后的预测价值甚微,与相关报道[22]结果一致。
ISTH显性积分诊断DIC的敏感性和特异性分别是91%和97%[23],ISTH显性积分与DIC患者预后和死亡率相关[14,23-25],更有前瞻性研究显示ISTH显性积分分值≥5的DIC患者死亡风险是<5分者的2.55倍[26]。本文治疗有效组病例显性积分分布明显少于治疗无效组,且随ISTH显性积分升高,治疗有效率下降,两者明显负相关。因此认为ISTH显性积分可用于DIC预后评估。
原发病的治疗是DIC治疗的基础和前提,在针对凝血系统的治疗中,包括抗凝治疗、补充凝血因子及血小板的替代治疗,除非确定存在纤溶亢进且DIC原发病及诱因已控制,一般不主张抗纤溶治疗[1]。本研究中不同治疗方案的有效率差异显著,替代治疗和抗凝治疗效果明显优于对症治疗,且抗凝治疗和替代治疗有效率相当。但有研究指出虽然理论上抗凝治疗有助于阻止微血栓的形成,可在DIC的治疗上发挥作用,而在临床上大剂量抗凝药的使用并没有提高DIC患者的存活率[27,28],对此亦待观察验证。
综上所述,不同成因的DIC临床表现及转归存在差异。PT、APTT、FIB、D-D和ISTH显性积分与DIC患者预后有关,合理应用凝血指标和ISTH显性积分的监测作用对临床提高疗效和改善预后有益。
◀
本文第一作者简介:
杨婷(1991-),女,汉族,硕士研究生,研究方向为自身免疫性血液病
1中华医学会血液学分会血栓与止血学组.弥散性血管内凝血诊断与治疗中国专家共识(2012年版)[J].中华血液学杂志,2012,33(11):978-979.
2Taylor FB,Toh CH,Hoots WK,et al.Towards definition,clinical and laboratory criteria,and a scoring system for disseminated intravascular coagulation[J].Thromb Haemost,2001,86(5):1 327-1 330.
3Dempfle CE,Wurst M,Smolinski M,et al.Use of soluble fibrin antigen instead of D-dimer as fibrin-related marker may enhance the prognostic power of the ISTH overt DIC score[J].Thromb Haemost,2004,91(4):812-818.
4张之南.血液病诊断及疗效标准[M].北京:科学出版社,2007:200-201.
5Okamoto K,Wada H,Hatada T,et al.Frequency and hemostatic abnormalities in pre-DIC patients[J].Thromb Res,2010,126(1):74-78.
6Peters K,Unger RE,Brunner J,et al.Molecular basis of endothelial dysfunction in sepsis[J].Cardiovasc Res,2003,60(1):49-57.
7Rickles FR,Falanga A.Molecular basis for the relationship between thrombosis and cancer[J].Thromb Res,2001,102(6):V215-V224.
8Kawasugi K,Wada H,Hatada T,et al.Prospective evaluation of hemostatic abnormalities in overt DIC due to various underlying diseases[J].Thromb Res,2011,128(2):186-190.
9Levi M.Cancer and DIC[J].Haemostasis,2001,31(Suppl 1):47-48.
10Kinasewitz GT,Zein JG,Lee GL,et al.Prognostic value of a simple evolving disseminated intravascular coagulation score in patients with severe sepsis[J].Critical Care Med,2005,33(10):2 214-2 221.
11Chakraverty R,Davidson S,Peggs K,et al.The incidence and cause of coagulopathies in an intensive care population[J].Brit J Haemost,1996,93(2):460-463.
12Schwameis M,Schober A,Sch rgenhofer C,et al.Asphyxia by drowning induces massive bleeding due to hyperfibrinolytic disseminated intravascular coagulation[J].Critical Care Med,2015,43(11):2 394-2 402.
13Kander T,Larsson A,Taune V,et al.Assessment of haemostasis in disseminated intravascular coagulation by use of point-of-care assays and routine coagulation tests,in critically Ill patients:A prospective observational study[J].PLoS One,2016,11(3):e0151202.
14Bakhtiari K,Meijers JCM,de Jonge E,et al.Prospective validation of the international society of thrombosis and haemostasis scoring system for disseminated intravascular coagulation[J].Critical Care Med,2004,32(12):2 416-2 421.
15Levi M,Toh CH,Thachil J,et al.Guidelines for the diagnosis and management of disseminated intravascular coagulation[J].Brit J Haematol,2009,145(1):24-33.
16Gando S,Iba T,Eguchi Y,et al.A multicenter,prospective validation of disseminated intravascular coagulation diagnostic criteria for critically ill patients:Comparing current criteria[J].Crit Care Med,2006,34(3):625-631.
17Levi M,van der Poll T.Disseminated intravascular coagulation:a review for the internist[J].Intern Emerg Med,2013,8(1):23-32.
18Haas FJLM,Schutgens REG,Biesma DH,et al.Diagnostic possibilities of specific fibrin (ogen) degradation products in relation to venous thromboembolism[J].Blood Coagul Fibrinolysis,2013,24(3):297-304.
19Gando S,Sawamura A,Hayakawa M.Trauma,shock,and disseminated intravascular coagulation:lessons from the classical literature[J].Ann Surg,2011,254(1):10-19.
20Li WJ,Sha M,Ma W,et al.Efficacy evaluation of D-dimer and modified criteria in overt and nonovert disseminated intravascular coagulation diagnosis[J].Int J Lab Hematol,2016,38(2):151-159.
21Eng CW,Wansaicheong G,Goh SK,et al.Exclusion of acute pulmonary embolism:computed tomography pulmonary angiogram or D-dimer? [J].Singapore Med J,2009,50(4):403-406.
22Akca S,Haji-Michael P,De Mendon a A,et al.Time course of platelet counts in critically ill patients[J].Critical Care Med,2002,30(4):753-756.
23Gando S,Meziani F,Levi M.What's new in the diagnostic criteria of disseminated intravascular coagulation? [J].Intensive Care Med,2016,42(6):1 062-1 064.
24 Hjorleifsson E,Sigurdsson MI,Gudmundsdottir BR,et al.Prediction of survival in patients suspected of disseminated intravascular coagulation[J].Acta Anaesthesiol Scand,2015,59(7):870-880.
25Ohuchi M,Fujino K,Kishimoto T,et al.Association of the plasma platelet-derived microparticles to platelet count ratio with hospital mortality and disseminated intravascular coagulopathy in critically lll patients[J].J Atheroscler Thromb,2015,22(8):773-782.
26Takemitsu T,Wada H,Hatada T,et al.Prospective evaluation of three different diagnostic criteria for disseminated intravascular coagulation[J].Thromb Haemost,2011,105(1):40-44.
27Iba T,Saitoh D.Efficacy of antithrombin in preclinical and clinical applications for sepsis-associated disseminated intravascular coagulation[J].J Intensive Care,2014,2(1):1-7.
28Iba T,Gando S,Thachil J.Anticoagulant therapy for sepsis-associated disseminated intravascular coagulation:the view from Japan[J].J Thromb Haemost,2014,12(7):1 010-1 019.
Clinical Manifestation of DIC with Different Causes and the Relationship between Outcome and Coagulation Indicators,Clinical Score of Patients
YANG Ting,GAO Qing-ping*
Renmin Hospital of Wuhan University,Wuhan 430060,China;*Corresponding author
Objective:To analysis clinical manifestation of disseminated intravascular coagulation with different causes and the relationship between outcome and coagulation indicators,clinical score of patients.Method:485 patients with DIC,based on the primary disease were divided into infection group (n=208),surgical trauma group (n=94),malignancy group (n=105),pathology obstetrics group (n=22),severe liver disease group (n=48) and organ injury group (n=8).The manifestations and clinical efficacy with different trerapies (sympotomatic therapy,simple replacement therapy and anticoagulation therapy)of each group,the difference of prothrombin time (PT),activated partial thromboplastin time (APTT),fibrinogen concentration (FIB),D-Dimer(D-D),platelet(PLT) and international society for thrombosis and hemostasis(ISTH) DIC dominant scoring(5 points,6 points,7 points,8 points) with different efficacy(effective,invalid),and the correlation between coagulation indicators,ISTH dominant scoring and the clinical outcome of DIC patients were analyzed.Results:DIC patients with different causes had strikingly different incidence in bleeding,shock and organ failure; Pathology obstetrics group had the highest incidence rate of bleeding(72.73%),compared with the total incidence (65.36%) was no significant differences (P>0.05);Surgical trauma group had the highest incidence rate of shock(79.79%) was higher,compared with the total incidence 68.04% differences (P<0.05); Infection group had the highest incidence rate of organ failure(95.19%),compared with the total incidence 91.55% was no significant differences (P>0.05); Pathology obstetrics group had the highest efficiency (59.09%),compared with the total incidence 25.15% was significant differences (P<0.05); Severe liver disease group had the highest inefficiency (83.33%),compared with the total incidence 74.85% was no significant differences (P>0.05); the highest mortality rate (52.38%) of malignancy group,compared with the total incidence 41.86% was significant differences (P<0.05).The effective rate of replacement therapy and anticoagulation therapy were significantly higher than that of the symptomatic therapy (P<0.05),and no significant differences between replacement therapy and anticoagulation therapy(P>0.05).Effective group and invalid group of PT,APTT,FIB,D-D and ISTH dominant scoring were significantly different (P<0.05).There was positive correlation between PT shortened,APTT shortened,FIB increased,D-D decreased and efficiency(r=-0.256,-0.202,-0.116,0.102,P<0.05).There was negative correlation between dominant scoring increased and efficiency(r=-0.150,P<0.05).Conclusion:DIC outcome is not very optimistic,rational application of the monitoring role of hemostatic indicators and ISTH dominant is helpful to improve the efficacy and prognosis.
Disseminated intravascular coagulation; Coagulation indicators; Clinical score; Outcome
单位]武汉大学人民医院,武汉 430060;*
,E-mail:gao.qingping@163.com
本文2016-02-20收到,2016-06-30修回
R554+.8[文献标识码]A
1005-1740(2016)03-0021-06

