缬草提取物对慢性心力衰竭室性心律失常兔电生理指标的影响*
杨淑红 曹 红 胡 河 陈玉婷 徐辉文
缬草提取物对慢性心力衰竭室性心律失常兔电生理指标的影响*
杨淑红1,2曹红2胡河2陈玉婷2徐辉文3
目的:观察缬草提取物(VOL)对慢性心力衰竭(CHF)致室性心律失常兔电生理指标的影响。方法:雄性新西兰大耳白兔30只,随机平分为三组:正常对照组(Control组)、CHF模型组(CHF组)和CHF+VOL组(VOL组)。CHF模型组经耳缘静脉推注异丙肾上腺素(0.3mg/kg/天,连续注射3周)诱导;Control组平行推注等体积生理盐水;VOL组对CHF兔持续静脉滴注浓度为50mg/L的VOL。记录各组在体心脏左心室单相动作电位(MAP)主要参数静息膜电位(RMP)、动作电位幅度(APA)、动作电位最大上升速率(Maxdv/dt)和动作电位复极化恢复时程(APD10-90);观察各组室性心律失常诱发周长(BCL)、诱发率和心律失常持续时间;分离单个心室肌细胞后,全细胞膜片钳技术记录心室肌细胞L-型钙电流(ICa-L)及电流-电压(I-V)曲线。结果:与Control组比较,CHF组RMP、APA、Maxdv/dt均明显降低,APD10、APD20、 APD50和APD90均显著延长(P均<0.01);与CHF组比较,VOL组RMP、APA、Maxdv/dt均明显增加,各APD时程均显著缩短(P<0.01)。CHF组诱发室性心律失常BCL、心律失常诱发率和持续时间均大于Control组(P<0.01);VOL组BCL、心律失常诱发率和持续时间均小于CHF组(P<0.01)。当钳制电位为+20mV时,与Control组比较,CHF组心室肌细胞ICa-L电流密度由(-12.13±0.99pA/pF)下降为(-7.14±0.33pA/pF)(P<0.01);VOL组则较CHF组ICa-L电流密度明显上升(-10.86±0.50pA/pF)(P<0.01),VOL组ICa-L的I-V曲线较CHF组明显下移,接近Control组。结论:VOL能显著降低CHF心室肌电生理易损性和室性心律失常易感性,拮抗CHF室性心律失常;其机制可能与VOL可增加心室肌细胞ICa-L有关。
缬草提取物;慢性心力衰竭;单相动作电位;L-型钙电流;抗室性心律失常;兔
慢性心力衰竭(Congestive Heart Failure,CHF)患者容易诱发室性心律失常,甚至出现心源性猝死等恶性事件[1]。CHF发生机制可能与离子通道表达异常,允许离子电流进出心室肌细胞内外量的多寡密切相关[2]。改善CHF患者的心功能,防止室性心律失常发生是药物治疗CHF的重要节点[3]。抗心律失常药物能够有效减少CHF室性心律失常的发生。缬草(Valeriana Officinalis L,VOL)属于败酱科缬草属多年生草本植物[4],其有效成分缬草单萜碱可通过降低心肌细胞内[Ca2+]i,发挥抗缺血再灌注损伤以及通过作用于Na+电流发挥抗心律失常等效应[5]。但其对CHF诱发心律失常的相关作用及其电生理变化尚不明确。本文采用静脉注射异丙肾上腺素诱发家兔CHF模型,采用单相动作电位(Monophasic Action Potential,MAP)、全细胞膜片钳等技术记录各种电生理指标,探讨VOL有效成分提取液对CHF所致室性心律失常的影响和电生理机制,为VOL的临床应用提供实验证据。
1 材料与方法
1.1实验动物及分组
健康雄性新西兰大耳白兔30只,购于武汉生物制品研究所,体重1.5-2.0kg。饲养于本院实验动物中心(SPF级动物室),整个饲养过程充分提供动物生活所需湿度、温度和光线,自由进食和饮水,1-2周后随机数字表法分为正常对照组(Control组)、CHF模型组(CHF 组)和CHF+VOL有效成分提取物组(VOL组),每组10只。
1.2实验仪器
婴幼儿超声仪(主机Vivid 7,探头S4,美国GE公司);16导电生理记录系统(PowerLab 16/30,澳大利亚AD公司);电生理记录和分析模块(LabChart Pro V7,澳大利亚AD公司);Langendorff离体心脏灌流装置(PowerLab7,澳大利亚AD公司);倒置显微镜(IX70-122,日本Olympus公司);Pulse+Pulsefit软件(version8.31,HEKA,德国);EPC-9放大器(HEKA,德国);Igor Pro分析软件(version 3.31,美国);玻璃微电极(Sutter-7,美国)。
1.3实验药物和试剂
VOL有效成分提取液(制备成安瓿,5ml/支)由华中科技大学老年医学研究所馈赠,参照前期VOL对心肌缺血再灌注实验结果[5],本次实验选择浓度为50mg/L。自配Tyrode液(mmol/L):NaCl 135.0、KCl 5.4、MgCl21.0、HEPES 10.0、Glucose 10.0,用NaOH调pH至7.35;ICa-L细胞外液(mM):CsCl 5.4、MgCl21、Hepes 5、Glucose 11,用CsOH调pH至7.4;ICa-L细胞内液(mM):NaCl 5、CsCl 10、Hepes 5、Mg-ATP 2.5,用CsOH调pH至7.4。异丙肾上腺素、戊巴比妥钠、Ⅰ型胶原酶、蛋白酶E、小牛血清白蛋白、河豚毒素(TTX)、BaCl2和维拉帕米均为美国Sigam公司产品。
1.4实验方法
1.4.1CHF模型制备:参照文献[7]并作改良。CHF组和VOL组共20只兔,经耳缘静脉推注异丙肾上腺素0.3mg/kg/天,连续注射3周(推注前后注意剃毛、消毒和止血);Control组兔注射相同体积0.9% NaCl并作同样处理,继续饲养6个月后,观察三组动物临床症状,并行超声心动图和心电图检查。超声心动图和心电图检查由同一名副高级职称专科医师完成。结果:CHF兔出现消瘦、食欲减退、嗜睡、气促和肌肉萎缩等临床症状;超声心动图指标与Control组比较,左室射血分数降低(52.37±12.75% vs 85.21±15.58%)(P<0.01),左室腔扩大29.46%,室间隔明显变薄,左室短轴缩短率降低49.12%;心电图出现室性早搏,与Control组比较心率变慢(231.07±27.32次/min vs 268.93±34.36次/min)(P<0.01),QT间期延长(183.62±38.42ms vs 115.97±29.89ms)(P<0.01)。与CHF模型兔相关报道结果[6]一致,即20只家兔均造模成功,后随机编入CHF组和VOL组,各10只,两组在临床表现、超声心动图和心动图各参数比较均无显著差异(P>0.05),具有可比性。
1.4.2VOL干预方法:VOL组家兔在做完心室MAP参数后,间隔30min(消除心脏记忆对后续实验数据的影响),开始耳缘静脉滴注VOL提取液20min(滴速为15滴/min),之后维持该滴速记录在体各项心电生理指标,直到实验完成;对离体心室肌细胞ICa-L作用的VOL提取液干预时间是在细胞外液灌流心室肌细胞10min后通过灌注给予(灌流速度为3-5ml/min),直到实验结束。
1.5观察指标
1.5.1在体左心室MAP:各组兔耳缘静脉推注戊巴比妥钠麻醉(300mg/kg)后开胸,用开睑器撑开胸廓充分暴露心脏,剪开心包膜,用接触式双极铂金微电极贴于左心室前壁靠近心尖部,记录MAP心电信号。MAP心电信号经放大器放大、转换和滤波后储存于计算机,供测量、分析和统计实验数据。观察参数包括静息膜电位(RMP)、动作电位幅度(APA)、动作电位最大上升速率(Maxdv/dt)、动作电位复极化恢复到10%、20%、50%、90%时程(APD10、APD20、APD50、APD90)。
1.5.2室性心律失常:MAP心电信号采集完成后30min(消除心脏记忆对后续实验数据的影响),采用短阵快速刺激法[7](Burst-pacing,波宽2ms,刺激时间10s)观察各组诱发性室性心律失常(包括室性早搏、室性心动过速或心室颤动)的诱发率和心律失常持续时间,以及诱发各种心律失常的刺激周长(BCL)。
1.5.3心室肌细胞ICa-L及其电流-电压(I-V)曲线: (1)分离心室肌细胞:上述实验结束后,各组家兔经耳缘静脉推注肝素钠(500IU/kg)抗凝,10min后摘取心脏置于冰冻生理盐水中,插入主动脉套管,连接离体心脏循环灌流装置,先用无Ca2+Tyrode液逆行灌流,再用含Ⅰ型胶原酶、蛋白酶E和小牛血清白蛋白的无Ca2+Tyrode液循环灌流,最后用无Ca2+Tyrode液灌流。取下心脏去除心房肌、乳头肌和浦肯野纤维等组织,留取心室肌制备单个心室肌细胞悬液,离心去上清,用含BSA和氨苄青霉素Tyrode调细胞浓度至5×105/ml,供膜片钳实验用。(2)分别将各组心室肌细胞悬液加到显微镜载物台上的细胞记录槽中,待细胞沉底贴壁,用细胞外液循环灌流10min。给予指令程序和记录信号于膜片钳软件,并通过电极内液和玻璃微电极与细胞高阻抗封接,形成全细胞膜片钳记录模式。将钳制电位设置为-40mV,指令电位由-40mV去极化到+60mV,跃阶10mV,持续时间200ms,记录一缓慢内向电流,然后灌流钙通道阻滞剂维拉帕米(20μmol/L)10min,该缓慢内向电流减小,即为ICa-L。为消除Na+和K+电流的干扰,循环灌流细胞外液中加入TTX(50μmol/L)阻断INa,加入 BaCl2(100μmol/L)阻断IK1,记录钳制电位为+20mV时的ICa-L电流密度。对各组数据与描记图形进行拟合,以钳制电位为横坐标,对应电流密度为纵坐标,绘制ICa-L的I-V曲线。为消除细胞大小对统计结果造成误差,ICa-L用电流密度(pA/pF)表示。
1.6统计学处理
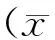
2 结 果
2.1各组心室肌MAP主要参数比较
RMP、APA、Maxdv/dt和各APD时程在Control组、CHF组和VOL组间差异均具有统计学意义(P<0.01)。与Control组比较,CHF组RMP、APA和Maxdv/dt明显减少(t均≥10.65,均P<0.01),各APD时程显著延长(t均≥7.31,均P<0.01);与CHF组比较,VOL组RMP、APA和Maxdv/dt明显增加(t均≥7.92,P<0.01),各APD时程均缩短(t均≥17.92,均P<0.01)。见表1。

表1 各组心室肌MAP主要参数比较(n均
注:与Control组比较,1)P<0.01;与CHF组比较,2)P<0.01
2.2各组诱发性室性心律失常指标比较
心律失常诱发率、持续时间分布、BCL和ICa-L在Control组、CHF组和VOL组间差异均有统计学意义(P<0.01)。与Control组比较,CHF组心律失常诱发率增加、心律失常持续时间延长(χ2均≥6.98,均P<0.01),BCL也明显延长(t=10.82,P<0.01);与CHF组比较,VOL组心律失常诱发率降低,持续时间缩短(χ2均≥10.96,均P<0.01)。BCL缩短(t=5.851,P<0.01)。见表2。

表2 各组家兔诱发性室性心律失常相关指标比较(n均=10)
注:与Control组比较,1)P<0.01;与CHF组比较,2)P<0.01
2.3各组心室肌细胞ICa-L及I-V曲线
各组心室肌ICa-L电流密度差异有统计学意义(P<0.01)。与Control组比较,CHF组ICa-L电流密度显著减小(t=8.64,P<0.01),而VOL组较CHF组明显增加(t=7.68,P<0.01),见表2。各组于钳制电位+20mV时,ICa-L电流密度最大,-40mV和+60mV时最低,呈明显抛物线状。各组I-V抛物线以Control组较高,CHF组明显上抬,VOL组较CHF组显著下移,接近Control组。见图1。
3 讨 论
CHF常引起心脏电重构,电活动紊乱,诱发严重室性心律失常[7]。本实验建立的家兔CHF模型显示,CHF发生后,其动作电位幅度降低,自动除极变缓,舒张速率低平、延长,复极化过程中各时间段均显著延长;这些改变有利于CHF兔室性心律失常的发生。本文结果证实,CHF兔心脏在程控和短阵快速刺激下,诱发室性心律失常的BCL和持续时间均显著延长,心室电明显重构,诱发了室性心律失常。
CHF诱发室性心律失常易导致猝死风险,针对性药物治疗非常关键[8]。VOL具有增加心脏冠脉血流量、抗心肌缺血再灌注损伤和抗心律失常等作用。本研究表明,VOL可使CHF兔心脏APA增加,Maxdv/dt增快,APD显著缩短,心室动作电位传导速度和心率增加,从而增加CHF心输出量和动能。而且VOL还能稳定心脏电活动,阻滞异位起搏点发放冲动,防止折返性室性心律失常的形成[9]。VOL能显著缩短诱发CHF室性心律失常BCL,明显降低心律失常发生率,即使发生室性心律失常,但持续时间也会变短,且易终止,或转为窦性心率。进一步说明VOL可明显降低CHF室性心律失常的敏感性阈值,增强抗额外快速刺激的耐受性,显示抗CHF室性心律失常作用,与有关研究报道结果[10]相一致。心肌细胞动作电位平台期的形成主要由ICa-L决定,它的开启和关闭控制着动作电位传导快慢和细胞中生理性[Ca2+]i变化[11]。Ca2+是心肌收缩原动力,其通过ICa-L进出细胞,产生动作电位传递的驱动力量[12]。当CHF心室肌细胞ICa-L下降,CHF心脏做功能力下降,电活动减弱,动作电位传导减慢;反之,ICa-L增加时,CHF心脏的上述功能将会改善或加强。本研究中,CHF心室肌细胞ICa-L显著减少,I-V曲线严重上抬,成为CHF心脏易发折返性室性心律失常的电生理表现。而VOL可以显著增加CHF心室肌细胞的ICa-L,明显下移I-V曲线,使心室肌细胞外Ca2+很快通过ICa-L进入心室肌细胞内,增加CHF心室肌细胞收缩动力和动作电位传导速度,避免CHF心脏诱发折返性室性心律失常[13]。

图1 各组心室肌细胞ICa-L的I-V曲线
总之,本次动物实验表明VOL可明显改善CHF兔心电生理指标,如缩短APD、BCL、降低心率失常发生率等,其机制可能与VOL增加CHF兔心肌细胞的ICa-L有关。该结果为临床选择应用VOL治疗终末期CHF提供了实验依据。
◀
本文第一作者简介:
杨淑红(1974-),女,汉族,硕士,主管护师,主要从事心脏疾病的基础研究
1Wilson LD,Jeyaraj D,Wan X,et al.Heart failure enhances susceptibility to arrhythmogenic cardiac alternans[J].Heart Rhythm,2009,6(2):251-259.
2Chua SK,Chang PC,Maruyama M,et al.Small-conductance calcium-activated potassium channel and recurrent ventricular fibrillation in failing rabbit ventricles[J].Circ Res,2011,108(8):971-979.
3吴明.心律失常药物治疗进展与评价[J].海南医学,2007,18(3):1-3.
4张丹,周立新,林能明.缬草的药理作用研究进展[J].中国临床药学杂志,2014,23(6):397-402.
5杨淑红,陈芳,马红梅,等.缬草提取物预处理对大鼠心肌细胞缺血再灌注损伤的保护作用[J].武汉大学学报医学版,2012,33(5):639-643.
6王腾,吴平亚,李文星,等.2-甲硫基三磷酸腺苷对心力衰竭兔心室电生理的影响[J].中国心脏起搏与心电生理杂志,2015,29(5):479-483.
7Houser SR,Margulies KB,Murphy AM,et al.Animal models of heart failure:a scientific statement from the American Heart Association[J].Circ Res,2012,111(1):131-150.
8杨溢,刘伟,陆秀红,等.2-甲硫基三磷酸腺苷可抑制兔慢性心力衰竭引起的室性心律失常[J].中华心血管病杂志,2015,43(3):212-218.
9Zhou SY,Mamdani M,Qanud K,et al.Treatment of heart failure by a methanocarba derivative of adenosine monophosphate:implication for a role of cardiac purinergic P2X receptors[J].J Pharmacol Exp Ther,2010,333(3):920-928.
10吴迪,张楠淇,李平亚.缬草化学成分及生物活性研究进展[J].中国中医药信息杂志,2014,21(9):129-133.
11Josephson IR,Guia A,Sobie EA,et al.Physiologic gating properties of unitary cardiac L-type Ca2+channels[J].Biochem Biophys Res Commun,2010,396(3):763-766.
12Goldhaber JI,Xie LH,Duong T,et al.Action potential duration restitution and alternans in rabbit ventricular myocytes:the key role of intracellular calcium cycling[J].Circ Res,2005,96(4):459-466.
13Viola HM,Macdonald WA,Tang H,et al.The L-type Ca2+channel as a therapeutic target in heart disease[J].Curr Med Chem,2009,16(26):3 341-3 358.
Effect of Valeriana Officinalis L Extract on Correlated Electrophysiological Parameters of Ventricular Arrhythmias induced by Congestive Heart Failure in Rabbit
YANG Shu-hong1,CAO Hong2,HU He2,CHEN Yu-ting,XU Hui-wen
1Clinical Dressing Room;2Institute of Cardiovasallar Disease;3Department of Geriatrics,Renmin Hospital of Wuhan University,Wuhan 430060,China
Objective:To investigate effects of valeriana officinalis L extract (VOL) on correlated electrophysiological parameters of ventricular arrhythmias induced by congestive heart failure (CHF) in rabbits.Method:The male New Zealand rabbits (n=30) were divide into control,CHF and CHF+VOL (VOL) groups.The CHF models were induced by injection isoproterenol (0.3mg/Kg/d for 3 weeks),and control rabbits were injected 0.9% NaCl with same ways.The VOL group rabbits were injected 50mg/L VOL.The main cardioelectrophysiological parameters such as RMP,APA,Maxdv/dtand APD10-90,as well as basic cycle length (BCL),rate and time of induced arrhythmias by recording monophasic action potential (MAP) with Burst-pacing in rabbits in vivo with 50mg/L VOL administration.The L-type calcium current (ICa-L) was recorded via whole-cell patch clamp technique in enzymatically dissociated single rabbit ventricular myocytes.Results:Compared with control group,RMP,APA and Maxdv/dtwere significantly lowered,as well as APD10-90were notably lingered in CHF rabbit (Pof all <0.01,respectively).Compared with CHF group,VOL could significantlyincrease RMP,APA and Vmax,as well shorten APD10-90inVOL group in vivo (Pof all <0.01,respectively).Compared with control group,BCL and persistence time inducing ventricular arrhythmias were significantly lengthened,and occurrence of ventricular arrhythmias were obviously increased in CHF group (Pof all <0.01,respectively).However,VOL could obviously shorten BCL and persistence time of ventricular arrhythmias,and decrease rate of inducibility of ventricular arrhythmias with burst-pacing in VOL group in vivo (Pof all <0.01,respectively).VOL could markedly increase the current density of ICa-L,and alter down of current-voltage (I-V) relationship curve in different command potential in CHF ventricular myocytes.When command potential was +20mV,the current densities of ICa-Lwere significantly increased from (7.14±0.33)pA/pF in CHF group to (10.86±0.50)pA/pF in VOL group(P<0.01)with VOL administration.Conclusion:VOL could significantly decrease the vulnerability and susceptibility of ventricular arrhythmias induced by CHF,which was contributed to anti-ventricular arrhythmias induced by CHF.It is suggested that the mechanisms might attribute to that VOL could markedly increase ICa-Lin CHF rabbits.
Valeriana officinalis L extract; Congestive heart failure; Monophasic action potential; L-type cacium current; Anti-ventricular arrhythmias; Rabbit
湖北省自然科学基金(2011CDB504);湖北省卫计委科研基金(JX6B67; WJ2015MB088)
单位]武汉大学人民医院,武汉 430060;1外科门诊;2心血管研究所;3老年病科
本文2016-05-30收到,2016-06-21修回
R541.7[文献标识码]A
1005-1740(2016)03-0011-05
——从一道浙江选考生物学试题谈起

