卡泊芬净与伏立康唑治疗侵袭性真菌感染的疗效观察
刘燕好,廖世雄
(1.惠州市第一妇幼保健院药剂科,广东 惠州 516000; 2.惠州市中心人民医院药学部,广东 惠州 516001)
卡泊芬净与伏立康唑治疗侵袭性真菌感染的疗效观察
刘燕好1*,廖世雄2
(1.惠州市第一妇幼保健院药剂科,广东 惠州516000; 2.惠州市中心人民医院药学部,广东 惠州516001)
目的:探讨卡泊芬净和伏立康唑治疗侵袭性真菌感染临床疗效。方法:选取侵袭性真菌感染患者100例,按随机数字表法分为观察组与对照组各50例。观察组患者给予注射用卡泊芬净(70 mg负荷剂量、50 mg维持剂量)静脉滴注,对照组患者给予注射用伏立康唑(400 mg负荷剂量、200 mg维持剂量)静脉滴注,比较2组患者的临床疗效。结果:观察组患者的痊愈率为44.00%(22/50)、总有效率为86.00%(43/50),高于对照组的32.00%(16/50)、74.00%(37/50),差异均有统计学意义(P<0.05);观察组患者平均住院时间、平均住院费明显低于对照组,细菌清除率明显高于对照组,差异均有统计学意义(P<0.05);治疗第4日,观察组患者的白细胞计数、C反应蛋白、降钙素原下降幅度明显高于治疗前,且明显优于对照组,差异有统计学意义(P<0.05);2组患者肝、肾功能均无明显变化。结论:卡泊芬净治疗重症患者侵袭性真菌感染疗效肯定,不良反应轻,可用于重症患者抗真菌治疗。
卡泊芬净; 伏立康唑; 侵袭性真菌感染
侵袭性真菌感染(invasive fungal infections,IFI)又称侵袭性真菌病,其为真菌侵袭引起人体皮肤的真皮层、黏膜、深部组织或者内脏器官感染的疾病。随着免疫缺陷病、恶性肿瘤、广谱抗菌药物的广泛应用,造血干细胞或者器官移植患者增多以及侵袭性操作增多等,国内外医院IFI的发病率逐年升高[1-2]。卡泊芬净是棘白菌素类抗真菌药,可特异性抑制真菌细胞壁的组成成分β(1,3)-D-葡聚糖的合成,从而破坏真菌结构,使之溶解。伏立康唑为三唑类抗真菌药,通过抑制对真菌肝药酶CYP有依赖的羊毛甾醇14α-去甲基化酶,进而抑制真菌细胞膜麦角甾醇的生物合成,使真菌细胞膜的结构和功能丧失,最终导致真菌死亡[3]。两者均有抗菌谱广、药效强、不良反应少等特点,已被广泛应用于临床。本研究比较了卡泊芬净与伏立康唑治疗IFI的疗效,现报告如下。
1 资料与方法
1.1资来源料
选取2013年1月—2015年12月入住呼吸科、重症监护病房和急诊重症监护病房确诊为侵袭性真菌感染患者100例,男性54例,女性46例;年龄62~80岁,平均(71±11)岁。纳入标准:(1)年龄≥18岁,(2)发病24 h内入院。排除标准:入院前已存在严重的肝肾疾病、恶性肿瘤等严重的系统性疾病者。按随机数字表法分为观察组和对照组,每组各50例。2组患者病情资料、年龄、性别等一般资料相似,具有可比性。本研究经医院医学伦理委员会批准,患者及家属签署了知情同意书。
1.2方法
观察组患者给予注射用卡泊芬净(Merck Sharp & Dohme Ltd,批准文号:H20130944)第1日单次70 mg负荷剂量,随后1日1次给药,1次50 mg,维持剂量静脉滴注。对照组患者给予注射用伏立康唑(丽珠集团丽珠制药厂,批准文号:国药准字H20064493)第1日单次400 mg负荷剂量,随后1日1次给药,1次200 mg,维持剂量静脉滴注。
1.3观察指标
(1)每日监测患者体温,每2~3 d复查血常规、C反应蛋白(CRP)、降钙素原(PCT)、肾功能等指标。(2)每3~4 d根据患者病情行真菌学培养、胸部X线检查,监测肝、肾功能。(3)观察真菌学清除情况、平均感染痊愈时间、治疗费用及住院时间。
1.4疗效评定标准
根据卫生部颁发的《抗生素药物临床试验技术标准》分为4级,临床痊愈:临床症状、患者体征、临床检查和真菌学检查4项均已经正常;显效:临床表现和症状明显好转,仍有前4项中1项未达标;进步:抗感染治疗后临床症状有好转,但效果不明显;无效:抗感染治疗后72 h临床症状无明显好转或有加重。临床痊愈、有效和进步者都归类为有效病例,以此计算临床有效率。总有效率=(临床痊愈病例数+有效病例数+进步病例数)/总病例数×100%。
1.5统计学方法

2 结果
2.12组患者临床疗效比较
观察组患者的痊愈率、总有效率均高于对照组,差异有统计学意义(P>0.05),见表1。
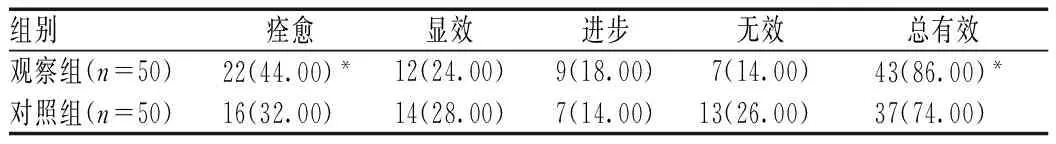
表1 2组患者临床疗效比较[例(%)]
注:与对照组比较,*P<0.05
Note:vs. the control group,*P<0.05
2.22组患者真菌学清除情况、平均感染痊愈时间、平均住院时间及平均住院费用比较
观察组患者的细菌清除率为94.00%,明显高于对照组的86.00%,差异有统计学意义(P<0.05)。观察组患者平均感染痊愈时间14.60 d,对照组为13.80 d,2组的差异无统计学意义(P>0.05)。观察组患者的平均住院时间为13.80 d,明显短于对照组的16.90 d;平均住院费用为44 012.42元,明显少于对照组的45 121.21元,差异均有统计学意义(P<0.05)。
2.32组患者治疗前后体温及各感染指标比较
治疗第4日,观察组患者的白细胞计数、CRP、PCT下降幅度明显高于治疗前,且明显优于对照组,差异有统计学意义(P<0.05),见表2。
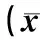
表2 2组患者体温及感染指标比较±s)
2.42组患者不良反应发生情况比较
2组患者肝肾功能未见明显异常,表明卡泊芬净与伏立康唑安全性较高。
3 讨论
3.1IFI的流行病学
近年来,IFI发病率不断攀升[4],有文献报道,真菌感染占院内感染的8%~15%,且呈上升趋势[5-6]。重症患者由于自身基础疾病较多、病情严重、免疫功能低下、有长时间广谱强效抗菌药物接触史以及创伤性操作等多种感染高危因素存在,故IFI的发生率较高[5],相关资料报道,重症患者感染IFI的死亡率只低于血液系统肿瘤患者[8],故其临床治疗有一定的难度。
IFI的病原菌仍以念珠菌为主,与血液和肿瘤真菌感染的真菌谱明显不同[9-10]。其中,白色念珠菌仍是最常见的病原菌,但近年来非白色念珠菌感染的比例也在逐渐上升,且病原菌耐药率逐渐增加[11]。相关资料报道,约77%的酵母菌菌血症为非白念珠菌引起。本研究中,非白念珠菌感染55例(占55.00%),此外其他致病菌还包括克柔念珠菌、光滑念珠菌菌、近平滑念珠菌、热带念珠菌等。临床医师和药师必须掌握重症患者IFI流行病学分布及耐药状况,以更好地选用合适抗真菌药。
3.2卡泊芬净与伏立康唑治疗IFI的疗效比及安全性
伏立康唑具有广谱抗真菌作用,对念珠菌、曲菌属真菌及其他致病性真菌有作用。卡泊芬净适用于可疑真菌感染治疗对其他治疗无效或不能耐受的侵袭性曲霉菌病。本研究中,观察组患者的总有效率为86.00%,明显高于对照组的74.00%;观察组患者的细菌清除率为94.00%,明显高于对照组的86.00%,差异均有统计学意义(P<0.05),表明卡泊芬净治疗IFI的疗效较好。
重症患者是IFI的高危人群,且这类患者中常合并多器官功能障碍或衰竭,而目前临床常用的抗真菌药几乎均有肝肾毒性及其他毒副作用。因此,在抗真菌治疗过程中,如何正确选择与合理使用抗真菌药物,尽可能避免或减少器官损害,是临床医师和临床药师必须面对的难题。但目前尚缺乏重症患者使用抗真菌药发生肝功能损害的大规模临床研究。卡泊芬净为棘白菌素类药物,相关资料表明,部分患者应用后可引起肝功能不全,因此,在轻度肝功能不全(Child-Push评分5~6分)时按原剂量给予治疗,中度肝功能不全(Child-Pugh评分7~9分)时给药剂量需调整为35 mg/d。目前查阅相关文献和资料均无肝衰竭(Child-Pugh评分>9分)患者的用药研究,若存在肝衰竭应慎用。
伏立康唑常见的不良反应为视觉障碍、发热、皮疹、恶心、呕吐、腹泻、头痛、败血症、周围性水肿、腹痛以及呼吸功能紊乱。与治疗有关的、导致停药的最常见不良反应包括肝功能实验值增高、皮疹和视觉障碍。目前尚无文献或资料报道肝功能衰竭可使用伏立康唑。本研究中,通过对患者肝肾功能各指标进行观察,结果发现,卡泊芬净与伏立康唑对肝肾功能无明显影响,表明两者抗真菌治疗并没有导致严重药物不良反应及药物性肝损害,但此结果可能存在一定的局限性(如本研究样本量较少等)因此,临床采用以上药物治疗时还需严密监测患者情况,如有轻度或中度肝功能障碍者需要定期检测肝功能[12-13],根据情况制订个体化伏立康唑给药方案等。
3.3卡泊芬净与伏立康唑治疗费用及住院时间
本研究中,观察组患者整个住院过程产生的平均总费用为44 012.42元,对照组为45 121.21元。由此可见,观察组患者的治疗费用明显低于对照组,差异有统计学意义(P<0.05);观察组患者的平均住院时间为13.80 d,明显短于对照组的16.90 d,差异有统计学意义(P<0.05),表明卡泊芬净可节省治疗费用,缩短住院时间。
综上所述,卡泊芬净治疗重症患者侵袭性真菌感染疗效肯定,不良反应轻,可用于重症患者的抗真菌治疗。因本次研究纳入样本量较少,影响因素较多,在目前有限的临床使用经验中,抗真菌治疗如何合理选择抗真菌药物,值得进一步深入研究。
[1]Hajjeh RA,Sofair AN,Harrison LH,et al.Incidence of bloodstream infections due to Candida species and in vitro susceptibilities of isolates collected from 1998 to 2000 in a population-based active surveillance program[J].J Clin Microbiol,2004,42(4):1519-1527.
[2]Bodro M,Sabé N,Gomila A,et al.Risk factors, clinical characteristics, and outcomes of invasive fungal infections in solid organ transplant recipients[M].Transplant Proc,2012,44(9):2682-2685.
[3]陈新谦,金有豫,汤光.新编药物学[M].北京:人民卫生出版社,2011:118,120.
[4]詹伟锋,张一臣,陈纯波,等.卡泊芬净治疗重症患者侵袭性真菌感染的疗效与安全性[J].广东医学,2011,32(22):2993-2995.
[5]Edmond MB,Wallace SE,McClish DK,et al.Nosocomial bloodstream infections in United States hospitals: a three-year analysis[J].Clin Infect Dis,1999,29(2):239-244.
[6]Shelton BK.Opportunistic fungal infections in the critically ill[J].Crit Care Nurs Clin North Am,2000,12(3):323-340.
[7]Ostrosky-Zeichner L,Pappas PG.Invasive candidiasis in the intensive care unit[J].Crit Care Med,2006,34(3):857-63.
[8]Tortorano AM,Peman J,Bernhardt H,et al.Epidemiology of candidaemia in Europe: results of 28-month European Confederation of Medical Mycology (ECMM) hospital-based surveillance study[J].Eur J Clin Microbiol Infect Dis,2004,23(4):317-322.
[9]伊曲康唑疗效和安全性评估ICU协作组.伊曲康唑静脉口服序贯治疗ICU侵袭性真菌感染的疗效与安全性[J].中华内科杂志,2008,47(12):1012-1016.
[10]陈纯波,曾红科,胡北,等.伏立康唑治疗重症患者侵袭性真菌感染的疗效[J].广东医学,2008,29(7):1218-1219.
[11]徐英春,王澎,陈民钧,等.辉瑞公司全球多中心酵母菌敏感性监测结果[J].中国抗感染化疗杂志,2003,3(3):187-190.
[12]Girois SB,Chapuis F,Decullier E,et al.Adverse effects of antifungal therapies in invasive fungal infections: review and meta-analysis[J].Eur J Clin Microbiol Infect Dis,2006,25(2):138-149.
[13]Bradbury BD,Jick SS.Itraconazole and fluconazole and certain rare, serious adverse events[J].Pharmacotherapy,2002,22(6):697-700.
Observation on Efficacy of Caspofungin and Voriconazole in Treatment of Patients with Severe Invasive Fungal Infections
LIU Yanhao1, LIAO Shixiong2
(1.Dept.of Pharmacy, the First Material and Child Hygiene Hospital, Guangdong Huizhou 516000, China; 2.Dept.of Pharmacy, Huizhou Central People’s Hospital, Guangdong Huizhou 516001, China)
OBJECTIVE:To probe into the clinical efficacy of caspofungin and voriconazole in treatment of patients with severe invasive fungal infections. METHODS: 100 cases of invasive fungal infections were selected to be divided into observation group and control group via random number table, with 50 cases in each. The observation group were treated with caspofungin (70 mg loading dose, 50 mg maintenance dose) intravenous infusion, while the control group were given voriconazole (400 mg loading dose, 200 mg maintenance dose) intravenous infusion; the clinical efficacy were compared between two groups. RESULTS: The recovery rate of observation group was 44.00%(22/50), the total effective rate was 86.00%(43/50), higher than those of control group 32.00%(16/50) and 74.00%(37/50), with statistically significant difference(P<0.05). The average hospitalization time, average hospitalization cost of observation group were significantly lower than those of control group, yet the rate of bacteria clearance was higher than that of control group, with statistically significant difference(P<0.05). After treatment of 4 days, the decrease of numeration of leukocyte, C reactive protein and procalcitonin in observation group was more significant than that of before group, and significantly higher than that of control group, with statistically significant difference(P<0.05). There were few changes in liver and kidney function in two groups. CONCLUSIONS: The efficacy of caspofungin in treatment of patients with severe invasive fungal infections is significant, with few adverse drug reactions, which can be used for patients with severe anti-fungal therapy.
Caspofungin; Voriconazole; Invasive fungal infections
R978.5
A
1672-2124(2016)08-1030-03
10.14009/j.issn.1672-2124.2016.08.008
2016-02-19)
*药师。研究方向:临床药学。E-mail:676234318@163.com

