神经营养因子-3通过W n t通路促进人骨髓间充质干细胞生长和成骨分化的研究*
张善强,李永涛,孙石柱,姚立杰,徐桂清,沈雷
(齐齐哈尔医学院 解剖教研室,黑龙江 齐齐哈尔 161006)
论著
神经营养因子-3通过W n t通路促进人骨髓间充质干细胞生长和成骨分化的研究*
张善强,李永涛,孙石柱,姚立杰,徐桂清,沈雷
(齐齐哈尔医学院 解剖教研室,黑龙江 齐齐哈尔 161006)
目的阐明神经营养因子-3(NT-3)促进人骨髓间充质干细胞分化为成骨细胞的能力,并分析W n t通路的作用机制。方法正常培养的人骨髓间充质干细胞为对照组;NT-3刺激的人骨髓间充质干细胞为NT-3组;加入I CG-001作用30m in后,用NT-3刺激者为W n t抑制剂组,每组进行成骨诱导实验。利用噻唑蓝细胞增殖、酶联免疫吸附试验、W e s t e r n blot检测、茜素红染色等实验分别检测各组人骨髓间充质干细胞增殖、细胞凋亡、碱性磷酸酶、骨形态发生蛋白-1(B M P-1)等蛋白表达及钙结节形成能力。结果与对照组比较,NT-3组间充质干细胞(M S C)增殖吸光度值增高(P<0.01);NT-3组碱性磷酸酶活性、B M P-1等蛋白表达或茜素红染色效果均高于对照组(P<0.01);与NT-3组比较,W n t抑制剂组M S C增殖吸光度值降低(P<0.01);而W n t抑制剂组的碱性磷酸酶活性、B M P-1等蛋白表达均低于NT-3组(P<0.01)。结论NT-3通过W n t通路,促进人骨髓间充质干细胞的增殖和成骨分化。
神经营养因子-3;人骨髓间充质干细胞;成骨分化;W n t通路
肿瘤、外伤、炎症原因所造成的骨质损伤,严重威胁患者的健康和生存质量。促进骨损伤的修复一直是组织工程等领域的研究热点[1]。间充质干细胞(mesenchymal stem cells,M S C)可以向骨、软骨、血管内皮细胞等多种细胞分化[2],已成为组织工程中种子细胞的主要来源。
临床工作发现,骨折区如果缺少血管营养或神经支配,断离的骨质往往难以愈合[3]。人体神经组织的生长与血管网络的形成相互作用、伴行生长[4-5]。因此笔者设想,神经因子可能在骨修复及骨再生中发挥重要作用。
神经营养因子-3(Ne u rotrophin-3,NT-3)是近年来发现的一种重要的神经营养家族成员[6],具有维持神经元存活、促进M S C分化为神经细胞[7]和促血管新生等作用[8]。如果挖掘NT-3对M S C成骨分化的影响,将对应用NT-3和M S C的组织工程技术,促进骨组织血管、神经再生,修复骨损伤等具有重要作用。目前,以NT-3促进M S C成骨分化的研究却鲜有报道。本实验拟阐明NT-3对人M S C生长和成骨分化能力的影响,为骨组织工程研究奠定研究基础。
1 材料与方法
1.1细胞培养与分组
人骨髓间充质干细胞(广州赛业生物有限公司),以含10%胎牛血清(美国G bico公司),1μmol/L青霉素(美国S i g ma公司),100 u/ml链霉素(美国S i g ma公司),2mmol/L谷氨酰胺(美国H yclone实验室)的α-M E M培养基为M S C基础培养基。含1×10-7mol/L地塞米松(美国S i g ma公司)、50 m g/L抗坏血酸C(美国S i g ma公司)、10mmol/Lβ-甘油磷酸钠(美国S i g ma公司)的α-M E M培养基为成骨诱导培养基。
NT-3组中加入100 n g/ml人NT-3重组蛋白(美国R D公司);在成骨诱导培养基中预先加入100 mmol/L ICG-001(美国R D公司)作用30 min,0.01mmol/L磷酸缓冲盐溶液(phosphate b uff er saline,P B S)清洗3次,用100 n g/ml NT-3刺激者为W nt抑制剂组;无刺激者为对照组。
1.2方法
1.2.1噻唑蓝[3-(4,5)-d i m e th y lth i a h i az o(-z-y1)-3,5-d i-p h e n y t e tr az ol i u m ro m i d e,M TT]实验检测细胞增殖根据M S C诱导实验的分组情况,将各组细胞按每孔2×103接种于96孔培养板,37℃、5%二氧化碳C O2培养48h,每孔中加入20μl、5m g/ml M TT(美国S i g ma公司),孵育4 h,加入150μl二甲基亚砜(美国S i g ma公司),连续振荡10min后,用Ema x酶标仪(美国M olec u lar De v ices公司)在490 nm波长检测每组样品吸光度(optical delnsity,O D)值。
1.2.2W e s t e r n blot检测 C a s pa s e-3蛋白的表达培养每组5×106个细胞,裂解细胞,25μg蛋白样品;依次经过十二烷基硫酸钠-聚丙烯酰胺(sodi u m dodecyls u l f ate-polyacrylamideg elelectrophoresis,S D S-P A G E)凝胶电泳、转膜、封闭等步骤;一抗使用小鼠抗人C aspase-3抗体(1∶150,英国A bcam公司),二抗使用辣根过氧化物酶标记山羊抗小鼠免疫球蛋白G;增强化学发光法(enhanced chemil u minescence,E C L)检测蛋白表达,I ma g e-P ro P l u s 6.0软件分析各蛋白条带相对吸光度作定量计算。选用β-actin(英国A bcam公司)为内参对照组。
1.2.3酶联免疫吸附试验(e n zy m e l in ke d i mm u n o s orb e n t a ss ay,EL ISA)检测碱性磷酸酶(al k aline phosphatase,A L P)、骨形态发生蛋白-1(bone morpho g enetic protein-1,B MP-1)的表达。使用人E L I S A试剂盒(美国R D公司)检测各实验组中A L P、B MP-1蛋白表达,严格按照说明书进行操作。1.2.4茜素红染色各组M S C诱导14 d后,用0.01 mol/L P B S冲洗3遍,4%多聚甲醛溶液固定60min,1%茜素红染色15min,再用0.01mol/L P B S漂洗,B I X显微镜(日本O lymp u s公司)观察。I ma g e-P ro P l u s 6.0软件分析各组茜素红染色的光密度。
1.3统计学方法
采用S P SS 18.0统计软件进行数据分析,计量资料以均数±标准差(x±s)表示,多组间比较用方差分析,若方差齐则两两比较用t检验,P<0.05为差异有统计学意义。
2 结果
2.1MSC细胞增殖检测结果
对照组细胞增殖的O D值为(0.440±0.257),NT-3组为(0.980±0.248),W nt抑制剂组为(0.685±0.251),经方差分析,差异有统计学意义(F=20.720,P=0.000)。NT-3组与对照组的M S C增殖O D值比较,经t检验,差异有统计学意义(t=6.415,P=0.001),NT-3组M S C增殖O D值高于对照组;W nt抑制剂组与NT-3实验组的M S C增殖O D值比较,经t检验,差异有统计学意义(t=3.547,P=0.001),W nt抑制剂组M S C增殖O D值低于NT-3实验组。见图1。
2.2MSC细胞凋亡检测结果
对照组C aspase-3蛋白相对含量为(1.250± 0.254),NT-3组为(0.690±0.239),W nt抑制剂组为(0.889±0.243),经方差分析,差异有统计学意义(F= 24.080,P=0.000)。NT-3组与对照组的C aspase-3蛋白相对含量比较,经t检验,差异有统计学意义(t=6.812,P=0.001),NT-3组C aspase-3蛋白相对含量低于对照组;W nt抑制剂组与NT-3组的C aspase-3蛋白相对含量比较,经t检验,差异有统计学意义(t=2.477,P=0.018),W nt抑制剂组C aspase-3蛋白相对含量高于NT-3组。见图2。
2.3细胞的A LP和BMP-1的表达
对照组、NT-3组和W nt抑制剂组的A L P、B MP-1蛋白浓度比较,经方差分析,差异有统计学意义(P<0.01)(见附表)。NT-3组A L P和B MP-1蛋白与对照组比较,经t检验,差异有统计学意义(t=10.497和19.792,P=0.001),NT-3组A L P和B MP-1蛋白均高于对照组;W nt抑制剂组A L P和B MP-1蛋白浓度与NT-3组比较,经t检验,差异有统计学意义(t= 6.474和10.919,P=0.001),W nt抑制剂组A L P和B MP-1蛋白浓度均低于NT-3组。见图3。
2.4细胞茜素红染色结果

图1 MTT法检测各组MSC增殖的OD值

图2 Wester n blot检测各组Caspase-3蛋白的表达
附表 各组细胞的A LP蛋白浓度方差分析 (n=18)

附表 各组细胞的A LP蛋白浓度方差分析 (n=18)
组别P值对照组 1 . 2 5 5 ± 0 . 2 5 6 1 . 7 9 1 ± 0 . 2 1 3 N T -3组 2 . 1 9 0 ± 0 . 2 7 8 5 6 . 7 0 0 0 . 0 0 0 3 . 4 9 6 ± 0 . 2 9 7 2 0 5 . 9 2 0 0 . 0 0 0 W n t抑制剂组 1 . 6 0 5 ± 0 . 2 6 4 2 . 5 1 0 ± 0 . 2 4 2 A L P蛋白浓度F 值P 值B M P -1蛋白浓度F 值

图3 各组细胞的A LP、BMP-1表达
对照组茜素红染色的光密度值为(0.426± 0.145),NT-3组为(0.857±0.187),W nt抑制剂组为(0.706±0.159),经方差分析,差异有统计学意义(F=31.780,P=0.000)。NT-3组茜素红染色的光密度与对照组比较,经t检验,差异有统计学意义(t=7.727,P=0.001),NT-3组茜素红染色的光密度高于对照组;W nt抑制剂组茜素红染色的光密度与NT-3组比较,经t检验,差异有统计学意义(t=2.610,P= 0.013),W nt抑制剂组茜素红染色的光密度低于NT-3组。见图4。
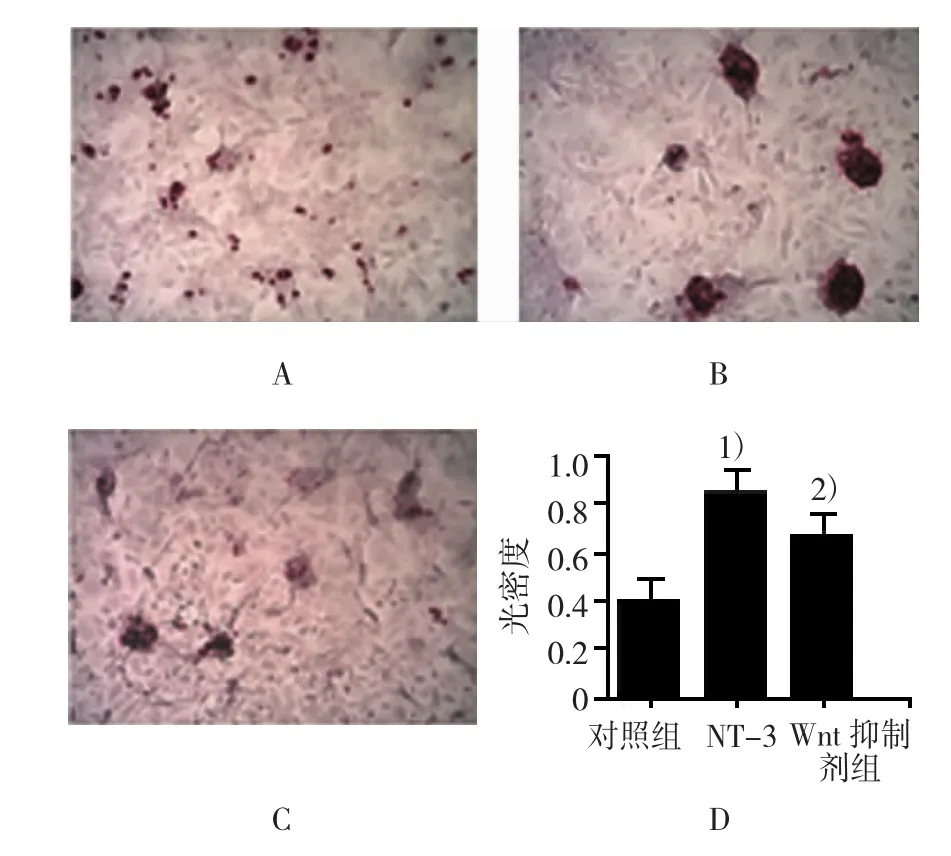
图4 各组细胞茜素红染色结果
3 讨论
目前,以组织工程技术进行骨损伤的治疗方法主要有自体或异体骨移植及利用羟基磷灰石、脱钙骨等技术制作人工骨组织材料等[9],虽然,这些方法各有优点,但同时也面临着诸如二次手术损伤、供体来源限制或存在免疫排斥反应、传播疾病、医学伦理等诸多问题[10]。
目前,骨组织工程成为促进骨质修复的重要手段,高分子支架材料适应于M S C生长和骨组织的修复[11]。M S C广泛存在于人体骨髓、脂肪等部位,并具有向骨、软骨、血管内皮细胞等组织细胞分化的特性,被广泛应用于骨损伤、心血管系统等疾病的治疗中,并取得较好的疗效。若在M S C培养基中加入地塞米松、维生素C和β-甘油磷酸钠,能够较好地促进M S C分化为成骨细胞[12],笔者的实验以上述经典的成骨诱导培养基为基础进行实验。若单独应用M S C修复骨缺损,往往难以达到理想效果,M S C向成骨细胞分化及促进成骨细胞增殖代谢等,还需要B MP-1、表皮细胞生长因子、血管内皮生长因子、胰岛素样生长因子等成骨诱导生物活性因子参与[13-14]。如果找到合适的骨活性因子,促进M S C成骨能力,必将加快成骨效果,对骨损伤修复具有重大意义。
临床工作发现,缺少神经支配或神经支配减弱的骨骼容易骨折或骨质疏松,笔者考虑神经因素在骨修复中扮演极为重要的角色。神经血管病变,会使骨组织失去神经血管支配或营养,而导致骨组织重塑修复功能障碍[15]。上述研究结果提示笔者,与其利用细胞因子单纯的促进M S C向成骨细胞分化,不如寻找一种能够促进神经、血管新生,并对M S C成骨分化具有效果的多功能细胞因子。
NT-3作为神经营养因子家族的重要成员,能够激化Tr k C发挥生物学效应,促进脊髓损伤平面神经元存活及其轴突再生。NT-3还能够激活W nt通路,W nt通路在胚胎血管、肢体等形成或发育过程中发挥重要作用。W nt通路活化,可以使胞质内的βcatenin积聚,导致下游K remen、N g n2、P a x6等基因高表达,促进血管内皮细胞、神经轴突等迁移,重塑肢体骨骼形成[16-17]。同时发现,NT-3也可有效地促进M S C向神经元分化[18]。近年来发现,NT-3与血管内皮细胞表面的Tr k C受体结合,在血管新生的过程中发挥重要作用[19],NT-3修饰的M S C能有效地促进M S C增殖并分化为血管内皮细胞,加快糖尿病性小鼠皮肤溃疡的愈合[12]。而脑源性神经营养因子、神经肽Y、NT-4能够促进M S C向成骨细胞分化[20],但有关NT-3对骨组织再生及修复的研究鲜见报道。
本实验发现,NT-3组的M S C增殖显著增高,而W nt抑制剂组的M S C增殖却明显降低,提示NT-3与M S C细胞膜上NT-3的特异性受体Tr k C结合,激活W nt通路[21],通过W nt通路而促进M S C的增殖。M S C成骨分化实验中发现,与对照组比较,NT-3组的茜素红染色效果显著优于对照组,其钙化结节数量多,面积大,说明NT-3能诱导细胞聚集生长和钙盐沉积,具有明显的促M S C成骨作用;与NT-3组比较,W nt抑制剂组的钙化结节数量明显降低,团块状也较前者小,说明W nt抑制剂组的促M S C成骨作用明显低于NT-3组。A L P作为M S C早期成骨分化的指标,能够反映M S C成骨分化的能力。本实验发现,NT-3组M S C成骨分化效果明显,A L P表达较高,W nt抑制剂组A L P表达降低,证明NT-3激活M S C内的W nt通路,促使M S C向成骨细胞分化,证明NT-3能够重新启动成骨分化机制,间接证明神经因子在M S C成骨分化中的重要作用。如果在临床适当应用神经因子将加快骨折等疾病的修复和重建。也有研究发现,NT-3尚能通过激活A k t通路,而促进高糖环境M S C旁分泌血管内皮生长因子等细胞因子[8,12,20]。因此不排除NT3在促进M S C成骨分化的过程中,可能会存在A k t、Er k等信号机制[22]。
综上所述,NT-3能有效促进M S C向成骨细胞分化。NT-3具备作为良好骨诱导活性因子和促进神经血管新生的潜质。笔者将探讨M S C联合生物活性因子及生物支架,开发原位诱导性生物材料,以期达到骨组织工程支架材料的优化与整合,更好地发挥神经血管源性细胞因子和M S C等干细胞在骨再生及修复中的作用,为骨组织工程修复的发展奠定研究基础。
[1]D IMI T R I OU R,JO NE S E,MCG O N A G L E D,et al.B one re g eneration:c u rrent concepts andfu t u re directions[J].B MCM ed,2011,9:66.
[2]NE O F Y T OU E,DE U S E T,B E Y G U I R E,et al.M esenchymal stromal cell therapy:di ff erent so u rces e x hibit di ff erent imm u nobiolo g ical properties[J].Transplantation,2015,99(6):1113-1118.
[3]S A R A N U,G E MI N I P S,C H A TTE R J EE S.R ole o f an g io g enesis in bone repair[J].A rch B iochem B iophys,2014,561(2):109-117. [4]M E L A N I M,W E I N S TE I N B M.C ommon f actors re g u latin g patternin g o f the ner v o u s and v asc u lar systems[J].A nn u R e v C ell De v B iol,2010,26:639-665.
[5]T A BB AA S M,HO R T O N C O,J E R A Y K J,et al.R ole o f v asc ularityf or s u ccess fu l bonef ormationandrepair[J].C rit R e v B iomed En g,2014,42(3/4):319-348.
[6]C H A L A Z O N I T I S A.Ne u rotrophin-3 as an essential si g nal f or the de v elopin g ner v o u s system[J].M ol Ne u robiol,1996,12(1):39-53. [7]D O N G Y,Y A N G L,Y A N G L,et al.Transplantation o f ne urotrophin-3-trans f ected bone marro w mesenchymal stem cells f or the repair o f spinal cord in j u ry[J].Ne u ral R e g en R es,2014,9(16): 1520-1524.
[8]C R I S T O F A R O B,S T O NE O A,C A P O R A L I A,et al.Ne urotrophin-3 is a no v el an g io g enic f actor capable o f therape u tic neo v asc u lari z ation in a mo u se model o f limb ischemia[J].A rterioscler Thromb V asc B iol,2010,30(6):1143-1150.
[9]G A R CI A-G A R ET A E,C O A T HU P M J,B L U NN G W.O steoind u ction o f bone g ra f tin g materials f or bone repair and re g eneration[J].B one,2015,81:112-121.
[10]A G A R W A L R,G A R CI A A J.B iomaterial strate g ies f or en g ineerin g implants f or enhanced osseointe g ration and bone repair[J]. A d v Dr u g Deli v R e v,2015,94:53-62.
[11]S U N H,Y A N G H L.C alci u m phosphate sca ff olds combined w ith bone morpho g enetic proteins ormesenchymal stem cells in bone tiss u e en g ineerin g[J].C hin M ed J(En g l),2015,128(8): 1121-1127.
[12]S H EN L,Z EN G W,WU Y X,et al.Ne u rotrophin-3 accelerates w o u nd healin g in diabetic mice by promotin g a paracrine re sponse in mesenchymal stem cells[J].C ell Transplant,2013,22(6): 1011-1021.
[13]A M B I K A IP A L A N A,WO N G J M,KH A N W S.P reclinical and clinical st u dies on the u se o f stem cells f or bone repair:a systematic re v ie w[J].C u rr S tem C ell R es Ther,2013,8(3):210-216.
[14]F I S H E R D M,WO N G J M,C R OW L E Y C,et al.P reclinical and clinical st u dies on the u se o f g ro w th f actors f or bone repair:a systematic re v ie w[J].C u rr S tem C ell R es Ther,2013,8(3): 260-268.
[15]C H EN W H,M A O C Q,Z HUO L L,et al.B eta-ner v e g ro w th f actor promotes ne u ro g enesis and an g io g enesis d u rin g the repair o f bone de f ects[J].Ne u ral R e g en R es,2015,10(7):1159-1165.
[16]U D A R T S E V A OO,A ND R EE V A E R,BU R A VKOV A L B.W NT-associated g ene e x pression in h u man mesenchymal stromal cells u nder hypo x ic stress[J].Do k l B iochem B iophys,2015,465(1): 354-357.
[17]YU Q,L I U L,D U A N Y,et al.W nt/beta-catenin si g nalin g re gu lates ne u ronal di ff erentiationo f mesenchymal stemcells[J]. B iochem B iophys R es C omm u n,2013,439(2):297-302.
[18]Z H A N G Y Q,H E L M,X I N G B,et al.Ne u rotrophin-3 g enemodi f ied S ch w ann cells promote Tr k C g ene-modi f ied mesenchymal stem cells to di ff erentiate into ne u ron-li k e cells in poly (lactic-acid-co-g lycolic acid)m u ltiple-channel cond u it[J].C ells Tiss u es O r g ans,2012,195(4):313-322.
[19]C H EN Y F,Z EN G X,Z H A N G K,et al.Ne u rotrophin-3 stim u lates mi g ration o f mesenchymal stem cells o v ere x pressin g Tr k C[J]. C u rr M ed C hem,2013,20(24):3022-3033.
[20]H E S,S H EN L,WU Y,et al.E ff ect o f brain-deri v ed ne urotrophic f actor on mesenchymal stem cell-seeded electrospinnin g biomaterial f or treatin g ischemic diabetic u lcers v ia milie u-dependent di ff erentiation mechanism[J].Tiss u e En g P art A,2015,21(5/6):928-938.
[21]K R Y L OV A O,H E RR E R O S J,C L E V E RL E Y K E,et al.W NT-3,e x pressed by motone u rons,re g u lates terminal arbori z ation o f ne u rotrophin-3-responsi v espinal sensoryne u rons[J].Ne u ron,2002,35(6):1043-1056.
[22]W A N G W X,HU X Y,X I E X J,et al.Ner v e g ro w th f actor ind u ces cord f ormation o f mesenchymal stem cell by promotin g proli f eration and acti v atin g the PI3K/A k t si g nalin g path w ay[J]. A cta P harmacol S in,2011,32(12):1483-1490.
(童颖丹 编辑)
Neurotrophin-3 promotes grow th and osteogenic differentiation of human bone marrow mesenchymal stem cells through W nt pathway*
Shan-qiang Zhang,Yong-tao Li,Shi-zhu Sun,Li-jie Yao,Gui-qing Xu,Lei Shen
(Department of Anatomy,Qiqihaer Medical College,Qiqihar,Heilongjiang 161006,China)
Objective To clarify the ability of neurotrophin-3(NT-3)in promoting the differentiation of human bone marrow mesenchymal stem cells(hMSCs)into osteoblasts,and analyze the mechanism of Wnt pathway.M ethods Normal cultured hMSCs were into control group,hMSCs stimulated by NT-3 were into NT-3 group,hMSCs added with ICG-001 acting for 30 min before stimulation of NT-3 were taken as Wnt inhibitor group.The experiment of osteogenic induction was performed in each group.MTT,ELISA,Western blot and alizarin red staining were used to detect hMSC proliferation,apoptosis,alkaline phosphatase activity (ALP),bone morphogenetic protein-1(BMP-1)and other proteins,and ability of calcium nodule formation respectively in each group.Results Compared with the control group,the OD value of hMSC proliferation in the NT-3 group significantly increased(P<0.01);the expressions of ALP,BMP-1 and other proteins,and the effect of alizarin red staining of the NT-3 group were significantly higher than those in the control group(P<0.01).Compared with the NT-3 group,the OD value of hMSC proliferation in the Wnt inhibitor group significantly decreased(P<0.01);the expressions of ALP,BMP-1 and other proteins of the Wnt inhibitor group were lower than those in the NT-3 group(P<0.01).Conclusions NT-3 promotes the proliferation and osteogenic differentiation of hMSCs through Wnt pathway
neurotrophin-3;human mesenchymal stem cell;osteogenic differentiation;Wnt pathway
R 318.0
A
10.3969/j.issn.1005-8982.2016.15.002
1005-8982(2016)15-0006-05
2016-01-28
国家自然科学基金(No:81541137);齐齐哈尔医学院博士基金(No:Q Y2015B-04)
沈雷,E-mail:shenleiby@126.com;Tel:0452-2663205

