促血管生成素重组腺病毒对糖尿病鼠肾血管新生的影响*
张子阳,谭州科,曹明燕,杨亦彬
(遵义医学院附属医院 肾病风湿科,贵州 遵义 563003)
·论著·
促血管生成素重组腺病毒对糖尿病鼠肾血管新生的影响*
张子阳,谭州科,曹明燕,杨亦彬
(遵义医学院附属医院 肾病风湿科,贵州 遵义 563003)
目的通过SD大鼠糖尿病肾病(DN)模型,观察经腺病毒外源性表达Ang-1对肾脏血管新生的作用,以期为DN的临床治疗提供参考。方法SD大鼠DN造模选用链脲佐菌素(STZ),设计两个大的组别,即正常对照组和DN模型组,并将DN模型组进一步划分为3个亚组,即糖尿病组、空白载体组、Ang-1腺病毒组。STZ造模成功后的第8周开始,从尾静脉注入Ang-1腺病毒载体以及空白载体,在8、12、20和28周,检测各组大鼠的尿蛋白水平,实时定量聚合酶链法分析肾脏Ang-2 mR NA水平。结果①DN模型组大鼠的尿蛋白水平较正常对照组升高(P<0.01),且只有在20周前,空白载体组及糖尿病组的尿蛋白水平才低于Ang-1腺病毒组(P<0.01);②在正常对照组大鼠肾组织中未检测到尿蛋白和Ang-2 mR NA表达,而其他DN模型组(糖尿病、空白载体、Ang-1腺病毒组)大鼠12周后的尿蛋白和Ang-2 mR NA表达升高,特别是Ang-1腺病毒组升高(峰值在20周)更为明显(P<0.05),在28周时降低,糖尿病、空白载体和Ang-1腺病毒组的Ang-2 mR NA表达比较差异有统计学意义(P<0.05);③Ang-2与尿蛋白排泄量呈负相关(r=-0.601,P<0.05)。结论外源性给予Ang-1对糖尿病肾脏新生微血管生成有保护作用。
促血管生成素;糖尿病肾病;血管生成;腺病毒载体
糖尿病肾病(diabetic nephropathy,DN)属于糖尿病严重微血管并发症,也是导致患者发生终末期肾脏病的重要原因[1]。研究表明,糖尿病肾病患者的血管调控因子普遍存在表达异常,患者的肾小球中存在新生血管[2],糖尿病肾病的发生与微血管病变密切相关,其发病机制复杂[3]。如何减少血管内皮损伤和促进修复已成为研究热点[4]。促血管生成素-1(A n g iopoietin-1,A n g-1)是近年来发现的促血管生长细胞因子,有促血管发生以及组织修复的重要功能,同时也有抗炎、缓解血管渗漏、抗内皮细胞凋亡等作用,越来越受到研究者的关注。另有实验发现,A n g-1下调可能导致糖尿病肾病后期新生血管消失[5],本实验通过给予糖尿病大鼠A n g-1腺病毒载体,观察其28周的尿蛋白、肾脏促血管生成素-2(A n g iopoietin-2,A n g-2)m R N A和蛋白表达变化,评估A n g-1对糖尿病大鼠肾脏新生血管的影响。
1 材料与方法
1.1研究动物
本研究动物为南京模式生物研究所购买的雄性S pra g u e-Da w ley大鼠,共140只。
1.2研究方法
1.2.1构建Ang-1腺病毒载体A n g-1腺病毒载体由大连宝生物工程有限公司构建,滴度为2.5× 1010p fu/ml。
1.2.2造模和分组采用链脲佐菌素(S trepto z otocin,S T Z)(55m g/k g)腹腔注射复制糖尿病模型,连续3 d血糖≥16.65mmol/L示造模成功。实验动物随机分为:①A n g-1腺病毒组。造模完成后8周,根据预实验结果以及参考文献[6]决定A n g-1腺病毒的实际注射量,本研究采用4×1011p fu/ml;②空白载体组,与A n g-1腺病毒同病毒低毒的阴性对照组,注射剂量同A n g-1腺病毒;③糖尿病组,腹腔注射S T Z造模,剂量为55m g/k g;④正常对照组,不做处理。分组完成后的第8、12、20和28周,每组分别选择6只大鼠在不同时间点进行观察及分析,每组35只。
1.2.3样品处理于实验的第8、12、20和28周腹腔注射麻醉,取部分肾组织(兼顾皮、髓质)迅速放入液氮中,以备后续实验使用;另取部分肾组织置于4%多聚甲醛液固定,24 h后转入95%酒精溶液中,并进行后续的梯度脱水、石蜡包埋和切片处理。
1.2.424 h尿蛋白定量检测采用7150型全自动生化分析仪(日本日立公司)进行24 h尿蛋白定量检测。
1.2.5肾组织Ang-2、血栓调节蛋白(T hro m bom odul in-1,T M-1)检测采用免疫荧光链霉亲和素-生物素复合物-异硫氰酸荧光素法检测肾组织A n g-2、血栓调节蛋白,按说明书及参考文献操作步骤操作。
1.2.6肾组织Ang-2 mR NA检测R N A提取及纯化按说明书及参考文献操作步骤操作。引物采用P R IM E R 5软件设计,并经上海生物工程有限公司合成。β肌动蛋白(β-actin)的正向引物:5'-GG A G A TT A C T GCCC T GGC T CC T A-3',反向引物:5'-G A C T C A T CG T A C T CC T GC TT GC T G-3';A n g-2正向引物:5'-C T CC T G T G A GC A T C T GGG AA C-3',反向引物:5'-GCG GGC AAAA T C A G T A GC A-3'。
1.3统计学方法
采用S P SS 20.0统计软件进行数据分析,计量资料以均数±标准差(x±s)表示,多组间数据比较用单因素方差分析,不同时间点数据比较用重复测量方差分析,P<0.05为差异有统计学意义。
2 结果
2.124 h尿蛋白
①正常对照组大鼠各时间点24 h尿蛋白比较差异无统计学意义(与8周比较:t12周=0.256,P12周= 0.800;t20周=0.198,P20周=0.844;t28周=1.686,P28周= 0.100)。②各组大鼠不同时间点的24 h尿蛋白经重复测量方差分析,差异有统计学意义(F=5.731,P=0.005)。与正常对照组比较,A n g-1腺病毒组、空白载体组和糖尿病组不同时间点的尿蛋白均高于正常对照组(t8周=15.122、15.298和45.559,P8周=0.000、0.000 和0.000;t12周=17.928、19.904和16.962,P12周=0.000、0.000和0.000;t20周=32.680、19.904和28.918,P20周= 0.000、0.000和0.000;t28周=21.090、20.685和28.222,P28周=0.000、0.000和0.000)。A n g-1腺病毒组尿蛋白在第12周后逐渐减少,在第20周以后低于空白载体组(t20周=5.002,P20周=0.000)和糖尿病组(t20周=2.682,P20周=0.010),差异有统计学意义。见表1和图1。
2.2肾脏Ang-2 m RN A及Ang-2水平(灰度值)
2.2.1Ang-2 mR NA表达①各组大鼠肾组织A n g-2 m R N A经重复方差分析,差异有统计学意义(F=3.981,P=0.020)。②A n g-2 m R N A在正常对照组中不表达;其余3组A n g-2 m R N A表达在12周开始上调,峰值均在20周。A n g-1腺病毒组A n g-2 m R N A表达普遍上调,其中在12、20和28周时A n g-2 m R N A表达高于空白载体组(t12周=22.718,P12周=0.000;t20周= 14.406,P20周=0.000;t28周=7.659,P28周=0.000)和糖尿病组(t12周=23.197,P12周=0.000;t20周=13.201,P20周= 0.000;t28周=24.882,P28周=0.000);另外,在不同时间点,空白载体组的A n g-2 m R N A表达与糖尿病组比较,差异无统计学意义(t12周=0.642,P12周=0.262;t20周= 1.645,P20周=0.052;t28周=0.254,P28周=0.400)。见表2和图2。
表1 各组大鼠不同时间点24 h尿蛋白比较

表1 各组大鼠不同时间点24 h尿蛋白比较
组别2 8周正常对照组 1 2 . 1 2 ± 1 . 3 8 1 2 . 2 3 ± 2 . 1 4 1 2 . 2 3 ± 2 . 9 8 1 2 . 8 7 ± 2 . 2 4 A n g -1腺病毒组5 2 . 3 3 ± 1 5 . 6 7 6 6 . 8 3 ± 1 7 . 8 9 5 7 . 1 7 ± 7 . 5 7 4 0 . 5 0 ± 7 . 4 2空白载体组 5 2 . 2 3 ± 1 5 . 4 5 7 0 . 3 1 ± 1 7 . 1 3 6 8 . 5 5 ± 1 1 . 1 3 7 1 . 5 4 ± 1 6 . 6 3糖尿病组 3 9 . 2 4 ± 3 . 2 4 5 7 . 1 5 ± 1 5 . 5 2 6 6 . 0 1 ± 1 4 . 2 1 7 5 . 8 0 ± 1 3 . 0 0 8 周1 2 周2 0 周

图1 各组大鼠不同时间点24 h尿蛋白变化趋势
表2 各组大鼠不同时间点肾组织Ang-2 m RN A表达比较

表2 各组大鼠不同时间点肾组织Ang-2 m RN A表达比较
组别2 0 周2 8周正常对照组 - - -A n g -1腺病毒组 2 . 3 4 ± 0 . 4 8 4 . 7 9 ± 1 . 5 1 1 . 1 9 ± 0 . 2 0空白载体组 0 . 4 2 ± 0 . 1 4 1 . 2 1 ± 0 . 3 5 0 . 2 6 ± 0 . 6 9糖尿病组 0 . 4 0 ± 0 . 1 2 1 . 3 4 ± 0 . 3 1 0 . 2 3 ± 0 . 1 1 1 2 周

图2 各组大鼠不同时间点肾组织Ang-2 m RN A表达变化趋势
表3 各组大鼠不同时间点Ang-2水平(灰度值)比较

表3 各组大鼠不同时间点Ang-2水平(灰度值)比较
组别2 8周正常对照组 - - -A n g -1腺病毒组 5 1 . 2 5 ± 1 . 2 3 9 5 . 2 1 ± 2 . 2 4 4 2 . 1 1 ± 0 . 7 2空白载体组 3 9 . 8 0 ± 0 . 7 2 7 9 . 3 3 ± 1 . 0 3 3 5 . 0 9 ± 0 . 7 3糖尿病组 4 0 . 1 2 ± 1 . 4 1 6 9 . 7 9 ± 1 . 6 2 3 6 . 3 6 ± 0 . 9 0 1 2 周2 0 周
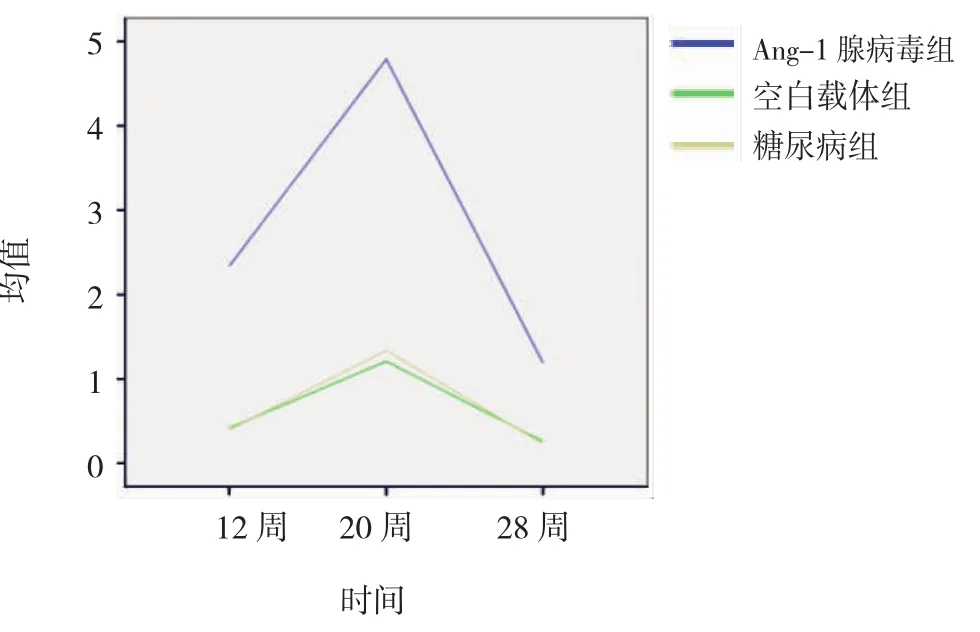
图3 各组大鼠不同时间点Ang-2水平(灰度值)变化趋势
2.2.2Ang-2水平(灰度值)①各组大鼠肾组织A n g-2水平灰度值,经重复方差分析,差异有统计学意义(F=4.751,P=0.001)。②正常对照组未发现A n g-2荧光表达,其余3组在第12周后肾小管周围出现荧光,A n g-1腺病毒组荧光强于空白载体组(F12周=1.685,t12周=48.222,P12周=0.000;F20周=1.440,t20周= 38.662,P20周=0.000;F28周=1.440,t28周=41.096,P28周= 0.000)和糖尿病组(F12周=1.632,t12周=35.705,P12周= 0.000;F20周=1.861,t20周=55.195,P20周=0.000;F28周= 1.341,t28周=29.515,P28周=0.000)。见表3和图3、4。
2.3指标的相关性分析
尿蛋白和A n g-2的测定结果表明,A n g-2荧光灰度值与尿蛋白呈负相关(t=28.507,r=-0.601,P= 0.000)。见图5。
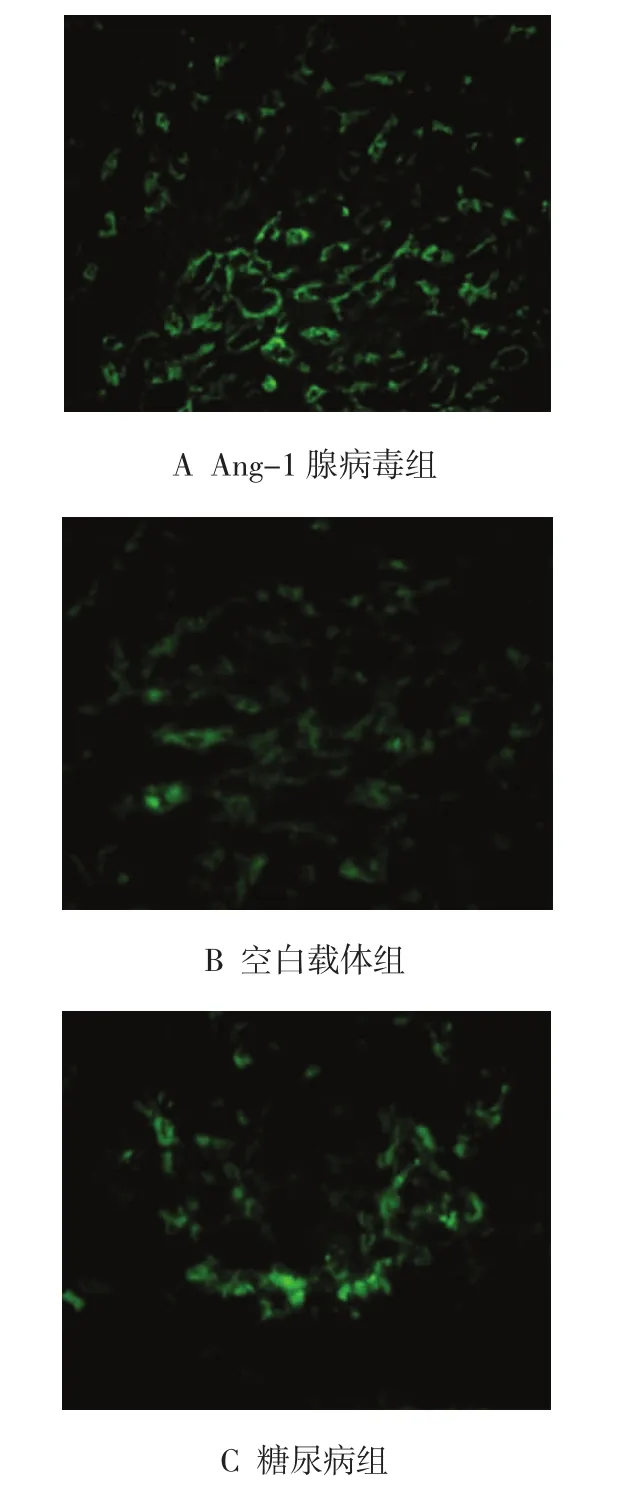
图4 3组大鼠肾组织Ang-2表达荧光图 (20周,×200)
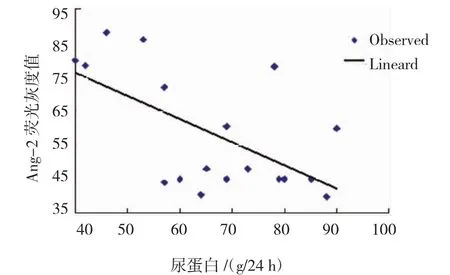
图5 Ang-2荧光灰度值与尿蛋白散点图
3 讨论
慢性肾脏疾病的发病机制较为复杂,其中慢性缺氧以及微血管病变起重要作用,可诱发肾脏周围血管调控因子失衡及微血管结构受到破坏,同时与微血管内皮细胞发生损伤及修复也有密切关系。近年来,慢性疾病药物开发及治疗的热点开始转向治疗血管生成。目前,慢性肾脏疾病重要的病因为糖尿病肾病相关的慢性进展性肾脏疾病。研究表明,该病患者的肾脏微血管出现结构异常,且与管周毛细胞的缺少存在紧密关系[7]。血管新生是指从原有的血管上以发芽或嵌入的方式形成新的毛细血管的过程[8]。一般认为A n g-1具有保持血管稳定和完整性、调节血管功能的作用,而A n g-2使血管的稳定性消失,主要表达在血管修复时的血管[9-10],并涉及血管病变级炎症性疾病的病理生理过程[11]。
A n g是一种能够针对血管内皮细胞发挥作用的细胞因子,能够对新生血管的生成及相关调控发挥重要作用。从种类进行分类,A n g家族可以分为4个亚类,即A n g-1、A n g-2、A n g-3及A n g-4,内皮细胞Tie-2受体可与这4类因子结合并发挥生理功能。其中,A n g-2是内皮细胞产生,与促血管生成素受体Tie-2结合后较为特殊,即不产生磷酸化反应而发挥对A n g-1竞争性抑制作用,是启动血管再次重构的主要因子,在血管新生的后期尤其血管的构建、成熟与稳定需要A n g-2家族的参与。A n g-2是内皮细胞炎症反应的自分泌调节因子。有实验表明,在高血糖情况下,A n g-2在心脏及视网膜等内皮细胞中高表达,并使血管受损伤级内皮细胞凋亡[12]。
本实验中作者采用重组腺病毒A n g-1干预后发现A n g-1腺病毒组A n g-2 m R N A和蛋白表达较糖尿病和空白载体组上调。A n g-1可通过募集血管周细胞和平滑肌细胞重塑血管,促进内皮细胞增殖和修复,形成完整、功能正常的血管网,是维持成熟血管稳定的重要因子;而A n g-2是启动血管再次塑型的关键因子,主要表达于重塑或修复时的血管,A n g-1在糖尿病中后期表达下调,通过外源性A n g-1干预形成更加成熟稳定的血管。A n g-2升高表明糖尿病肾病中后期有血管不完整及不稳定性,表明它是启动血管再次重构的主要因子;糖尿病肾病后期有血管破坏,重塑新生的血管。提示A n g-1对糖尿病肾脏血管新生产生保护效应。另外,研究显示,在腹膜的新生血管形成期间,A n g-1出现下调,这是诱发新生血管后续消失的重要因素;通过给予A n g-1(外源性),有助于减轻糖尿病并发症,诸如能够有效缓解患者血-视网膜屏障紊乱,延缓肾脏纤维化进展[13-14]。
目前采用A n g-1干预性治疗慢性肾脏病尤其是糖尿病肾病的研究报道较少,且多为短期实验观察。本实验旨在探讨促进血管新生和稳定对DN进展的影响,实验中如重组腺病毒A n g-1给予时间、剂量、途径仅参照国外文献,评价血管新生的指标,还有待进一步继续研究。
[1]M O GI L I N S,K R I S H N A S W A M Y V R,J A Y A R A M A N M,et al. A ltered an g io g enic balance in k eloids:a k ey to therape u tic interv ention[J].Transl R es,2012,159(3):182-189.
[2]刘琳,谢志明.血管生成素-1在小鼠肾脏发育中的表达及作用[J].中国生化药物杂志,2012,33(4):430-432.
[3]冯国庆,魏凯,杨万杰,等.血管粘附蛋白-1在糖尿病肾病患者体内水平变化及意义[J].临床研究,2013,21(21):2461-2462.
[4]R E I NDE RS E J,R A B E L I N K T J,B R I S C O E D M.A n g io g enesis and endothelial cell repair in renal disease and allo g ra f t re j ection[J]. J A m S oc Nephrol,2006,17(4):932-942.
[5]尤巧英,黄迪华.血管生成素2及血管内皮生长因子与2型糖尿病大血管病变的关系[J].中国糖尿病杂志,2014,22(3):252-254.
[6]汪琛颖,司马义·萨依木,马晴,等.糖尿病肾病大鼠胰基因组. DN A甲基化状态的变化[J].北京师范大学学报(自然科学版),2004,38(3):395-398.
[7]N A R I S A F,P R A S I T F.R enal micro v asc u lar disease predicts renal fu nction in diabetes[J].R enal F ail u re,2012,34(34):126-129.
[8]M A S A BU MI S.V asc u lar endothelial g ro w th f actor and its receptor system:P hysiolo g ical fu nctions in an g io g enesis and patholo g ical roles in v ario u s diseases[J].J B iochem,2013,153(1):13-19.
[9]R A L U C A A C,A N C A M C,I V A N K A D,et al.E v erolim u s d u al e ff ects o f an area v asc u losaan g io g enesis and lymphan g io g enesis[J]. I n V i v o,2013,27(1):61-66.
[10]何泉,罗海明,朱宝生,等.2型糖尿病肾病患者血管生成素2A1087G基因多态性的研究[J].中国全科医学,2013,4(16): 1216-1220.
[11]A H M ED A,F UJ I S A W A T.M u ltiple roles o f an g iopoieetins in athero g enesis[J].C u rr O pin L ipidol,2011,22(5):380-385.
[12]尤巧英,黄迪华,诸葛福媛.血管生成素2及血管内皮生长因子与2型糖尿病大血管病变的关系[J].中国糖尿病杂志,2014,3(22): 252-254.
[13]林文雄,王彪,苏振民.促血管生成素-1、2及Tie2在血管瘤及血管畸形中的表达及意义[J].中国美容整形外科杂志,2008,1(1): 62-66.
[14]胡国恒,盛望,李旭华,等.益气活血组方对大鼠缺血心肌血管新生因子A n g-1/A n g-2表达的影响[J].中医药导报,2013,8(8):71-74.
(申海菊 编辑)
Effect of recombinant adenovirus angiopoietin-1 on renal angiogenesis in diabetic rats*
Zi-yang Zhang,Zhou-ke Tan,Ming-yan Cao,Yi-bin Yang
(Department of Nephropathy and Rheumatology,the First Affiliated Hospital of Zunyi Medical School,Zunyi,Guizhou 563003,China)
Objective To establish diabetic nephropathy rat model and observe diabetic kidney exogenous expression of angiopoietin-1(Ang-1)by adenovirus and to study its effect on generation of new blood vessels inthe kidneys,inorder toprovidereference for clinical treatment of diabeticnephropathy.M ethods Streptozotocin(STZ)was chosen for diabetic nephropathy modeling of SD rats.The model rats were divided into two groups,namely normal control group and diabetic nephropathy group;and diabetic nephropathy model group was further divided into three subgroups as diabetic group,empty vector group and Ang-1 adenovirus group.Since the eighth week of successful rat modeling,Ang-1 adenovirus vector and empty vector were injected through tail vein.At different time,such as the 8th week,12th week,20th week and 28th week,the level of urine protein content of each group was detected,and kidney level of Ang-2 mRNA was analyzed using real-time quantitative PCR.Results Urinary proteins of the diabetic nephropathy model group were significantly higher than those in the healthy rats(P<0.01),and only in the first 20 weeks,urine protein levels of the empty vector group and the diabetic group were significantly lower than those in the Ang-1treatment group(P<0.01).Urine protein content and Ang-2 mRNA were not detected in healthy kidney tissue of the control group;while those in the diabetes group,empty vector group and Ang-1 adenovirus group were significantly elevated after the 12th week,especially those of the Ang-1 adenovirus group with the peak values at the 20th week(P<0.05);and reduced in the 28th week,Ang-2 mRNA levels of the diabetic group,empty vector group and Ang-1adenovirus group were statistically different(P<0.05).Ang-2 and urinary protein excretion showed a negative correlation(r=-0.601,P<0.05).Conclusions The exogenous administration of Ang-1 in diabetic kidney has a protective effect on angiogenesis.
angiopoietin;diabetic nephropathy;angiogenesis;adenoviral vector
R 587.2
A
10.3969/j.issn.1005-8982.2016.15.001
1005-8982(2016)15-0001-05
2015-12-07
国家自然科学基金(No:81260118)
杨亦彬,E-mail:yyb1011@sina.com;Tel:13765930909

