T h1/T h2/T h17细胞在实验性过敏性结膜炎中的作用研究*
张剑,王冬兰,闫冬梅
(1.佳木斯大学附属第一医院 眼科,黑龙江 佳木斯 154003;2.佳木斯大学基础医学院,黑龙江 佳木斯 154003)
论著
T h1/T h2/T h17细胞在实验性过敏性结膜炎中的作用研究*
张剑1,王冬兰1,闫冬梅2
(1.佳木斯大学附属第一医院 眼科,黑龙江 佳木斯 154003;2.佳木斯大学基础医学院,黑龙江 佳木斯 154003)
目的探讨T h1/T h2/T h17细胞在实验性过敏性结膜炎发病中的可能作用。方法40只B ro w n N or way大鼠随机分为3组:空白组、对照组和实验组。应用鸡卵清蛋白(O V A)复制大鼠过敏性结膜炎模型。取3组大鼠眼球及上下眼睑进行病理学分析,计数穹隆部结膜嗜酸性粒细胞浸润数。EL ISA法测定大鼠血清Ig E、Ig G1、Ig G2a和脾细胞培养上清液I L-17、I L-4、I L-6、I L-10、I F N-γ含量。流式细胞仪测定大鼠外周血和脾脏T h17细胞。结果实验组大鼠穹隆部眼结膜嗜酸性粒细胞浸润数较空白组和对照组升高(P<0.01)。实验组大鼠血清Ig E、Ig G1较空白组和对照组升高(P<0.01),血清Ig G2a较空白组和对照组降低(P<0.01)。实验组大鼠血清脾细胞培养上清液I L-17、I L-4、I L-6、I L-10水平较空白组和对照组升高(P<0.01),I F N-γ水平较空白组和对照组降低(P<0.01)。实验组大鼠外周血和脾脏T h17细胞均高于空白组和对照组(P<0.01)。结论T h1/T h2/T h17细胞平衡失衡是大鼠实验性过敏性结膜炎发病的主要原因。恢复T h1/T h2/T h17失衡可能成为过敏性结膜炎治疗的一条新途径。
过敏性结膜炎;辅助性T细胞1/辅助性T细胞2/辅助性T细胞17;细胞因子
过敏性结膜炎是一种多见于儿童和青少年,易反复发作,常呈季节性加重的变态反应性眼表疾病,患病达人群的20%[1]。近年来随着环境污染加重,变应原增加,发病率逐年增高。过敏性结膜炎确切的发病机制至今尚不十分清楚。以往的研究认为过敏性结膜炎是免疫球蛋白E(imm u no g lob u lin E,I g E)介导的体液免疫和细胞免疫机制[2],但是I g E介导的过敏性结膜炎变态反应的病理生理过程并不完全清楚。本研究拟通过鸡卵清蛋白(Ov alb u min,OV A)致敏、诱导大鼠实验性过敏性结膜炎模型。检测过敏性结膜炎大鼠1型辅助性T细胞(type 1 helper T cell,Th1)/2型辅助性T细胞(type 2 helper T cell,Th2)/17型辅助性T细胞(type 17 helper T cell,Th17)相关细胞因子白细胞介素17(I nterle uk in-17,I L-17)、白细胞介素4(I nterle uk in-4,I L-4)、白细胞介素6(I nterle uk in-6,I L-6)、白细胞介素10(I nter le uk in-10,I L-10)、γ-干扰素(I nter f eron-γ,I F N-γ)及相应抗体I g E、免疫球蛋白G1(imm u no g lob u lin G1,I g G1)、免疫球蛋白G2a(imm u no g lob u lin G2a,I g G2a)水平,揭示过敏性结膜炎的免疫学机制及发病的病理生理过程,为探讨新的治疗靶点和方法提供理论依据。
1 材料与方法
1.1材料
1.1.1实验动物B ro w n Nor w ay大鼠40只(S P F级),6~8周龄,体重150~200 g,由佳木斯大学实验动物中心提供。
1.1.2主要试剂及仪器OV A(美国S i g ma公司),G iemsa染色试剂(北京索莱宝科技有限公司),莫能菌素、P E标记的抗大鼠I L-17A、异硫氰酸荧光素(f l u orescein isothiocyanate,F I T C)标记的抗大鼠C D4+抗体(美国e B iloscience公司),R PMI 1640培养基(美国G ibo公司),大鼠变应原特异性I g E、I g G1、I g G2a、I L-17、I L-4、I L-6、I L-10、I F N-γE L I S A试剂盒(美国R D公司),B A C S C alib u r流式细胞仪(美国B D公司),全自动酶标仪(型号:R T-6000,美国R ayto公司)。
1.2方法
1.2.1实验动物分组B ro w n Nor w ay大鼠40只,随机分为空白组10只,对照组10只,实验组20只。实验组于实验第1天给予OV A 100μg和佐剂A l 35m g磷酸盐缓冲液(phosphate b uff er saline,P B S)200μl左足底部注射。第7天给同样OV A P B S液200μl腹腔注射。第14天和第16天OV A P B S液(750μg/5μl/眼)点眼激发。对照组给予等量的P B S液,给药时间和途径同实验组。空白组为正常大鼠不加任何处理。
1.2.2眼部病理学检查末次激发24 h断髓法处死大鼠,摘取眼球及上下眼睑,10%福尔马林溶液固定,石蜡包埋,矢状位4μm厚连续切片,G iemsa染色观察大鼠眼结膜病理变化。计数穹隆部结膜每高倍镜下嗜酸性粒细胞浸润数量。
1.2.3血清特异性Ig E、Ig G1、Ig G2a抗体测定采用双抗体夹心酶联免疫吸附试验(en z ymelin k ed imm u nosorbent assay,E L I S A)法,在大鼠I g E、I g G1、I g G2a单抗包被的酶标板上分别加入标准品和样品,37℃,90min,洗板4次。加入生物素化抗大鼠I g E、I g G1、I g G2a抗体,37℃,60min,洗板4次。加入辣根过氧化物酶标记的抗生物素蛋白链菌素37℃,30min。加入底物显色。450 nm处测光密度值,根据标准曲线计算待测样品I g E、I g G1、I g G2a浓度。
1.2.4外周血、脾脏T h17细胞的流式细胞术检测肝素化抗凝大鼠外周血或脾细胞悬液,裂解红细胞,分离淋巴细胞,调整细胞浓度1×107个/ml,取100μl加入佛波醇酯、离子霉素、莫能霉素,37℃,5%二氧化碳C O2培养5h,收集细胞用P E标记的抗大鼠I L-17A、F I T C标记的抗大鼠C D4+抗体进行细胞表面及细胞内抗原染色。流式细胞仪进行检测。
1.2.5脾细胞上清液细胞因子测定无菌条件下取出大鼠脾脏,经100目钢网研磨过滤成单个细胞,用R PMI 1640培养基(含100μg/L小牛血清、100μg/L青霉素及100μg/L链霉素)重悬脾细胞。用8.3 g/L N H4C l红细胞裂解液裂解红细胞,离心,收集细胞沉淀,R PMI 1640培养基重悬脾细胞,制成均质的脾细胞悬液,调整细胞浓度至2×106个/ml。台昐蓝染色观察活细胞≥98%时可用于实验。取脾细胞悬液100μl加到无菌96孔板中,加入OV A至质量终浓度100μg/L,并设立阴性对照组,37℃,5%C O2培养72 h。收集上清液E L I S A法测定I L-17、I L-4、I L-6、I L-10、I F N-γ含量。实验操作程序与测定I g E、I g G1、I g G2a相同。
1.3统计学方法
采用S P SS 19.0统计软件进行数据分析,计量资料用均数±标准差(x±s)表示,多组间差异性测定用方差分析,多组间两两比较用S N K-q检验,P<0.05为差异有统计学意义。
2 结果
2.1眼病理切片结果
空白组大鼠眼结膜无充血,固有层无或偶见粒细胞浸润,每高倍镜下嗜酸性粒细胞浸润数(15.92± 5.97)个。对照组大鼠眼结膜无明显充血水肿,固有层没有或偶见粒细胞浸润,每高倍镜下嗜酸性粒细胞浸润数(17.36±6.02)个。实验组大鼠结膜组织疏松,充血水肿明显,固有层内嗜酸性粒细胞及中性粒细胞浸润,肥大细胞增加,并有脱颗粒现象。实验组每高倍镜下嗜酸性粒细胞数(78.27±15.96)个。3组大鼠眼结膜嗜酸性粒细胞浸润数比较,经单因素方差分析差异有统计学意义(F=128.193,P=0.000)。大鼠结膜嗜酸性粒细胞浸润数经S N K-q两两比较,对照组与空白组比较差异无统计学意义(P=0.596),实验组较对照组增多(P=0.000)。病理改变证明实验组大鼠发生过敏性结膜炎。见图1。
2.2大鼠血清I g E、I g G1、I g G2a水平的变化
大鼠血清I g E、I g G1、I g G2a水平比较,经单因素方差分析差异有统计学意义(P=0.000)。大鼠血清I g E、I g G1水平经S N K-q两两比较,对照组与空白组比较差异无统计学意义(P<0.05),实验组较对照组升高(P=0.000),血清I g G2a水平经S N K-q两两比较,对照组与空白组比较差异无统计学意义(P=0.405),实验组较对照组降低(P=0.000)。见表1和图2。
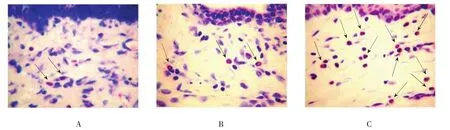
图1 空白组、对照组与实验组病理切片结果

表1 大鼠血清I g E、I g G1、I g G2a水平比较 (μg/m l,x±s)
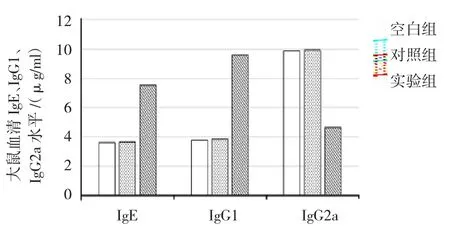
图2 大鼠血清I g E、I g G1、I g G2a水平比较
2.3大鼠外周血、脾脏组织T h17细胞检测结果
外周血Th17细胞流式细胞仪检测结果显示,大鼠外周血Th17细胞含量空白组为(0.70±0.05)%,对照组为(0.71±0.09)%,实验组为(3.98±0.13)%。3组大鼠外周血Th17细胞含量,经单因素方差分析,差异有统计学意义(F=456,P=0.000)。大鼠外周血Th17细胞含量经S N K-q两两比较,对照组与空白组差异无统计学意义(P=0.760),实验组较对照组升高(P=0.001)(见图3A)。脾脏组织Th17细胞检测中选择代表性的流式细胞仪分析。结果显示大鼠脾细胞悬液Th17细胞空白组含量为(0.81±0.07)%,对照组为(0.82±0.11)%,实验组为(4.86±0.17)%,3组大鼠脾细胞悬液Th17细胞含量,经单因素方差分析差异有统计学意义(F=439,P=0.000)。经S N K-q两两比较对照组与空白组无统计学意义(P=0.813),实验组较对照组升高(P=0.001)(见图3B)。
2.4大鼠脾细胞培养上清液I L-17、I L-4、I L-6、I L-10、IF N-γ水平
3组大鼠脾细胞培养上清液I L-17、I L-4、I L-6、I L-10、I F N-γ水平经单因素方差分析,差异有统计学意义(P=0.000)。大鼠脾细胞培养上清液I L-17、I L-4、I L-6、I L-10水平经S N K-q两两比较,对照组与空白组比较差异无统计学意义(P>0.05)。实验组较对照组升高(P=0.000),大鼠脾细胞培养上清液I F N-γ水平经S N K-q检验,对照组与空白组比较差异无统计学意义(P=0.317)。实验组较对照组降低(P=0.000)。见表2和图4。
2.5大鼠脾细胞培养上清液I L-17/IF N-γ、I L-4/ IF N-γ、I L-6/IF N-γ、I L-10/IF N-γ比值
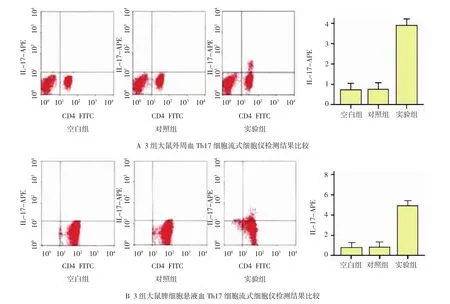
图3 3组大鼠外周血、脾细胞悬液T h17细胞流式细胞仪检测结果比较
表2 大鼠脾细胞培养上清液I L-17、I L-4、I L-6、I L-10、IF N-γ水平比较 (p g/ml,)
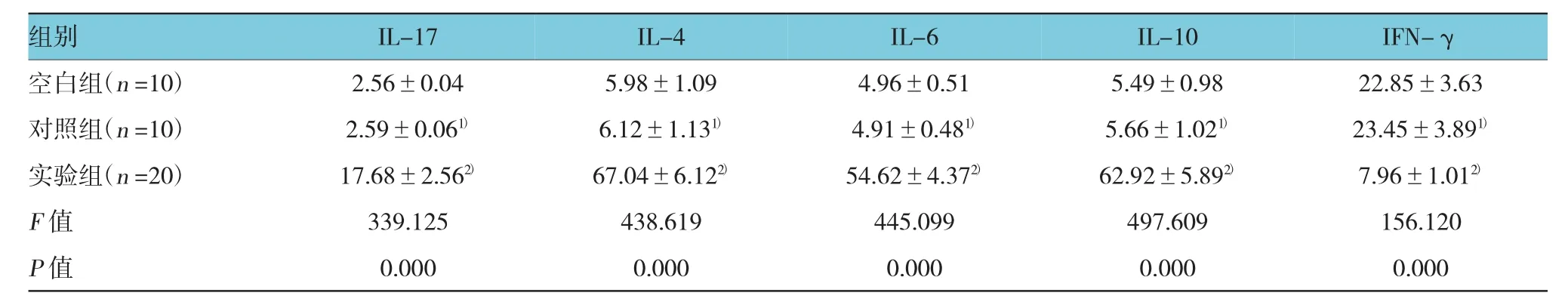
表2 大鼠脾细胞培养上清液I L-17、I L-4、I L-6、I L-10、IF N-γ水平比较 (p g/ml,)
注:1)与空白组比较,P>0.05;2)与对照组比较,P<0.01
组别I F N -γ空白组(n = 1 0) 2 . 5 6 ± 0 . 0 4 5 . 9 8 ± 1 . 0 9 4 . 9 6 ± 0 . 5 1 5 . 4 9 ± 0 . 9 8 2 2 . 8 5 ± 3 . 6 3对照组(n = 1 0) 2 . 5 9 ± 0 . 0 61) 6 . 1 2 ± 1 . 1 31) 4 . 9 1 ± 0 . 4 81) 5 . 6 6 ± 1 . 0 21) 2 3 . 4 5 ± 3 . 8 91)实验组(n = 2 0) 1 7 . 6 8 ± 2 . 5 62) 6 7 . 0 4 ± 6 . 1 22) 5 4 . 6 2 ± 4 . 3 72) 6 2 . 9 2 ± 5 . 8 92) 7 . 9 6 ± 1 . 0 12)F值 3 3 9 . 1 2 5 4 3 8 . 6 1 9 4 4 5 . 0 9 9 4 9 7 . 6 0 9 1 5 6 . 1 2 0 P值 0 . 0 0 0 0 . 0 0 0 0 . 0 0 0 0 . 0 0 0 0 . 0 0 0 I L -1 7 I L -4 I L -6 I L -1 0
3组大鼠脾细胞培养上清液I L-17/I F N-γ、I L-4/I F N-γ、I L-6/I F N-γ、I L-10/I F N-γ 比值经单因素方差分析,差异有统计学意义(P=0.000)。大鼠脾细胞培养上清液I L-17/I F N-γ、I L-4/I F N-γ、I L-6/ I F N-γ、I L-10/I F N-γ比值经S N K-q两两比较,对照组与空白组差异无统计学意义(P>0.05)。实验组较对照组升高(P=0.000)。见表3。
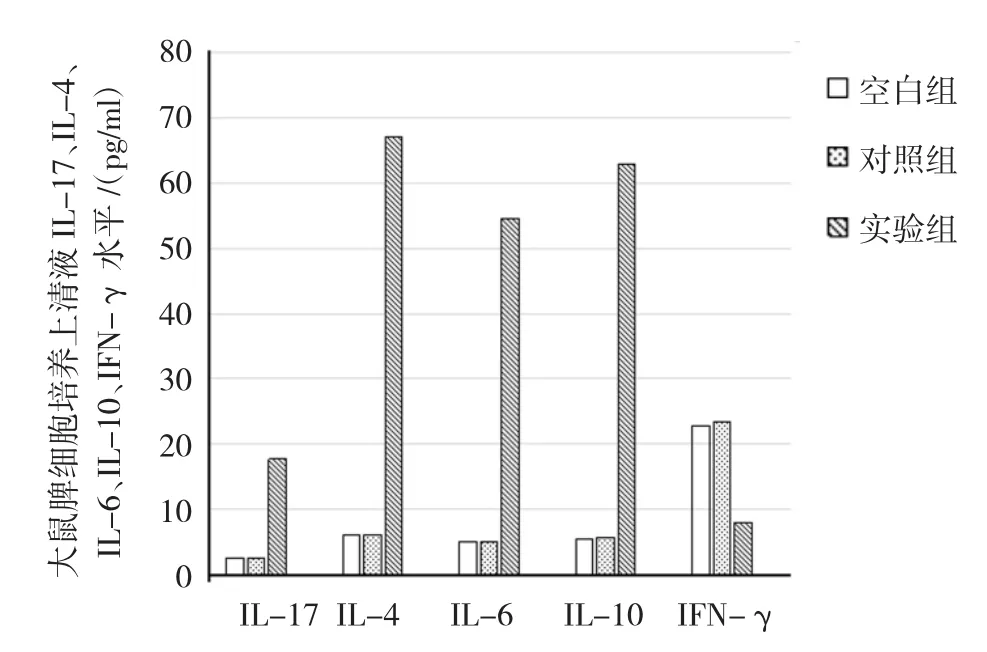
图4 大鼠脾细胞培养上清液I L-17、I L-4、I L-6、I L-10、IF N-γ水平比较
表3 脾细胞I L-17/IF N-γ、I L-4/IF N-γ、I L-6/IF N-γ、I L-10/IF N-γ比较 ()
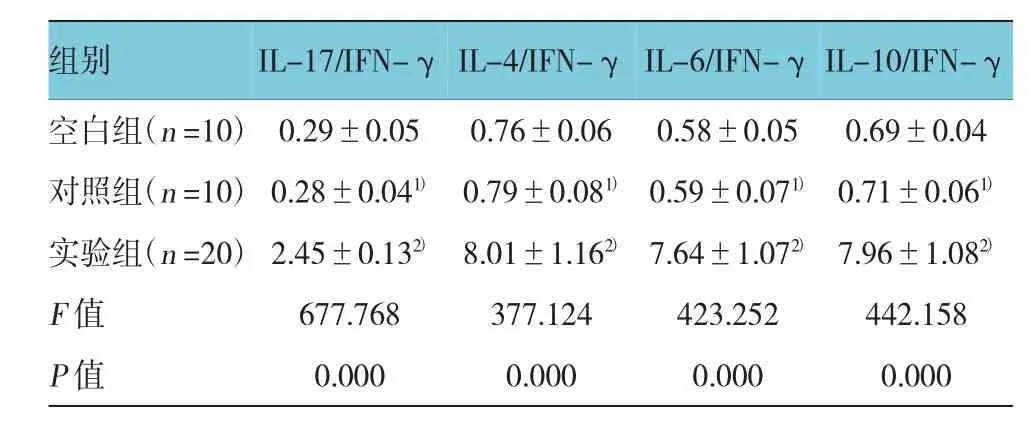
表3 脾细胞I L-17/IF N-γ、I L-4/IF N-γ、I L-6/IF N-γ、I L-10/IF N-γ比较 ()
注:1)与空白组比较,P>0.05;2)与对照组比较,P<0.01
组别I L -1 0 / I F N -γ空白组(n = 1 0 ) 0 . 2 9 ± 0 . 0 5 0 . 7 6 ± 0 . 0 6 0 . 5 8 ± 0 . 0 5 0 . 6 9 ± 0 . 0 4对照组(n = 1 0 ) 0 . 2 8 ± 0 . 0 41) 0 . 7 9 ± 0 . 0 81) 0 . 5 9 ± 0 . 0 71) 0 . 7 1 ± 0 . 0 61)实验组(n = 2 0 ) 2 . 4 5 ± 0 . 1 32) 8 . 0 1 ± 1 . 1 62) 7 . 6 4 ± 1 . 0 72) 7 . 9 6 ± 1 . 0 82)F值 6 7 7 . 7 6 8 3 7 7 . 1 2 4 4 2 3 . 2 5 2 4 4 2 . 1 5 8 P值 0 . 0 0 0 0 . 0 0 0 0 . 0 0 0 0 . 0 0 0 I L -1 7 / I F N -γ I L -4 / I F N -γ I L -6 / I F N -γ
3 讨论
过敏性结膜炎是眼部结膜组织对过敏原发生了广泛的抗原特异性辅助T细胞反应引起的过敏性疾病。辅助性T细胞按其分化和功能分为Th1、Th2、Th17和调节性T细胞[3]。
Th1细胞产生I L-2、I F N-γ、TN F-α,Th2细胞产生I L-4、I L-5、I L-6、I L-10等细胞因子,近年研究证实Th17产生I L-17。Th1、Th2细胞分别产生特征性细胞因子,检测I F N-γ可以了解Th1的功能状态,检测I L-4、I L-6、I L-10可以了解Th2的功能状态[4]。研究发现,Th1、Th2细胞产生的细胞因子还与特异性抗体I g E、I g G亚类的表达密切相关,Th1细胞因子刺激I g G2a抗体的产生,而Th2细胞因子刺激I g E、I g G1的产生。比较血清I g G2a和I g G1水平的改变也可以了解Th1/Th2之间功能状态的调节变化[5]。本研究结果显示,过敏性结膜炎大鼠脾细胞培养上清液I L-4、I L-6、I L-10水平较对照组大鼠升高,I F N-γ水平降低。脾细胞培养上清液I L-4/I F N-γ、I L-6/ I F N-γ、I L-10/I F N-γ比值过敏性结膜炎大鼠较对照组大鼠升高。过敏性结膜炎大鼠血清I g E、I g G1水平较对照组大鼠升高,血清I g G2水平较对照组降低。提示过敏性结膜炎大鼠Th2细胞功能活动增强,Th1细胞活性降低。Th2/Th1比例升高,免疫状态由Th1向Th2“克隆漂移”,表现为Th2型优势表达。表明Th1/Th2失衡与过敏性结膜炎的发病密切相关[6],Th2细胞过多产生的细胞因子I L-4、I L-6、I L-10参与过敏性结膜炎发病的病理生理过程[7]。但是Th1/ Th2失衡并不能完全解释过敏性结膜炎发病的全部机制。近年研究发现,在辅助性T细胞中还存在着一类新成员,由于这类效应C D4+T细胞分泌的细胞因子以I L-17为主,因此被命名为Th17[8]。Th17参与完成许多免疫反应,Th17发挥作用的关键是其分泌的细胞因子I L-17[9]。
近年研究发现,在花粉季节过敏性鼻炎患者外周血Th17细胞数量增多,血清I L-17水平升高,患者血清I L-17水平与过敏性鼻炎患者临床症状严重程度呈正相关[10]。支气管哮喘患者肺泡支气管灌洗液中I L-17表达升高[11]。变应性鼻炎、支气管哮喘均为细胞介导的变态反应。有研究证明,在OV A诱导的小鼠支气管哮喘模型致敏阶段,中和I L-17抗体可增强过敏反应,使小鼠支气管灌洗液中I L-5和嗜酸性粒细胞数增加。I L-17在抗原特异性细胞的活化、嗜酸性粒细胞聚集和血清I g E的生成过程中均发挥作用[12]。I L-17参与Th1/Th2失调过敏性疾病的发病过程[13]。I L-17能诱导人支气管上皮细胞、纤维细胞、气道平滑肌细胞和静脉内皮细胞释放促炎因子TN F-α、I L-1β、C-C S F、I L-6以及趋化因子C X C L1/G roα、C X C L2和C X C L8/I L-8,增加中性粒细胞的生成。I L-17通过刺激固有免疫机制调节中性粒细胞聚集,I L-17的基本生物学功能就是促进趋化因子、促细胞炎症因子和金属蛋白酶的表达,刺激炎症反应及中性粒细胞趋化[14]。本研究结果显示,过敏性结膜炎大鼠外周血、脾脏Th17细胞增加,脾细胞培养产生I L-17增多。提示Th17细胞分泌I L-17增多参与了过敏性结膜炎发病的病理生理过程。
对人类的研究发现,Th17/Th1细胞能同时分泌I L-17和I F N-γ[15]。I L-12不仅刺激Th17/Th1产生I L-23R和R O Rγδ而促进I L-17分泌,还上调Th1细胞转录因子Tbet表达,促进I F N-γ分泌[16]。在病理状态下,Th1、I F N-γ可能影响Th17、I L-17,动物实验发现,缺乏I F N-γ时Th17产生I L-17增多,可诱发实验性自身免疫性葡萄膜炎的发生。I F N-γ缺失型小鼠实验性自身免疫性葡萄膜炎模型外周血I L-17明显增多[17]。本研究结果显示,过敏性结膜炎大鼠脾细胞培养上清液I F N-γ减少,外周血、脾脏Th17细胞数量增多,脾细胞培养上清液I L-17含量增多。提示Th17/Th1失衡是大鼠过敏性结膜炎发病的重要原因。
本研究证明,Th1/Th2/Th17失衡,Th2、Th17细胞因子产生增多,Th1细胞功能降低、细胞因子分泌减少是大鼠过敏性结膜炎发病的重要原因。因此,在临床上抑制Th2、Th17细胞因子产生,促进Th1细胞因子分泌,增强Th1反应,抑制Th2、Th17过度反应,恢复Th1/Th2/Th17平衡,可能成为治疗过敏性结膜炎的一条新途径。
[1]杭丽.鱼腥草滴眼液联合吡嘧司特钾滴眼液治疗过敏性结膜炎的疗效观察[J].国际眼科杂志,2013,13(12):2468-2470.
[2]C O M E S P J.Trends in pre v alence and treatment o f oc u lar aller g y[J]. C u rr O pin A ller g y C lin I mm u nol,2014,14(5):451-456.
[3]L EE S H.M echamism o f the aller g ic asthma patho g enesis by protease aller g en[J].H anyan g M ed R e v,2013,33(1):39-44.
[4]范惠珍,尹卫华,夏红梅.接种乙肝疫苗对成人外周血Th1/Th2的影响研究[J].中国现代医学杂志,2012,22(34):81-83.
[5]K IM H,K IM Y J,L EE S H,et al.E ff ects o f lactobacill u s rhamnos u s on aller g ic march model by s u ppresin g Th2,Th1,and T SL P responses v ia C D4+C D25+F o x p3+Tre g[J].C lin I mm u nol,2014,153(1):178-186.
[6]G A L ICI A-C A RR E O N J,S A NT A C T U Z C,HO N G E,et al.The oc u lar s u r f ace:f rom physiolo g y to the oc u lar aller g ic disease[J]. R e v A ler g M e x,2013,60(4):172-183.
[7]陈大复,于坤瑛.过敏性结膜炎的免疫学研究进展[J].中国医药导报,2014,11(33):162-165.
[8]单世民,毛毅敏,孙瑜霞.Th17细胞在支气管哮喘小鼠发病机制中的作用研究[J].中国现代医学杂志,2015,25(25):21-24.
[9]薛海波,马蕾,李元宾,等.Tre g/Th17细胞轴与桥本甲状腺炎自身免疫的相关性[J].中国现代医学杂志,2012,22(23):67-71.
[10]李媛媛,张贝林,严共刚.过敏性鼻炎患者血清I L-17和I L-22水平的变化及其与病情严重程度的关系[J].黑龙江医学,2015,39(8): 921-925.
[11]隋学斌,刘斌,楊艳华,等.支气管哮喘患者肺泡灌洗液中I L-17水平分析[J].齐齐哈尔医学院学报,2013,34(20):2990-2992.
[12]魏然,臧金萍,王金亮,等.支气管哮喘小鼠气道中I L-17表达与气道重塑关系的相关研究[J].中国医药指南,2013,11(14):87-89.
[13]张仲林,钟玲,袁明勇,等.Th1/Th2/Th17/Tre g细胞因子在变应性鼻炎发病中的免疫机制研究[J].医学综述,2014,20(16):2906-2909.
[14]王敬敬,王小明.I L-17家族及其在支气管哮喘发病中的作用[J].医学综述,2014,20(19):3539-3541.
[15]白党强,周瑞.结核性胸腔积液中Th1/Th17平衡关系研究及临床意义[J].海南医学院学报,2014,20(8):1057-1060.
[16]王庆文.腹腔镜胃癌根治术患者围术期Th1、Th2及Th17的变化研究[J].海南医学院学报,2014,20(9):1223-1227.
[17]钱丽丽,徐亚茹,胡芳,等.Th1、Th17细胞相关因子在实验性自身免疫性葡萄膜炎大鼠中的表达及作用[J].眼科新进展,2015,35(10):918-920.
(申海菊 编辑)
Effect of Th1/Th2/Th17 balance on development of experimental allergic conjunctivitis*
Jian Zhang1,Dong-lan Wang1,Dong-mei Yan2
(1.Department of Ophthalmology,the First Affiliated Hospital of Jiamusi University,Jiamusi,Heilongjiang 154003,China;2.College of Basic Medical Sciences,Jiamusi University,Jiamusi,Heilongjiang 154003,China)
Objective To investigate the effect of Th1/Th2/Th17 balance on development of experimental allergic conjunctivitis.Methods Forty Brown Norway rats were randomly divided into three groups:normal group,control group and experimental allergic conjunctivitis group(experimental group).Ovalbumin(OVA)-induced allergic conjunctivitis models were established.The eyes including eyelids and conjunctivae were harvested for histological analysis,and infiltrating eosinophils in fornical conjunctivae were counted.The serum levels of IgE,IgG1 and IgG2a and the concentrations of IL-17,IL-4,IL-6,IL-10 and IFN-γin spleen culture supernatant were measured by ELISA.The Th17 cells in peripheral blood and spleen tissue were detected using flow cytometry.Results The experimental group had significantly higher number of conjunctival eosinophils than the normal and control groups(P<0.01).The experimental group had significantly higher serum IgE and IgG1 levels and significantly lower serum IgG2a level than the normal and control groups(P<0.01).The concentrations of IL-17,IL-4,IL-6 and IL-10 in spleen culture supernatant were significantlyhigher but the IFN-γlevel was significantly lower in the experimental group than in the normal and control groups(P<0.01).The Th17 cells in the peripheral blood and spleen tissue of the experimental group were significantly more than those of the normal and control groups(P<0.01).Conclusions Th1/Th2/Th17 imbalance might play an important role in the development of experimental allergic conjunctivitis.To modulate the unbalanced Th1/Th2/Th17 reaction may contribute to treatment of allergic conjunctivitis.
allergic conjunctivitis;Th1;Th2;Th17;cytokine
R 777.3
A
10.3969/j.issn.1005-8982.2016.15.006
1005-8982(2016)15-0032-06
2015-08-14
黑龙江省卫生厅科研项目(No:2013248);佳木斯大学青年基金(No:S q2014-006)
闫冬梅,E-mail:chaiyin g1975@soh u.com;Tel:0454-8623586

