小鼠孕早期暴露量子点对妊娠结局和CD4+CD25+Tre g细胞的影响*
郑凤霞,许恒毅,傅芬
(1.南昌大学第二附属医院 妇产科,江西 南昌 330006;2.南昌大学 食品科学与技术国家重点实验室,江西 南昌 330047)
论著
小鼠孕早期暴露量子点对妊娠结局和CD4+CD25+Tre g细胞的影响*
郑凤霞1,许恒毅2,傅芬1
(1.南昌大学第二附属医院 妇产科,江西 南昌 330006;2.南昌大学 食品科学与技术国家重点实验室,江西 南昌 330047)
目的探讨小鼠孕早期暴露硫化锌量子点(Q Ds)对妊娠结局和外周血C D4+C D25+T r e g细胞的影响。方法制备成年健康孕鼠并将其随机分为高剂量Q Ds组、低剂量Q Ds组和对照组,分别于妊娠第3~5天尾静脉注射0.50和0.05μm ol/L Q Ds,以及生理盐水各100μl,于妊娠第15天观察妊娠结局,并采用流式细胞术分析孕鼠外周血C D4+C D25+T r e g细胞比例。结果Q Ds可引起流产、吸收胎和死胎等不良妊娠结局,高剂量Q Ds使胚胎平均着床数、胎鼠均重及胎盘均重低于对照组,差异有统计学意义(P<0.05);且Q Ds暴露孕鼠外周血C D4+C D25+T r e g细胞的比例低于对照组,差异有统计学意义(P<0.05)。结论小鼠孕早期暴露Q Ds具有胚胎毒性,且其毒性机制可能与降低外周血中C D4+C D25+T r e g细胞比例、扰乱妊娠免疫耐受有关。
量子点;生殖毒理;C D4+C D25+T r e g细胞;妊娠免疫耐受
近年随着纳米材料的规模化生产和纳米产品的普及,人类主动或被动接触纳米材料的机会越来越多,但纳米材料兼有材料本身引起的毒性和纳米尺寸效应、表面效应等而致的特殊毒性,纳米毒理学成为纳米技术可持续发展的关键环节,也是现代毒理学的前沿领域。生殖毒理学是一个关乎人类繁衍健康和社会发展的多领域交叉学科,研究纳米材料的生殖毒理具有重要意义。量子点(q u ant u m dots,Q Ds)作为新型无机荧光纳米粒子具有荧光寿命长、耐光漂白、发射光谱窄而对称、激发光谱宽而连续等优点,在生物医学领域如生物分子检测、生物荧光标记、活体成像、荧光定位和动态示踪等表现出巨大的应用潜力[1-2]。相对于量子点细胞毒性和一般活体毒性的研究而言,关于量子点生殖毒性及用于筛选和评价生殖损伤观察指标的研究报道较少[3-4]。妊娠是一个复杂而又协调的过程,母胎界面正常免疫耐受的建立和维持是妊娠成功的关键。C D4+C D25+Tre g细胞起源于胸腺,可以抑制同种异体移植物的排斥反应,在妊娠免疫耐受中的作用备受关注。大量研究表明,其不但参与母胎免疫耐受机制的形成,而且对其维持发挥积极作用,C D4+C D25+Tre g细胞平衡的失调可影响妊娠的结局[5-6]。本文以量子点为研究材料,以成年健康孕鼠为评价模型,研究评估小鼠孕早期暴露量子点引发的生殖毒性,并从C D4+C D25+Tre g细胞比例变化的角度探究其毒性机制,为认识量子点的生殖安全提供重要的实验参考。
1 材料与方法
1.1实验动物
选择健康出生7周龄的S P F级昆明雌性小鼠24只,雄性12只,体重28~30 g,由南昌大学动物科学部提供,动物合格证号为S Y X K(赣)2015-0002。本实验经实验动物研究伦理委员会批准,批准号为0064257。实验动物在南昌大学动物房内饲养,室温保持22~24℃,相对湿度为55%~60%,昼夜交替各12 h,自由摄食、饮水,定期更换垫料。
1.2主要试剂与仪器
硫化锌量子点原液(浓度为10μmol/L,水化粒径为8~10 nm,吸收光谱为400~600 nm,发射光谱为540~560 nm)购自美国O cean NanoTech公司,A nti-M o u se C D4-异硫氰酸荧光素(f l u orescein isothiocyanate,F I T C)单抗、A nti-M o u se C D25-藻红蛋白(P hycoerythrin,P E)单抗、A nti-M o u se I g G2a抗体购自美国B D公司。流式细胞仪购自美国B D公司,超净生物工作台购自苏州净化设备有限公司,电子天平购自上海梅特勒-托利多有限公司,恒温水浴箱购自江苏金坛市中大公司,离心机购自安徽中科中佳科学仪器公司。
1.3实验动物分组及染毒
将所购小鼠适应性饲养1周后,于下午5∶00将雌性、雄性小鼠以2∶1比例合笼,次日清晨8∶00检查阴栓,以查见阴栓日为妊娠第1天,其余妊娠天数依次类推。参照文献[7-8]的量子点染毒剂量,将所得24只妊娠早期雌鼠完全随机化分为3组,分别为对照组(生理盐水)、低剂量(0.05μmol/L)和高剂量(0.50μmol/L)Q Ds组,每组8只,于妊娠第3、4和5天采用尾静脉注射方式染毒,染毒容量为100μl/只,1次/d,连续染毒3 d。实验期间,每天上午9∶00称量记录孕鼠体重,并观察记录其呼吸、神态、活动和阴道出血等情况。
1.4孕鼠的解剖和胚胎毒性的观察
将所有孕鼠于妊娠第15天摘除眼球,收集新鲜抗凝血后颈椎脱臼处死,迅速沿腹中线剖开腹腔暴露子宫。首先观察记录死胎、活胎和吸收胎,然后剪除子宫,去掉血污后依次分离胎盘、胎鼠,称量胎鼠、胎盘的重量。
1.5流式细胞术检测孕鼠外周血CD4+CD25+Tre g细胞的比例
取新鲜抗凝血100μl,加入A nti-M o u se C D4-F I T C单抗10μl、A nti-M o u se C D25-P E单抗10μl(同时设置A nti-M o u se I g G2a同型阴性对照反应管、A nti-M o u se C D4-F I T C单阳管和 A nti-M o u se C D25-P E单阳管)轻微混匀,室温避光孵育25min,加入红细胞裂解液2ml,避光裂解10min,1 200 r/min离心5min,弃上清液,加入1 ml磷酸盐缓冲溶液(phosphate b uff er saline,P B S)洗涤细胞,1 200 r/min离心5min后弃上清液。再加入500μl P B S重悬细胞,30min内在流式细胞仪上机检测,根据前向角散射(f or w ard scatter,F S C)和侧向角散射(side scatter,SS C)光信号圈定淋巴细胞群,根据同型阴性对照样品(小鼠I g G2a同型对照反应管)来调整仪器电压,用C D4单阳和C D25单阳样品来调整F I T C和P E之间的荧光补偿,以淋巴细胞群设门来计算C D4+淋巴细胞的比例,以C D4+设门来计算C D4+C D25+Tre g细胞占C D4+T细胞比例。
1.6统计学方法
采用S P SS 19.0统计软件分析处理实验数据,计量资料以均数±标准差(x±s)表示,两组间数据比较用t检验,多组间数据比较用单因素方差分析(O ne-w ay,A N OV A)及LS D检验,P<0.05为差异有统计学意义。
2 结果
2.1一般观察结果
观察期间各组孕鼠均未出现死亡现象,高剂量Q Ds组孕鼠进食、进水量较对照组和低剂量Q Ds组明显减少,其毛色晦暗,嗜睡,活动减少,精神萎靡,其中有3只孕鼠出现阴道流血、体重骤降等症状;低剂量Q Ds组孕鼠注射药物后出现易激惹、躁动不安等症状;对照组所有孕鼠未发现异常。观察期间高剂量Q Ds组、低剂量Q Ds组孕鼠体重净增长率[孕期体重净增长率=(妊娠当日体重-妊娠第1天体重)/妊娠第1天体重×100%]较对照组减少。见附图。
2.2量子点对妊娠结局的影响
本研究观察期间高剂量Q Ds组有3只孕鼠发生流产,解剖其余5只孕鼠见3只死亡胚胎及4个吸收胎等不良妊娠结局,各组胚胎平均着床数比较,经方差分析,差异有统计学意义(F=8.927,P=0.002)。各组胎鼠均重比较,经方差分析,差异有统计学意义(F=87.824,P=0.000)。各组胎盘均重比较,经方差分析,差异有统计学意义(F=21.640,P=0.000)。量子点暴露孕鼠平均着床数、胎鼠均重和胎盘均重低于对照组,差异有统计学意义(P<0.05)。见表1。
2.3Q Ds对CD4+CD25+Tre g细胞的影响
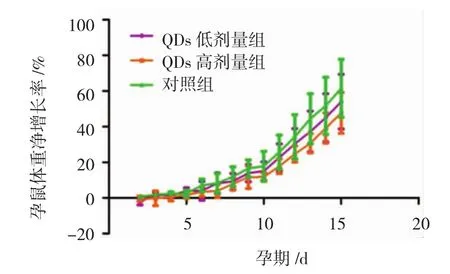
附图 量子点对孕鼠净体重变化的影响
高剂量Q Ds组、低剂量Q Ds组孕鼠外周血中C D4+T细胞的比例比较,经方差分析,差异有统计学意义(F=73.199,P=0.000)。C D4+C D25+Tre g细胞占C D4+T细胞比例比较,经方差分析,差异有统计学意义(F=210.998,P=0.000)。Q Ds暴露孕鼠外周血中C D4+T细胞的比例及C D4+C D25+Tre g细胞占C D4+T细胞比例低于对照组,差异有统计学意义(P<0.05)。见表2。
表1 孕鼠妊娠早期暴露量子点对妊娠结局的影响(n=8,)

表1 孕鼠妊娠早期暴露量子点对妊娠结局的影响(n=8,)
注:t1、P1值:低剂量Q Ds组与对照组比较;t2、P2值:高剂量Q Ds组与对照组比较
组别胎盘均重/ g对照组 1 5 . 1 3 ± 2 . 6 4 0 . 3 3 ± 0 . 2 5 0 . 1 4 ± 0 . 0 1低剂量Q D s组 1 2 . 6 7 ± 1 . 8 6 0 . 2 9 ± 0 . 0 1 0 . 1 2 ± 0 . 1 0高剂量Q D s组 9 . 0 0 ± 3 . 2 4 0 . 2 3 ± 0 . 1 3 0 . 1 0 ± 0 . 0 1 t1值 3 . 5 2 7 -1 8 . 2 0 5 -4 . 1 2 3 P1值 0 . 0 1 0 0 . 0 0 0 0 . 0 0 4 t2值 -4 . 2 3 0 1 2 . 8 0 2 -1 2 . 6 9 4 P2值 0 . 0 1 3 0 . 0 0 0 0 . 0 0 0平均着床数/个胎鼠均重/ g
表2 孕鼠妊娠早期Q Ds对外周血CD4+CD25+Tre g细胞的影响 (n=8,%)

表2 孕鼠妊娠早期Q Ds对外周血CD4+CD25+Tre g细胞的影响 (n=8,%)
注:t1、P1值:低剂量Q Ds组与对照组比较;t2、P2值:高剂量Q Ds组与对照组比较
组别C D 4+C D 2 5+/ C D 4+对照组 3 1 . 9 0 ± 2 . 7 5 3 7 . 1 3 ± 2 . 6 0低剂量Q D s组 2 6 . 8 8 ± 1 . 9 1 2 3 . 7 0 ± 1 . 0 7高剂量Q D s组 1 8 . 5 7 ± 0 . 6 1 1 9 . 9 0 ± 0 . 8 7 t1值 -8 . 2 3 0 -2 9 . 3 2 7 P1值 0 . 0 1 7 0 . 0 2 5 t2值 -5 6 . 0 8 7 -5 1 . 0 9 5 P2值 0 . 0 0 0 0 . 0 1 1 C D 4+
3 讨论
纳米材料的生殖毒性研究主要包括对生殖能力、宫内胚胎发育和子代的影响等方面。2008年C H A N等[9]发现,Q Ds具有小鼠囊胚发育毒性,可诱导囊胚凋亡,经Q Ds染毒后的囊胚种植到子宫内膜后,其发育较对照组缓慢。H S I E H等[10]通过体外实验研究发现Q Ds有较明显的胚胎发育毒性,经Q Ds干预后发育的胚胎着床后吸收胎率增加,胎盘及胎儿重量明显减轻。但目前关于妊娠早期Q Ds的生殖毒性及其机制的动物体内实验较少见,且妊娠早期是哺乳动物最为敏感的时期,妊娠母体在该阶段接触药物或化学材料更易对子代造成不同程度的影响,研究纳米材料的胚胎毒性对环境保护和健康有重要意义。本实验在小鼠妊娠的第3~5天经尾静脉注射Q Ds,结果发现Q Ds暴露孕鼠的平均胎仔数、胎鼠均重和胎盘均重等较对照组减少,且高剂量Q Ds组孕鼠出现流产、死胎及吸收胎等不良妊娠结局,表明小鼠孕早期以静脉注射方式暴露一定量的Q Ds可导致胚泡着床障碍和胚胎宫内发育迟缓等毒性。
纳米材料本身及其释放的重金属离子毒性可与其干扰性激素水平、调节机体免疫和相关氧化应激水平等因素相关[11-12]。从生殖免疫学观点来看,胚胎拥有一半父源性遗传物质,一次成功的妊娠形同一次成功的同种异体移植,胚胎所携带的父源性抗原刺激母体免疫活性细胞进行免疫应答,但同时母体内具有免疫抑制功能的细胞也增加,使免疫应答和免疫抑制相平衡,才能使胎儿正常发育直至分娩,母胎界面正常免疫耐受的建立和维持是妊娠成功的关键。C D4+C D25+Tre g细胞是一群具有免疫调节功能的细胞群,是机体调控不适当或者过强免疫应答的关键机制之一,其通过调控抑制性T细胞,抑制自身反应性T细胞,亦能促进一些抑制性细胞因子(如转化生长因子和白细胞介素-10)的分泌等,在防止自身免疫性疾病及母胎免疫耐受机制的形成和维持中发挥重要作用[5-6]。研究表明,正常妊娠时孕体外周血中C D4+C D25+Tre g细胞比例升高,而不明原因复发性流产者或其他病理妊娠机体外周血中C D4+C D25+Tre g细胞比例较正常妊娠者减少[13-14]。R OW E等[15]报道在易发流产的机体外周血中C D4+C D25+Tre g细胞数量较正常妊娠组明显减少,C D4+C D25+Tre g细胞缺乏可导致母体产生针对胎儿的免疫排斥,使流产率增加。本实验中通过流式细胞术检测不同处理组孕鼠外周血C D4+C D25+Tre g细胞,结果发现,Q Ds暴露孕鼠外周血中C D4+C D25+Tre g细胞比例较对照组降低,且高剂量Q Ds组最低,差异有统计学意义(P<0.05)。推测孕鼠妊娠早期暴露于Q Ds引发的胚泡着床障碍、胚胎宫内发育迟缓等胚胎毒性,可能与其降低C D4+C D25+Tre g细胞比例破坏母胎免疫耐受平衡有关,但关于新型纳米材料量子点的生殖毒性的具体机制及其有关因素有待进一步研究。
[1]G UO Z,H A O T,D U S,et al.M u ltiple x electrochemil u minescence imm u noassay o f t w o t u mor mar k ers u sin g m u lticolor q u ant u m dots as labels and g raphene as cond u ctin g brid g e[J].B iosens B ioelectron,2013,44:101-107.
[2]K A R EE MA L-K A Z A ZA.Detectiono f the o v ariancancer biomar k er C A-125u sin g chemil u minescence resonance ener g y trans f er to g raphene q u ant u m dots[J].C hem C omm u n,2014,50(11): 1344-1346.
[3]K A T S U MI T I A,GI LL I L A ND D,A R O S TE G U I I,et al.C ytoto x icity andcell u lar mechanisms in v ol v ed inthe to x icity o f C d S q u ant u m dots in hemocytes and g ill cells o f the m u ssel mytil u s g allopro v incialis[J].A q u at To x icol,2014,153:39-52.
[4]WU T,T A N G M.To x icity o f q u ant u m dots on respiratory system[J]. I nhal To x icol,2014,26(2):128-139.
[5]S H A R M A S.Nat u ral k iller cells and re g u latory T cells in early pre g nancy loss[J].I nt J De v B iol,2014,58:219-229.
[6]D U M R,G UO P F,PI A O H L,et al.Embryonic trophoblasts ind u ce decid u al re g u latory T cell di ff erentiation and maternal-f etal tolerancethro u g hthymicstromal lymphopoietininstr u ctin g dendritic cells[J].J I mm u nol,2014,192(4):1502-1511.
[7]C HU M,WU Q,Y A N G H,et al.Trans f er o f q u ant u m dots f rom pre g nant mice to p u ps across the placental barrier[J].S mall,2010,6(5):670-678.
[8]S U Y,P EN G F,J I A N G Z,et al.I n v i v o distrib u tion,pharmaco k inetics,and to x icity o f a q u eo u s synthesi z ed cadmi u m-containin g q u ant u m dots[J].B iomaterials,2011,32(25):5855-5862.
[9]C H A N W H,S H I A O N H.C ytoto x ic e ff ect o f C d S e q u ant u m dots on mo u se embryonic de v elopment[J].A cta pharmacol S in,2008,29(2):259.
[10]H S I E H M S,S H I A O N H,C H A N W H.C ytoto x ic e ff ects o f C d S e q u ant u m dots on mat u ration o f mo u se oocytes,f ertili z ation,and f etal de v elopment[J].I nt J M ol S ci,2009,10(5):2122-2135.
[11]S A R H A N O M,HU SS E I N R M.E ff ects o f intraperitoneally inj ected sil v er nanoparticles on histolo g ical str u ct u res and blood parameters in the albino rat[J].I nt J Nanomedicine,2014,9: 1505-1517.
[12]C H A TTE R J EE N,E O M H J,C HO I J.E ff ects o f sil v er nanoparticles on o x idati v e DN A dama g e-repair as a fu nction o f p38 M A P Kstat u s:a comparati v e approach u sin g h u man j u r k at T cells and the nematode C aenorhabditis ele g ans[J].En v iron M ol M u ta g en,2014,55:122-133.
[13]阮静,沈洁,汪铮,等.调控量子点对小鼠胚胎干细胞活性影响的研究[J].东南大学学报(医学版),2011,30(1):24-28.
[14]夏欣一,杨滨,熊婷,等.反复自然流产患者外周血C D4+C D25+调节性T细胞的检测[J].中华男科学杂志,2008,14(12):1106-1108.
[15]R OW E JH,E R TE L T J M,X I N L,et al.R e g u latory T cells and the imm u ne patho g enesis o f prenatal in f ection[J].R eprod u ction,2013,146(6):191-203.
(童颖丹 编辑)
Effects of quantum dots on pregnancy outcomes and CD4+CD25+regulatory T cells in early pregnant m ice*
Feng-xia Zheng1,Heng-yi Xu2,Fen Fu1
(1.Department of Gynecology,the Second Affiliated Hospital of Nanchang University,Nanchang,Jiangxi 330006,China;2.National Key Laboratory of Food Science and Technology,Nanchang University,Nanchang,Jiangxi 330047,China)
Objective To investigate the effects of quantum dots(QDs)on pregnancy outcomes and CD4+CD25+regulatory T cells in early pregnant mice.M ethods The pregnant mice were randomly divided into three groups(QDs high-dose exposure group treated with 0.5μmol/L QDs,100μl/mice per day;low-dose exposure group treated with 0.05μmol/L QDs,100 ul/mice per day;and normal saline group treated with 0.9% NS,100μl/mice per day).Solutions of the different treatment materials were administered by tail vein injection on the 3rd-5th GD.The pregnant outcomes were observed and CD4+CD25+regulatory T cells in the peripheral blood were detected by flow cytometry on the 15th GD.Results In the QDs exposure groups,the pregnant mice showed abnormal pregnancy outcomes(abortion,stillbirth and fetal absorption).The avrage number of embryo implantation,offspring's body weight and placental weight in the high-dose exposure group were significantly lower than those of the control group(P<0.05).The proportion of CD4+CD25+regulatory T cells in CD4+T cells in the QDs groups was significantly lower than that of the control group(P<0.05). Conclusions The exposure of pregnant mice to QDs during early pregnancy is harm ful to embryos.One of the toxicity mechanisms may be related to the decrease of CD4+CD25+regulatory T cells in the peripheral blood.
quantum dot;reproductive toxicology;CD4+CD25+regulatory T cell;pregnancy immune tolerance
R 994
A
10.3969/j.issn.1005-8982.2016.15.005
1005-8982(2016)15-0028-04
2015-12-25
江西省青年科学基金(No:20143A C B21003)
傅芬,E-mail:fu_f en@163.com

