芥子气经腹腔和气管致大鼠急性肺损伤细胞凋亡的变化*
祝筱姬,朱双双,韩玮,贝媛媛,钟玉绪,刘菲,王涛,赵超,赵建
(1.解放军第89医院 呼吸科,山东 潍坊 261021;2.潍坊医学院 研究生处,山东 潍坊 261042;3.军事医学科学院 毒物药物研究所,北京 100850;4.解放军第89医院 病理科,山东 潍坊 261021;5.解放军第89医院 检验科,山东 潍坊 261021)
论著
芥子气经腹腔和气管致大鼠急性肺损伤细胞凋亡的变化*
祝筱姬1,朱双双2,韩玮1,贝媛媛2,钟玉绪3,刘菲1,王涛4,赵超5,赵建3
(1.解放军第89医院 呼吸科,山东 潍坊 261021;2.潍坊医学院 研究生处,山东 潍坊 261042;3.军事医学科学院 毒物药物研究所,北京 100850;4.解放军第89医院 病理科,山东 潍坊 261021;5.解放军第89医院 检验科,山东 潍坊 261021)
目的经腹腔和气管建立大鼠芥子气(S M)急性肺损伤动物模型,比较两种大鼠急性肺损伤模型细胞凋亡的差异。方法选取S p r a g u e D aw l ey大鼠136只,随机分为5组,正常对照组8只,其他4个组为腹腔S M组、腹腔丙二醇对照组、气管S M组、气管丙二醇对照组,每组32只。腹腔S M组腹腔内注入稀释的S M 0.1m l(0.96 L D50=8m g/k g),气管S M组气管内注入稀释的S M 0.1m l(0.98 L D50=2m g/k g),正常对照组未做任何处理。采用末端脱氧核苷酸转移酶介导的d U T P缺口末端标记测定法(T U N EL)染色和免疫组织化学法及电镜观察,判断细胞凋亡情况。结果①腹腔S M组各时间段肺泡间隔T U N EL染色阳性细胞表达率较气管S M组增多(P<0.05)。②腹腔S M组各时间段肺泡间隔凋亡蛋白Ba x阳性表达率较气管S M组升高(P<0.05);腹腔S M组各时间段肺泡间隔凋亡蛋白B c l-2阳性表达率较气管S M组降低(P<0.05)。③腹腔S M组各时间段肺泡间隔凋亡蛋白酶C a s pa s e-3、C a s pa s e-9阳性表达率较气管S M组增多(P<0.05)。④电镜显示,染毒72 h,腹腔S M组和气管S M组Ⅰ型和Ⅱ型肺泡上皮凋亡细胞形态特征为上皮细胞膜附着的微绒毛断裂缺失,排列紊乱;线粒体嵴模糊,粗面内质网表面附着的核糖体脱离,并游离于细胞质中。结论S M经腹腔和气管染毒致大鼠急性肺损伤,通过内源性通道引发细胞凋亡调节异常,S M经腹腔染毒大鼠各项细胞凋亡指标比经气管明显升高,推测可能与S M腹膜腔的快速吸收有关。
芥子气;肺损伤;细胞凋亡
芥子气(s u l fu r m u stard,S M)是一种最常用的化学武器,据统计其致伤率占所有化学武器的80%[1]。S M的主要靶器官是皮肤、肺、眼睛,其死亡率主要来自肺损伤和呼吸道病变[2]。S M中毒的病理生理机制相当复杂,涉及DN A和蛋白质烷化、酶功能失调、基因表达改变、氧自由基产生过剩和能量耗竭,导致细胞周期受阻,细胞凋亡或死亡,且所有阶段均伴随炎症反应[3]。S M诱导肺损伤与细胞凋亡密切相关,且细胞凋亡是S M诱导肺损伤的重要机制之一[4]。动物实验表明,S M经口服、皮肤、皮下、静脉、腹腔、气管途径均可致急性肺损伤,并且具有时间和剂量依赖性[1]。本实验通过建立高剂量S M经腹腔和气管途径致大鼠急性肺损伤模型,探讨其细胞凋亡的细胞和分子机制,为将来的干预性治疗奠定基础。
1 材料与方法
1.1实验试剂与仪器
1,2-丙二醇溶液由天津致远化学有限公司提供,羊血清由北京中杉金桥生物技术有限公司提供,微波缓冲液自配,试剂由北京化工厂提供,R oche细胞凋亡试剂由瑞士罗氏生物科技公司提供,B a x、B cl-2、活化的胱天蛋白酶(C aspase)-3、C aspase-9试剂盒由北京博奥森生物技术有限公司提供,H-7500型透射电镜由日本日立公司提供。
1.2实验动物与分组
健康雄性S pra g u e Da w ley大鼠(S P F级,中国人民解放军军事医学科学院实验动物中心提供,合格证号:0015902)136只,体质量280~300 g,年龄15周。
将大鼠分为腹腔S M组(32只)、腹腔丙二醇组(32只)、气管S M组(32只)、气管丙二醇组(32只)、正常对照组(8只)。S M液(纯度>90%)临用前用丙二醇稀释至所需浓度。①气管途径染毒动物模型建立:实验前气管S M组和气管丙二醇组皮下注射阿托品(0.05m g/k g),30min后腹腔内注射盐酸氯胺酮(100m g/k g)实施麻醉,气管内注入稀释的S M 0.1ml (0.98L D50=2m g/k g),气管丙二醇组注入丙二醇0.1ml。②腹腔途径染毒动物模型建立:同上方法实施麻醉。腹腔S M组大鼠腹腔内注入稀释的S M 0.1ml(0.96 L D50=8m g/k g),腹腔丙二醇组注入丙二醇0.1ml。正常对照组未做任何处理。
1.3观察指标
1.3.1制备石蜡切片与电镜观察收集大鼠肺组织标本共136份,10%中性福尔马林溶液固定标本24 h,常规脱水、石蜡包埋、切片、苏木精-伊红染色法(hemato x ylin-eosin stainin g,H E)染色,光镜观察。制备超薄切片:取新鲜标本1mm3,用3%戊二醛液固定标本,别在70%、80%、90%和100%丙酮梯度脱水15min,环氧树脂包埋,超薄切片,铀铅染色,透射电镜观察。
1.3.2末端脱氧核苷酸转移酶介导的d U T P缺口末端标记测定(t e r m in a l-d e o x y n u c l e o i t i d y l tr a ns f e r a s e m e d i a t e d ni c k e n d l a b e l ing,T U N EL)法标记凋亡细胞4μm石蜡切片,常规二甲苯脱蜡,0.3%双氧水H202处理10min;1∶200的P roteinase K稀释液消化10min;标记缓冲液末端转移酶(terminal deo x yn u cleotidyl trans f erase,TdT)和异羟基洋地黄毒苷配基标记的脱氧尿嘧啶核苷三磷酸(di g o x i g enin-deo x y u ridine triphosphate,D IG-d U T P)各1μl,加入18μl标记缓冲液,每片20μl,37℃标记2 h。封闭液每片50μl,室温处理30min。抗体稀释液1∶100稀释生物素化抗地高辛抗体,每片50μl,37℃孵育30min。抗体稀释液l∶100稀释链霉亲和素-生物素复合物,每片50μl,37℃孵育30min。新鲜配制二氨基联苯胺显色液显色20min,苏木素复染,0.01mol三羟基甲胺-盐酸缓冲盐溶液(Tris-H C l b uff er saline,T B S)终止反应,甘油明胶封片。以不加TDT酶作阴性对照,已知阳性切片作阳性对照组。
1.3.3凋亡蛋白Ba x和B c l-2检测免疫组织化学法检测凋亡蛋白B a x和B cl-2的表达。石蜡切片,常规二甲苯脱蜡,抗原修复,滴加兔抗大鼠B a x和B cl-2单克隆抗体20μl/片,再滴加二抗,三乙烯二胺(triethylene diamine,D A B C)显色,苏木精衬染,常规树脂封片。磷酸缓冲盐溶液(phosphate b uff er saline,P B S)代替一抗作阴性对照,用已知阳性切片作阳性对照组。
1.3.4C a s pa s e-3和C a s pa s e-9检测免疫组织化学法检测C aspase-3和C aspase-9的表达。石蜡切片,常规二甲苯脱蜡,抗原修复,滴加兔抗大鼠C aspase-3和C aspase-9单克隆抗体20μl/片,再滴加二抗,D A B C显色,苏木精衬染,常规树脂封片。P B S代替一抗作阴性对照,用已知阳性切片作阳性对照组。
1.3.5显微图像分析采用I ma g e-P ro P l u s 6.0病理细胞图像分析系统,将各组T U NE L标记及B a x、B cl-2、C aspase-3、C aspase-9免疫组织化学法染色切片行图像分析,选取测量参数,测定阳性率和强阳性率,每间隔1个高倍视野(400倍)选取1个视野进行观察,每张切片观察≥5个高倍视野,计算其肺泡间隔阳性细胞比率,肺泡间隔阳性细胞比率=5个高倍视野的阳性细胞数/细胞总数×100%,并计算其平均值。
1.4统计学方法
采用S P SS 17.0统计软件进行数据分析,计量资料以均数±平均差(x±s)表示,多组间比较用重复测量的多因素方差分析,P<0.05为差异有统计学意义。
2 结果
2.1大鼠肺泡间隔细胞凋亡情况
2.1.1T U N EL染色腹腔S M组6和24 h肺泡间隔凋亡细胞呈带状分布,48 h肺泡间隔凋亡细胞聚集成簇,72 h肺泡间隔凋亡细胞呈团簇状;气管S M 组6、24、48和72 h肺泡间隔细胞凋亡聚集成簇;丙二醇和正常对照组凋亡细胞呈零星分布(见图1)。5组不同时间的细胞凋亡阳性表达率比较,采用重复测量数据的方差分析结果:①腹腔和气管S M组不同时间的细胞凋亡阳性表达率比较,差异有统计学意义(F=18.479,P=0.000)。②腹腔S M组与其他4组的细胞凋亡阳性表达率比较,差异有统计学意义(F= 1 318.654,P=0.000)。③腹腔S M组与气管S M组的细胞凋亡阳性表达率变化趋势比较,差异有统计学意义(F=4.623,P=0.000),呈递增趋势(见图2、3)。
2.1.2Ba x免疫组织化学法腹腔和气管S M组6 h肺泡间隔凋亡蛋白B a x阳性表达呈带状分布,24 h肺泡间隔凋亡蛋白B a x阳性表达聚集成簇,48和72h肺泡间隔凋亡蛋白B a x阳性表达呈团簇状;丙二醇和正常对照组肺泡间隔凋亡蛋白B a x阳性表达呈零星分布(见图4)。5组不同时间的细胞凋亡阳性表达率比较,采用重复测量数据的方差分析结果:①腹腔和气管S M组不同时间的细胞凋亡阳性表达率比较,差异有统计学意义(F=23.202,P=0.000)。②腹腔S M组与其他4组的细胞凋亡阳性表达率比较,差异有统计学意义(F=490.828,P=0.000)。③腹腔S M组与气管S M组的细胞凋亡阳性表达率变化趋势比较,差异有统计学意义(F=8.031,P=0.000),呈递增趋势(见图5、6)。

图1 大鼠肺泡间隔TUN E L染色 (×400)

图2 5组大鼠肺泡间隔TUN E L染色细胞凋亡阳性表达率不同时间的变化趋势

图3 大鼠肺泡间隔TUN E L染色阳性细胞表达率
2.1.3B c l-2免疫组织化学法腹腔和气管S M组6 h肺泡间隔凋亡蛋白B cl-2阳性表达呈团簇状,24 h肺泡间隔凋亡蛋白B cl-2阳性表达聚集成簇,48和72 h肺泡间隔凋亡蛋白B a x阳性表达呈带状分布。丙二醇和正常对照组肺泡间隔凋亡蛋白B cl-2阳性表达呈零星分布(见图7)。5组不同时间的细胞凋亡阳性表达率比较,采用重复测量数据的方差分析结果:①腹腔和气管S M组不同时间的细胞凋亡阳性表达率比较,差异有统计学意义(F=211.833,P=0.000)。②腹腔S M组与其他4组的细胞凋亡阳性表达率比较,差异有统计学意义(F=617.955,P=0.000)。③腹腔S M组与气管S M组的细胞凋亡阳性表达率变化趋势比较,差异有统计学意义(F=134.574,P=0.000),呈递减趋势(见图8、9)。

图4 大鼠肺泡间隔凋亡蛋白Ba x表达 (×400)

图5 5组大鼠肺泡间隔凋亡蛋白Ba x阳性表达率不同时间的变化趋势

图6 大鼠肺泡间隔凋亡蛋白Ba x阳性表达率
2.1.4C a s pa s e-3免疫组织化学法腹腔和气管S M 组6 h肺泡间隔凋亡细胞C aspase-3阳性表达呈带状分布,24 h肺泡间隔凋亡细胞C aspase-3阳性表达聚集成簇,48和72 h肺泡间隔凋亡细胞C aspase-3阳性表达呈团簇状。丙二醇和正常对照组肺泡间隔凋亡细胞C aspase-3阳性表达呈零星分布(见图10)。5组不同时间的细胞凋亡阳性表达率比较,采用重复测量数据的方差分析结果:①腹腔和气管S M组不同时间的细胞凋亡阳性表达率比较,差异有统计学意义(F=34.201,P=0.000)。②腹腔S M组与其他4组的细胞凋亡阳性表达率比较,差异有统计学意义(F=759.817,P=0.000)。③腹腔S M组与气管S M组的细胞凋亡阳性表达率变化趋势比较,差异有统计学意义(F=18.073,P=0.000),呈递增趋势(见图11、12)。

图7 大鼠肺泡间隔凋亡蛋白B c l-2表达 (×400)

图8 5组大鼠肺泡间隔凋亡蛋白B c l-2阳性表达率不同时间的变化趋势

图9 大鼠肺泡间隔凋亡蛋白B c l-2阳性表达率
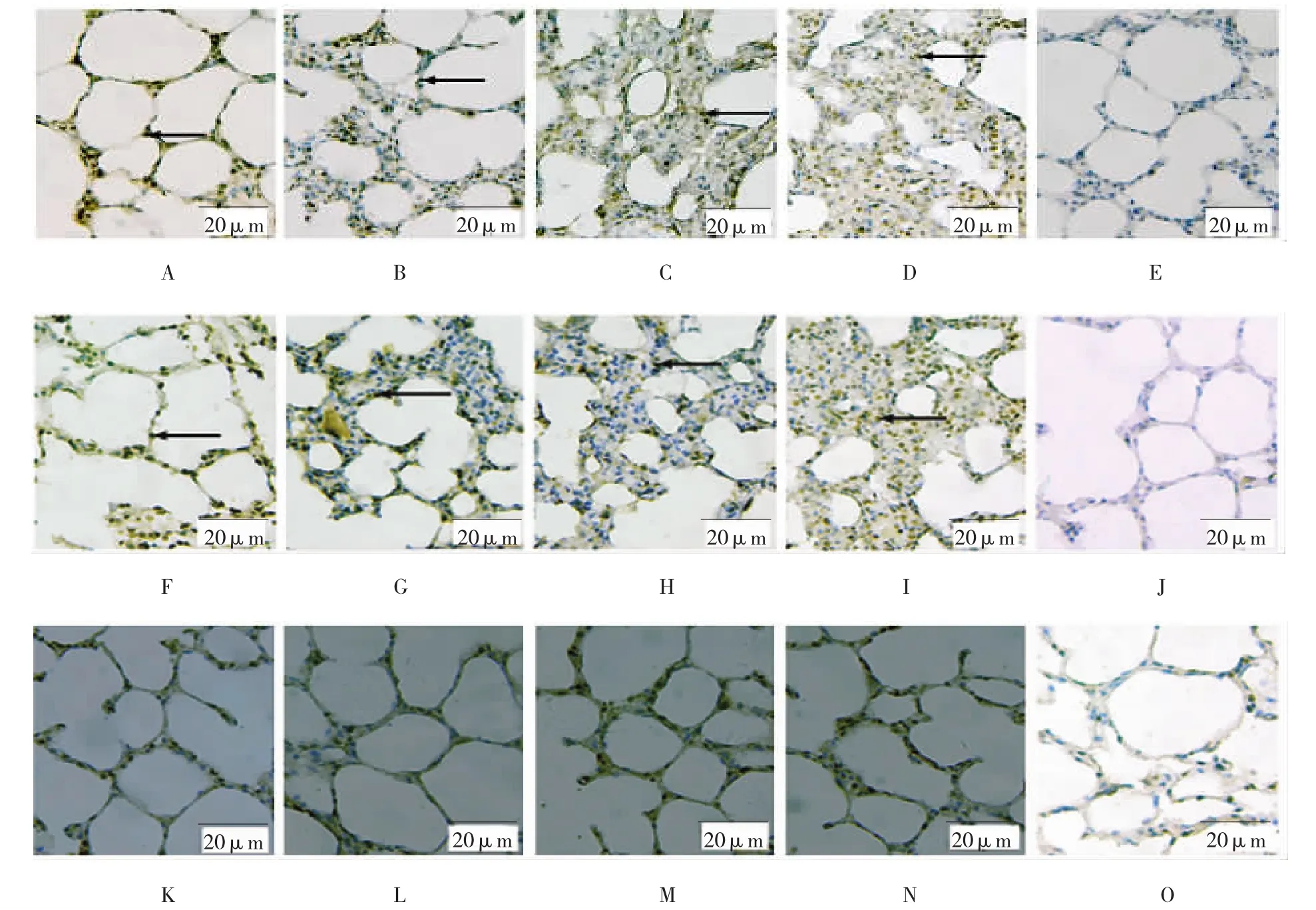
图10 大鼠肺泡间隔Caspase-3表达 (×400)

图11 5组大鼠肺泡间隔凋亡细胞Caspase-3阳性表达率不同时间的变化趋势
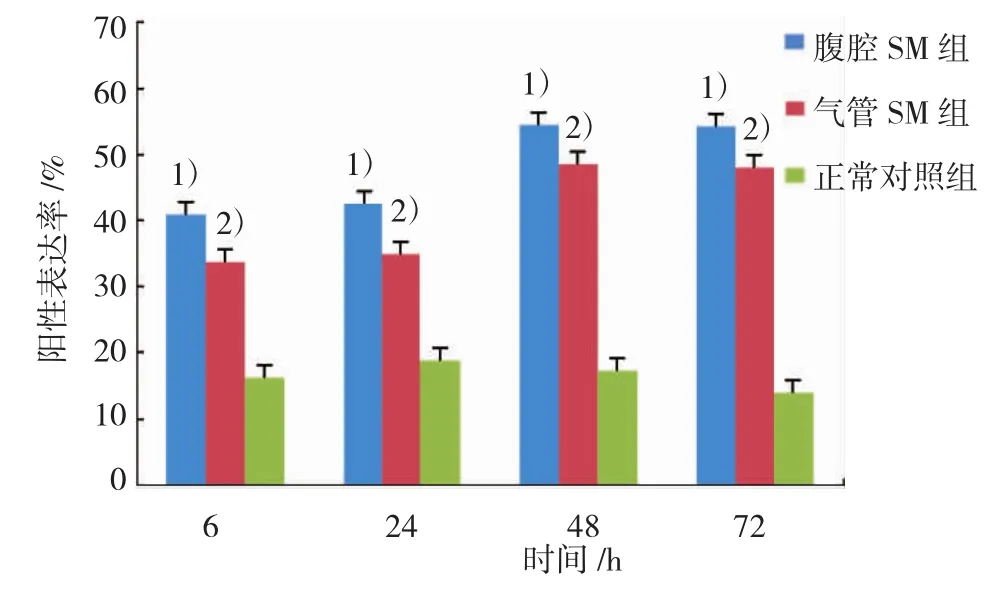
图12 大鼠肺泡间隔凋亡细胞Caspase-3阳性表达率
2.1.5C a s pa s e-9免疫组织化学法腹腔和气管S M组6 h肺泡间隔凋亡细胞C aspase-9阳性表达呈带状分布,24 h肺泡间隔凋亡细胞C aspase-9阳性表达聚集成簇,48和72 h肺泡间隔凋亡细胞C aspase-9阳性表达呈团簇状。丙二醇和正常对照组肺泡间隔凋亡细胞C aspase-9阳性表达呈零星分布(见图13)。5组不同时间的细胞凋亡阳性表达率比较,采用重复测量数据的方差分析结果:①腹腔和气管S M组不同时间的细胞凋亡阳性表达率比较,差异有统计学意义(F=24.755,P=0.000)。②腹腔S M组与其他4组的细胞凋亡阳性表达率比较,差异有统计学意义(F=2 087.109,P=0.000)。③腹腔S M组与气管S M组的细胞凋亡阳性表达率变化趋势比较,差异有统计学意义(F=10.844,P=0.000),呈递增趋势(见图14、15)。
2.2大鼠肺泡上皮细胞的超微结构变化
染毒72 h,腹腔和气管S M组大鼠Ⅰ型和Ⅱ型肺泡上皮凋亡细胞形态特征:上皮细胞膜附着的微绒毛断裂缺失,排列紊乱;线粒体嵴模糊,粗面内质网表面附着的核糖体脱离,并游离于细胞质中,细胞核染色质正常。丙二醇和正常对照组肺泡上皮形态:细胞膜、线粒体、粗面内质网、细胞核染色质正常。见图16。

图13 大鼠肺泡间隔Caspase-9表达 (×400)

图14 5组大鼠肺泡间隔凋亡细胞Caspase-9阳性表达率不同时间的变化趋势

图15 大鼠肺泡间隔凋亡细胞Caspase-9阳性表达率

图16 大鼠肺泡上皮细胞超微结构变化
3 讨论
细胞凋亡包括内源性(线粒体)和外源性(死亡受体)两种通路[5]。内源性通路启动经促凋亡分子(细胞色素C)从线粒体释放到胞浆内,导致C aspase-9激活,最后激活C aspase-3;外源性通路经细胞表面死亡受体诱导,刺激死亡结构域相关蛋白(adaptor F as-associated protein w ith death domain,F P DD)和死亡结构域相关肿瘤坏死因子受体(t u mor necrosis f actor receptor 1A-associatedv iadeathdomain,T R A DD),依次激活启动因子胱天蛋白酶原-8、-10。F P DD/T R A DD和 P rocaspaese-8,P rocaspaese-10组合成诱导死亡信号复合体(death-ind u cin g si g nalin g comple x,D I S C),D I S C能促进自身程序,启动P rocaspase活化,激活胱天蛋白酶原-8、-10并从蛋白复合体中游离。C aspaese-8、C aspaese-10可直接激活下游C aspaese-3、C aspaese-7导致细胞凋亡[6-7]。C aspaese是一种关键的蛋白酶,在两种细胞凋亡通路中发挥重要作用[8]。内源性通路和外源性通路均需激活C aspaese-3,其是细胞凋亡中的效应因子[9]。在许多生物过程中,细胞的生存与死亡取决于线粒体表面的B cl-2家族成员。B cl-2家族蛋白由促凋亡(B a x、B a k、B o k)和抗凋亡(B cl-2、B cl-x l)蛋白组成,主要在线粒体水平调控C aspase活性[10-11]。B cl-2和B cl-x l可稳定线粒体的完整性,B a x和B a k则可使小细胞器丧失稳定性。当B a x激活时,可嵌入线粒体外膜内,引发细胞色素C释放和细胞凋亡。反之,B cl-2表达过剩可抑制B a x激活,阻止DN A损伤和细胞色素C释放[12]。细胞凋亡还包括细胞核形态改变、凋亡小体形成、胞质凝聚、线粒体膜电位降低、细胞内酸化、丝氨酸磷脂酰基裸露于细胞表面、细胞皱缩、膜出泡[3]。S M可触发多种分子通路致肺损伤,包括氧化应激、细胞凋亡、补给失调、蛋白水解酶与抗蛋白水解酶失调、炎症、气道重塑、基因失调,导致细胞的完整性和功能丧失[13-17]。体内外实验研究表明,S M主要通过线粒体通路和死亡受体通路诱导细胞凋亡[2,4,8,18]。S M诱导的细胞反应相当复杂,还涉及3种丝裂原活化蛋白激酶(mito g en-acti v ated protein k inase,M A P K)通路和核因子-κB(n u clear f actor κB,N F-κB)通路、P53和胱天蛋白酶-多聚二磷酸腺苷核糖聚合酶(poly A D P-ribose polymerase,P A R P,C aspase-P A R P)通路、钙调蛋白通路[19-22]。许多学者研究发现,S M诱导细胞凋亡常与氧化应激、炎症反应、DN A损伤伴随,并与其伴随的反应程度呈正相关[23-26]。由此可见,在S M诱导肺损伤中,细胞凋亡是重要的分子和细胞损伤机制之一。
本研究通过T U NE L染色检测发现,腹腔和气管S M组肺泡间隔凋亡细胞数随时间延长呈递增趋势。腹腔S M组各时间段肺泡间隔凋亡细胞阳性表达率较气管S M组明显增多(P<0.05)。免疫组织化学法显示,腹腔和气管S M组肺泡间隔凋亡蛋白B a x阳性表达随时间延长呈递增趋势,而凋亡蛋白B cl-2则呈递减趋势。腹腔和气管S M组肺泡间隔凋亡蛋白酶C aspase-3、C aspase-9阳性表达随时间延长呈递增趋势。电镜显示,染毒72h,腹腔S M组和气管S M组Ⅰ型和Ⅱ型肺泡上皮凋亡细胞形态特征为上皮细胞膜附着的微绒毛断裂缺失,排列紊乱;线粒体嵴模糊,粗面内质网表面附着的核糖体脱离,并游离于细胞质中。本研究结果提示,经两种途径致大鼠急性肺损伤中细胞凋亡是S M损伤机制之一,像炎症反应一样,与S M的暴露剂量和时间呈正相关[27]。同时证实,导致细胞凋亡的分子机制是经线粒体通路。体外实验发现,S M诱导细胞凋亡可通过线粒体通路和死亡受体通路,且两种通路之间存在着相互关联性[28-29]。笔者检测的凋亡蛋白指标显示,促凋亡蛋白B a x表达增多,抗凋亡蛋白B cl-2表达减少,B a x/B cl-2比值增加,该比值的变化与T U NE L染色凋亡细胞逐渐增加趋势相符合。检测的凋亡蛋白酶指标提示,启动因子C aspase-9和效应因子C aspase-3均呈阳性表达,表明线粒体通路中C aspase裂解和触发作用被激活[30-31]。该凋亡蛋白酶的变化与R A Y[8]和S OU R DE V A L等[32]报道结果相同。电镜显示,S M诱导肺上皮细胞形态学变化主要在细胞膜、线粒体、粗面内质网。学者推测该损伤现象可能与线粒体膜通透性改变和线粒体膜电位降低及钙离子失衡有关[33-34]。由此表明,线粒体是细胞易损伤的微小器官和生物程序的主要调控点[11]。一旦线粒体损伤,则会激活多种促凋亡分子信号通路,有助于加速细胞的自我毁灭[35-36]。笔者认为,S M诱导细胞凋亡是多种因素作用的结果,其分子和细胞机制相当复杂,这种网络式调节通路尚未完全阐明。本研究结果显示,S M经腹腔和气管致大鼠急性肺损伤通过内源性通道引发细胞凋亡调节异常,S M经腹腔染毒大鼠各项细胞凋亡指标比气管明显升高,推测可能与S M腹膜腔的快速吸收有关。在经腹腔和气管造模剂量的选择方面,研究发现,S M腹腔注射引起的肺损伤较经皮下注射或口服途径染毒更严重[37]。当大鼠经腹腔注射S M剂量>10m g/k g时,就会出现大鼠死亡[38]。显然笔者选择经腹腔和气管S M L D50相近的剂量建立急性肺损伤模型,S M肺损伤细胞凋亡的反应程度出现差异性,说明血液对S M的吸收可能占主导作用。本研究提示,在S M L D50相同剂量下,并非是经气管致肺损伤诱导细胞凋亡最重,为S M肺损伤的靶向干预提供有价值的参数。
[1]S HOH R A T I M,K A R IM Z A DE H I,S A BU R I A,et al.The role o f N-acetylcysteine in the mana g ement o f ac u te and chronic p u lmonary complications o f s u l fu r m u stard:a literat u re re v ie w[J].I nhal To x icol,2014,26(9):507-523.
[2]K E Y S E R B M,A ND R E S D K,NE A LL E Y E,et al.P oste x pos u re applicationo f F as receptor small-inter f erin g R N Ato s u ppress s u l fu r m u stard-ind u cedapoptosisinh u manair w ayepithelial cells:implication f or a therape u tic approach[J].J P harmacol E x p Ther,2013,344(1):308-316.
[3]K E H E K,B A LSZ UW E I T F,S TE I N R I T Z D,et al.M olec u lar to xicolo g y o f s u l fu r m u stard-ind u cedc u taneo u s in f lammationand blisterin g[J].To x icolo g y,2009,263(1):12-19.
[4]PI RZ A D G,J A F A R IM,T A V A N A S,et al.The R ole o f F as-F as L si g nalin g path w ay in ind u ction o f apoptosis in patients w ith s u l fu r m u stard-ind u ced chronic bronchiolitis[J].J To x icol,2010,D O I: 10.1155/2010/373612.
[5]K E Y S E R B M,A ND R E S D K,HO L M E S W W,et al.M u stard g as inhalation in j u ry:therape u tic strate g y[J].I nt J To x icol,2014,33(4):271-281.
[6]G H A NE I M,H A R A ND I A A.M olec u lar and cell u lar mechanism o f l u n g in j u ries d u e to e x pos u re to s u l fu r m u stard:a re v ie w[J]. I nhal To x icol,2011,23(7):363-371.
[7]JO S E P H L B,H E C K D E,C E R V E LL I J A,et al.S tr u ct u ral chan g es in hair f ollicles and sebaceo u s g lands o f hairless mice f ollo w in g e x pos u re to s u l fu r m u stard[J].E x p M ol P athol,2014,96(3):316-327.
[8]R A Y R,S IM BU L A N-R O S ENT H A L CM,K E Y S E R B M,et al. Su l fu r m u stard ind u ces apoptosis in l u n g epithelial cells v ia a caspase ampli f ication loop[J].To x icolo g y,2010,271(3):94-99.
[9]G R O SS A,MC D O NNE LL J M,KO RS M E Y E R S J.B C L-2 f amily members and the mitochondria in apoptosis[J].G enes De v,1999,13(15):1899-1911.
[10]WO N G W W,P U T H A L A K A T H H.B cl-2 f amily proteins:the sentinels o f the mitochondrial apoptosis path w ay[J].I UB M B L i f e,2008,60(6):390-397.
[11]R A Y R,K E Y S E R B,B ENT O N B,et al.Su l fu r m u stard ind u ces apoptosis inc u lt u rednormal h u manair w ay epithelial cells:e v idence o f a dominant caspase-8-mediated path w ay and di ff erential cell u lar responses[J].Dr u g C hem To x icol,2008,31(1): 137-148.
[12]IM A N I S,P A N A H I Y,S A L IMI A N J,et al.Epi g enetic:a miss-in g paradi g m in cell u lar and molec u lar path w ays o f s u l fu r m u stard l u n g:a prospecti v e and comparati v e st u dy[J].I ran J B asic M ed S ci,2015,18(8):723-736.
[13]V A L I Z A DE H M,MI RZ A E I B,T A V A LL A E I M,et al.Do w nre g u lation o f T G F-b1,T G F-b receptor 2,and T G F-β-associated micro R N A s,mi R-20a and mi R-21,in s k in lesions o f s u lfu r m u stard-e x posed I ranian w ar v eterans[J].J R ecept S i g nal Transd u ct R es,2015,35(6):634-639.
[14]N OU R A N I M R,M A H M OO D Z A DE H HO SS E I N I H,IM A N I F OO L A D I A A,et al.C omparati v e transcriptional and translational analysis o f heme o x y g enase e x pression in response to s u l fu r m u stard[J].J R ecept S i g nal Transd u ct R es,2015,35(5): 479-484.
[15]YU E L,Z H A N G Y,C H EN J,et al.Distrib u tion o f DN A add u cts andcorrespondin g tiss u e dama g e o f S pra g u e-Da w ley rats w ith perc u taneo u s e x pos u re to s u l fu r m u stard[J].C hem R es To x icol,2015,28(3):532-540.
[16]JOW S E Y P A,B L A I N PG.C hec k point k inase 1 is acti v ated and promotes cell s u r v i v al a f ter e x pos u re to s u lph u r m u stard[J]. To x icol L ett,2015,232(2):413-421.
[17]L U LL A A,PI N O M A,PI ET K A-O TT L I K M,et al.Ebselen red u ces the to x icity o f mechlorethamine in A-431 cells v ia inhibition o f apoptosis[J].J B iochem M ol To x icol,2013,27(6):313-322.
[18]R E BHO LZ B,K E H E K,R U Z IC K A T,et al.R ole o f N F-k appa B/R el A and M A P K path w ays in k eratinocytes in response to s u l fu r m u stard[J].J I n v est Dermatol,2008,128(7):1626-1632.
[19]G O S W A MI D G,TE W A R I-S I N G H N,D H A R D,et al.Nitro g en m u stard-ind u cedcorneal in j u ryin v ol v esDN Adama g eand path w ays related to in f lammation,epithelial-stromal separation,and neo v asc u lari z ation[J].C ornea,2015,35(2):257-266.
[20]B A LSZ UW E I T F,M EN A C H E R G,B L O E M E K E B,et al.Dev elopment o f a co-c u lt u re o f k eratinocytes and imm u ne cells f or in v itro in v esti g ationo f c u taneo u s s u l fu r m u stard to x icity[J]. C hem B iol I nteract,2014,223:117-124.
[21]MI N S A V A G E G D,D I LL M A N J F.B i fu nctional al k ylatin g ag ent-ind u ced p53 and nonclassical n u clear f actor k appa B responses and cell death are altered by ca ff eic acid phenethyl ester:a potential role f or antio x idant/electrophilic response-element si g nalin g[J].J P harmacol E x p Ther,2007,321(1):202-212.
[22]JOW S E Y P A,W I LL I A M S F M,B L A I N PG.DN A dama g e responses in cells e x posed to s u lph u r m u stard[J].To x icol L ett,2012,209(1):1-10.
[23]JO S T P,S VOBO D OV A H,S TET I N A R.I nd u ction and repair o f DN A cross-lin k s ind u ced by s u l fu r m u stard in the A-549 cell line f ollo w ed by a comet assay[J].C hem B iol I nteract,2015,237:31-37.
[24]G E R E C K E D R,C H EN M,I S UK A P A LL I SS,et al.Di ff erential g ene e x pression pro f ilin g o f mo u se s k in a f ter s u l fu r m u stard e xpos u re:E x tended time response and inhibitor e ff ect[J].To x icol A ppl P harmacol,2009,234(2):156-165.
[25]M A L A V I Y A R,S U N I L V R,C E R V E LL I J,et al.I n f lammatory e ff ects o f inhaled s u l fu r m u stard in rat l u n g[J].To x icol A ppl P harmacol,2010,248(2):89-99.
[26]I NT U R I S,TE W A R I-S I N G H N,J A I N A K,et al.A bsence o f a p53 allele delays nitro g en m u stard-ind u ced early apoptosis and in f lammation o f m u rine s k in[J].To x icolo g y,2013,311(3):184-190.
[27]朱双双,祝筱姬,赵建,等.芥子气不同途径染毒致大鼠急性肺损伤的观察[J].中华劳动卫生职业病杂志,2015,33(9):685-688.
[28]P OH L C,P A P R I T Z M,M O I S C H M,et al.A c u te morpholo g ical and to x icolo g ical e ff ects in a h u man bronchial coc u lt u re model a f ter s u l fu r m u stard e x pos u re[J].To x icol S ci,2009,112(2):482-489.
[29]S TE I N R I T Z D,E MM L E R J,H I NT Z M,et al.A poptosis in s u lfu r m u stard treated A549 cell c u lt u res[J].L i f e S ci,2007,80 (24/25):2199-2201.
[30]DE B I A K M,K E H E K,BÜR K L E A.R ole o f poly(A D P-ribose)polymerase in s u l fu r m u stard to x icity[J].To x icolo g y,2009,263(1): 20-25.
[31]C U S IM A N O E M,K N IG H T A R,SL U SS E R J G,et al.M itochondria:the hemi o f the cell[J].A d v Emer g N u rs J,2009,31(1): 54-62.
[32]S OU R DE V A L M,L E M A I R E C,DEN I A U D A,et al.I nhibition o f caspase-dependent mitochondrial permeability transition protects air w ay epithelial cells a g ainst m u stard-ind u ced apoptosis[J]. A poptosis,2006,11(9):1545-1559.
[33]F UJ I T A E,E G A S H I R A J,U R A S E K,et al.C aspase-9 processin g by caspase-3 v ia a f eedbac k ampli f ication loop in v i v o[J]. C ell Death Di ff er,2001,8(4):335-344.
[34]R O S ENT H A L D S,S IM BU L A N-R O S ENT H A L CM,I Y E R S,et al.C almod u lin,poly(A D P-ribose)polymerase and p53 are targ ets f or mod u latin g the e ff ects o f s u l fu r m u stard[J].J A ppl To x icol,2000,20(Su ppl 1):S43-S49.
[35]K IM T H,Z H A O Y,B A R B E R M J,et al.B id-ind u ced cytochrome c release is mediated by a path w ay independent o f mitochondrial permeability transitionpore andba x[J].J B iol C hem,2000,275(50):39474-39481.
[36]P O R TE R A G,JÄN IC K E R U.Emer g in g roles o f caspase-3 in apoptosis[J].C ell Death Di ff er,1999,6(2):99-104.
[37]W E I N B E R G E R B,L A S K I N J D,S U N I L V R,et al.Su l fu r m u stard-ind u cedp u lmonary in j u ry:therape u tic approaches to miti g atin g to x icity[J].P u lm P harmacol Ther,2011,24(1):92-99. [38]J A F A R I M.Dose and time dependent e ff ects o f s u l fu r m u stard on antio x idant system in li v er and brain o f rat[J].To x icolo g y,2007,231(1):30-39.
(童颖丹 编辑)
Changes of apoptosis in acute pulmonary injury of rats induced by intraperitoneal and tracheal injection of sulfur mustard*
X iao-j i Z h u1,S h u an g-sh u an g Z h u2,W ei H an1,Y u an-y u an B ei2,Y u-x u Z hon g3,F ei L i u1,Tao W an g4,C hao Z hao5,J ian Z hao3
(1.Department of Respiratory Diseases,the 89th Hospital of PLA,Weifang,Shandong 261021,China;2.Graduate Department,Weifang Medical College,Weifang,Shandong 261042,China;3.Institute of Pharmacology and Toxicology,Academy of Military Medical Sciences,Beijing 100850,China;4.Department of Pathology;5.Clinical Laboratory,the 89th Hospital of PLA,Weifang,Shandong 261021,China)
Objective To establish rat models of sulfur mustard(SM)-induced acute lung injury via intra-peritoneal and tracheal injection,and compare the difference in apoptosis of the two models.M ethods A total of 136 male Sprague Dawley rats were selected and randomly divided into control group with 8 cases and other four groups(i.e.intraperitoneal SM group,intraperitoneal glycol propylene group,tracheal SM group and tracheal glycol propylene group with 32 cases in each group).The intraperitoneal SM group was intraperitoneally injected with 0.1m l diluted SM(0.96 LD50=8mg/kg),the tracheal SM group had intratracheal injection of 0.1m l diluted SM(0.98 LD50=2mg/kg),meanwhile the status quo was kept with the control group. SM-induced apoptosis was observed by TUNEL staining and immunohistochemical staining as well as electron microscopy.Results In the alveolar septum,the expression rate of positive cells by TUNEL staining in the intraperitoneal SM group was increased compared with that in the tracheal SM group at the same period of time(P<0.05).In the alveolar septum,a significantly higher positive expression rate of Bax protein was detected by immunohistochemical staining in the intraperitoneal SM group at different periods of time compared with that in the tracheal SM group at the corresponding period(P<0.05);while a significantly lower positive expression rate of Bcl-2 protein was detected by immunohistochemical staining in the intraperitoneal SM group at different periods of time compared with that in the tracheal SM group at the corresponding period(P<0.05).In the alveolar septum,the expression rates of caspase-3 and caspase-9 by immunohistochemical staining in the intraperitoneal SM group at different periods of time were increased compared those with the tracheal SM group at the corresponding period(P<0.05).Electron microscopic observation confirmed that both type I and type II alveolar epithelial cells in the lungs exhibited apoptotic morphologic features,such as break,loss and disarrangement of the microvilli on cell membrane,blurred mitochondrial cristae,and detachment and dissociation of the ribosomes from the surface of the rough endoplasmic reticula.Conclusions Our results showed that dysregulation of apoptosis via intrinsic pathways in the intraperitoneal SM group and the tracheal SM group leads to up-regulation of apoptosis.In SM-induced acute lung injury in rats via intraperitoneal route,the index of apoptosis is significantly higher than that via tracheal route,which may be related to fast absorption of SM in the peritoneal cavity.
sulfur mustard;lung injury;apoptosis
R 114;R 563.8文献识别码:A
10.3969/j.issn.1005-8982.2016.15.003
1005-8982(2016)15-0011-11
2015-01-19
国家重大新药创制科技重大专项(No:2013Z X09J13103-01B)
赵建,E-mail:j ian_z hao@126.com;Tel:010-66931646,18910216751

