幽门螺杆菌lpp20基因在食品级乳酸菌中的表达及免疫活性鉴定*
孙 楠,张荣光,段广才,陈帅印,彭晓燕,范清堂,郗园林
郑州大学公共卫生学院流行病学教研室; 河南省分子医学重点实验室 郑州 450001
幽门螺杆菌lpp20基因在食品级乳酸菌中的表达及免疫活性鉴定*
孙楠,张荣光#,段广才#,陈帅印,彭晓燕,范清堂,郗园林
郑州大学公共卫生学院流行病学教研室; 河南省分子医学重点实验室 郑州 450001
摘要目的:构建分泌表达幽门螺杆菌lpp20基因的重组乳酸乳球菌菌株,并鉴定其免疫活性,为研究安全高效的幽门螺杆菌口服疫苗奠定基础。方法:采用PCR法从幽门螺杆菌基因组DNA中扩增lpp20基因,将lpp20先与T载体(pMD19-T)连接,进而经双酶切与表达载体pNZ8149-SPusp45连接,用电穿孔法将重组质粒转入食品级乳酸乳球菌菌株NZ3900中,并用Nisin诱导Lpp20表达,表达产物通过Western blot法鉴定免疫活性。结果:lpp20基因的PCR扩增产物大小约为540 bp,重组质粒的酶切、PCR和测序鉴定结果符合预期;在菌体和培养基中均检出表达的Lpp20蛋白,重组表达的Lpp20蛋白相对分子质量约为20 000,且具有与小鼠抗幽门螺杆菌血清反应的免疫活性。结论:成功构建了能够分泌表达幽门螺杆菌Lpp20抗原的乳酸乳球菌菌株,该重组菌株在口服疫苗研究中具有应用潜力。
幽门螺杆菌(Helicobacterpylori,H.pylori)是人体胃炎、消化性溃疡和胃癌等胃部疾病的主要病原体[1-2]。我国自然人群H.pylori感染率为56.22%[3],虽然临床治疗H.pylori感染目前仍以三联疗法为主,但由于药物治疗的不良反应严重和根除率逐年下降,且无法达到群体防治的效果[4],所以疫苗研究将在H.pylori感染防治中具有广阔应用前景。食品级乳酸乳球菌(Lactococcuslactis,L.lactis)NZ3900菌株以其安全可靠性而成为备受关注的口服疫苗表达载体[5-6]。Lpp20是一种免疫活性较强且氨基酸序列高度保守的H.pylori保护性抗原[7],目前以L.lactisNZ3900为 Lpp20表达宿主菌的口服疫苗研究尚少有报道。该研究构建表达Lpp20抗原的重组L.lactis菌株,并鉴定其作为H.pylori疫苗菌株的免疫活性。
1材料与方法
1.1质粒与菌株L.lactisNZ3900菌株和质粒载体pNZ8149购自荷兰NIZO食品研究所;H.pyloriHp27菌株为河南省分子医学重点实验室保种菌株,分离自郑州市慢性萎缩性胃炎患者;质粒载体pNZ8149-SPusp45由河南省分子医学重点实验室前期构建;质粒载体pMD19-T购自大连宝生物公司。
1.2主要试剂pMD19-T克隆载体、质粒提取试剂盒、凝胶DNA回收试剂盒、T4 DNA连接酶、限制性内切酶及DL2000 Marker和pyrobest DNA 聚合酶购自TaKaRa公司,诱导剂Nisin为美国Sigma公司产品。
1.3H.pylorilpp20基因的PCR扩增用碱裂解法提取H.pyloriHp27菌株的基因组DNA。扩增lpp20基因的PCR引物由上海生工生物工程有限公司合成,引物序列:5’-CGAGTCGCATGCATGAAAAATCAAGTTA-3’(上游),5’-GCTCTAGACTACTTTTTAACCATGCCCAA-3’(下游)。在上游和下游引物中分别含有SphⅠ和XbaⅠ酶切位点。采用pyrobest DNA聚合酶和上述引物,以Hp27 基因组DNA为模板,PCR扩增lpp20基因,PCR反应条件为:预变性94 ℃5 min,94 ℃变性30 s,55 ℃退火30 s;72 ℃终延伸5 min。
1.4H.pylorilpp20基因克隆和鉴定将PCR产物用10 g/L琼脂糖凝胶进行电泳分析,并用凝胶回收试剂盒回收,将回收的基因片段与质粒载体pMD19-T连接后,用于转化E.coliDH5α感受态细胞。通过蓝白斑筛选得到阳性转化子,用试剂盒从转化子中提取质粒,经PCR和酶切鉴定后,将重组质粒pMD19-T-lpp20交由上海生工生物工程有限公司测序。
1.5表达载体的构建和L.lactis的转化分别将pMD19-T-lpp20和L.lactis质粒载体pNZ8149-SPusp45用SphⅠ+XbaⅠ进行双酶切,用试剂盒回收lpp20基因和载体pNZ8149-SPusp45的酶切片段,以T4 DNA连接酶于室温连接2 h,将10 μL连接产物与100 μLL.lactisNZ3900感受态细胞混匀后,转入预冷的电击杯进行电转化[8]。电击参数:脉冲25 μF、电阻200 Ω、电压1 250 V,电击后加入1 mL预冷的GM17MC恢复培养基,将菌液转入1.5 mL的离心管中,冰上静置5 min,30 ℃、体积分数5%CO2条件下静止恢复培养2 h, 取100 μL恢复培养的菌液接种到Elliker选择固体培养基上[8],在30 ℃、体积分数5%CO2条件下静止培养过夜,阳性克隆子为黄色菌落。提取重组菌质粒,通过PCR、酶切、测序进行鉴定。
1.6Lpp20的诱导表达参照文献[8],将L.lactisNZ3900/pNZ8149-SPusp45和L.lactisNZ3900/pNZ8149-SPusp45-lpp20单菌落分别接种于10 mL GM17液体培养基中,30 ℃、体积分数5%CO2条件下静止培养过夜。次日取过夜培养的菌液2 mL加入到50 mL的GM17液体培养基中,在菌液OD600nm=0.3~0.4时,加入Nisin液至终浓度为25 mg/L,诱导5 h,将菌液4 ℃离心,分别收集上清和菌体,上清中加入终体积分数为10%的三氯乙酸于4 ℃过夜,次日收集沉淀,-20 ℃贮存备用;用原菌液0.1倍体积的磷酸缓冲液重悬菌体,加溶菌酶37 ℃水浴,1 h后用超声细胞壁仪破壁,4 ℃离心收集上清,即为菌体蛋白,-20 ℃贮存备用。
1.7Western blot检测采用120 g/L分离胶和50 g/L浓缩胶进行SDS-PAGE分析,重组菌株的菌体可溶性蛋白和培养液上清蛋白样品按每孔20~50 μg上样。电泳约3 h,凝胶用考马斯亮蓝R250染色,脱色,待蛋白条带清晰后,用凝胶图像分析仪进行分析。重组乳酸菌表达产物经SDS-PAGE电泳后,用湿转法转膜,采用课题组前期自制的小鼠抗H.pylori血清作为一抗,辣根过氧化物酶标记的羊抗鼠IgG为二抗,根据需要量将增强型发光剂和稳定剂混合配置为化学发光检测底物,进行Western blot分析。
2结果
2.1H.pylorilpp20基因的PCR扩增以H.pyloriHp27菌株基因组DNA为模板,lpp20基因的PCR产物电泳结果见图1。
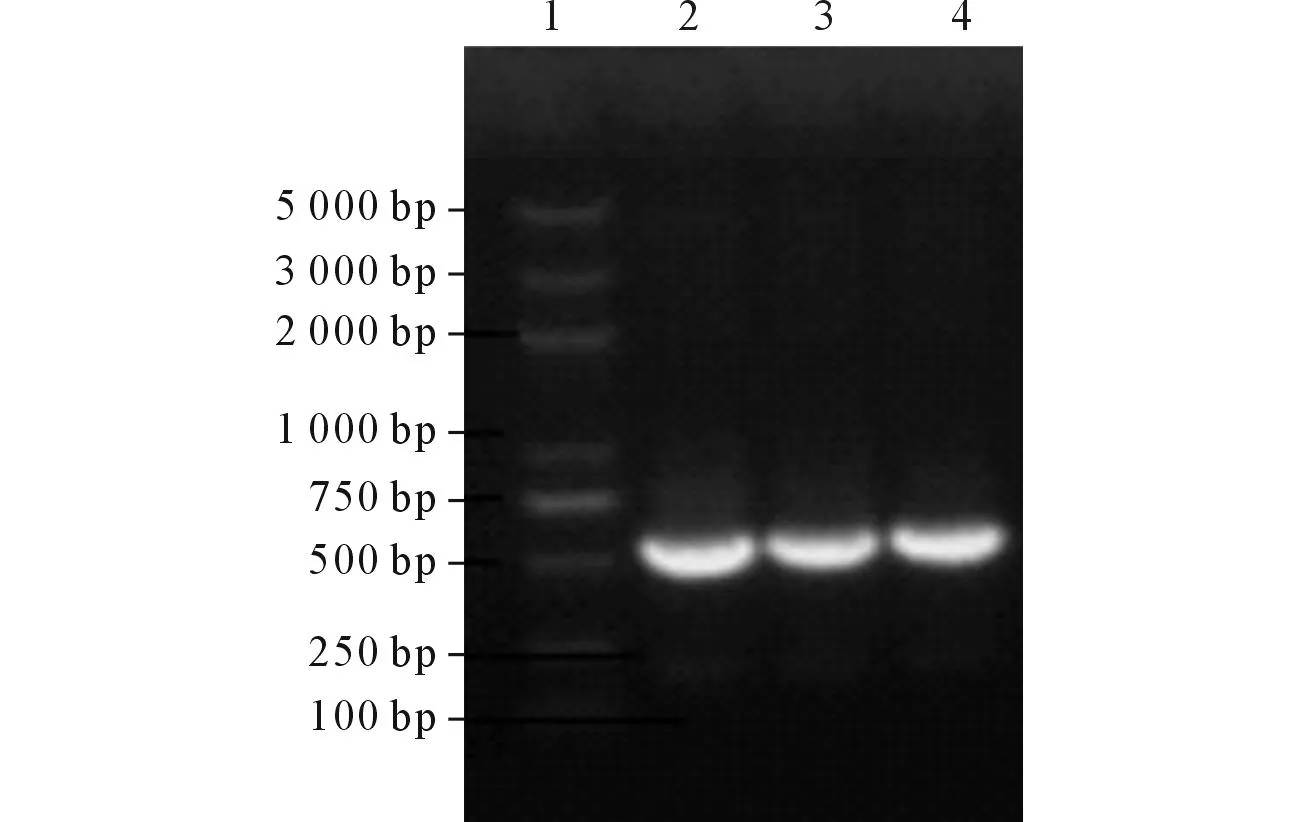
1:DNA Marker;2、3、4:lpp20 PCR产物。图1 H. pylori lpp20基因的PCR扩增
2.2H.pylorilpp20基因克隆和鉴定构建的重组质粒pMD19-T-lpp20的PCR和双酶切鉴定结果正确(图2),测序结果与GenBank 报道Hp27 lpp20基因序列(GI:31540586)同源性为97%,对应的氨基酸序列相同。
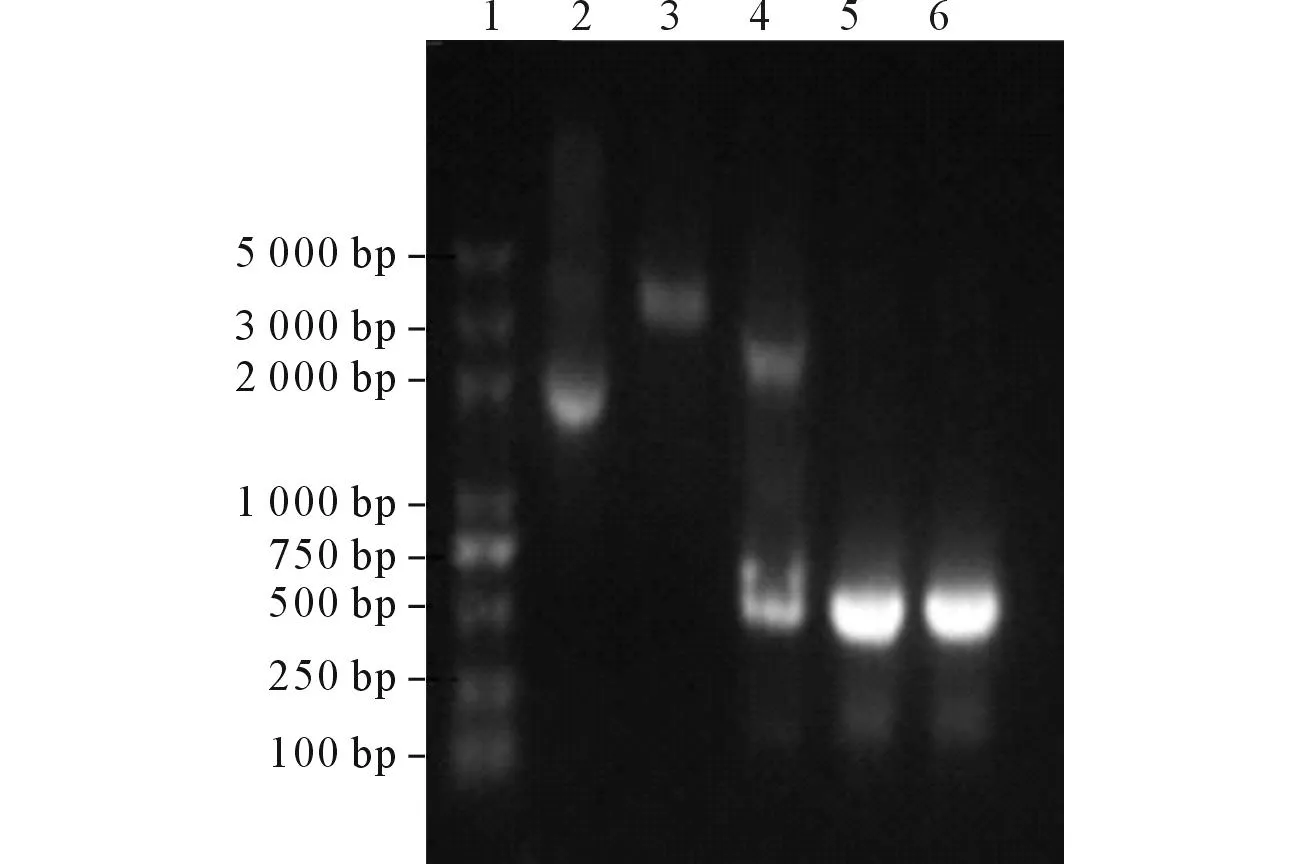
1:DNA Marker;2:pMD19-T-lpp20质粒;3:质粒pMD19-T-lpp20单酶切;4:质粒pMD19-T-lpp20双酶切;5:以重组质粒为模板lpp20 PCR产物;6:以H. pylori基因组DNA为模板lpp20 PCR产物。图2 重组质粒pMD19-T-lpp20的PCR和酶切鉴定
2.3重组质粒pNZ8149-SPusp45-lpp20的构建L.lactis经电转化后,在Elliker筛选培养板生长出金黄色阳性菌落,菌落经培养后提取质粒,重组质粒的PCR、酶切鉴定(图3)及测序结果符合预期。
2.4重组L.lactis菌株表达产物鉴定L.lactis菌株诱导表达产物的SDS-PAGE分析结果显示重组菌株与原菌株蛋白条带差异不明显。Western blot分析结果显示,重组菌株菌体总蛋白和培养液上清蛋白样品中均检出相对分子质量约为20 000的Lpp20表达产物,重组表达的Lpp20蛋白与小鼠抗H.pylori免疫血清发生明显的阳性反应(图4、5)。
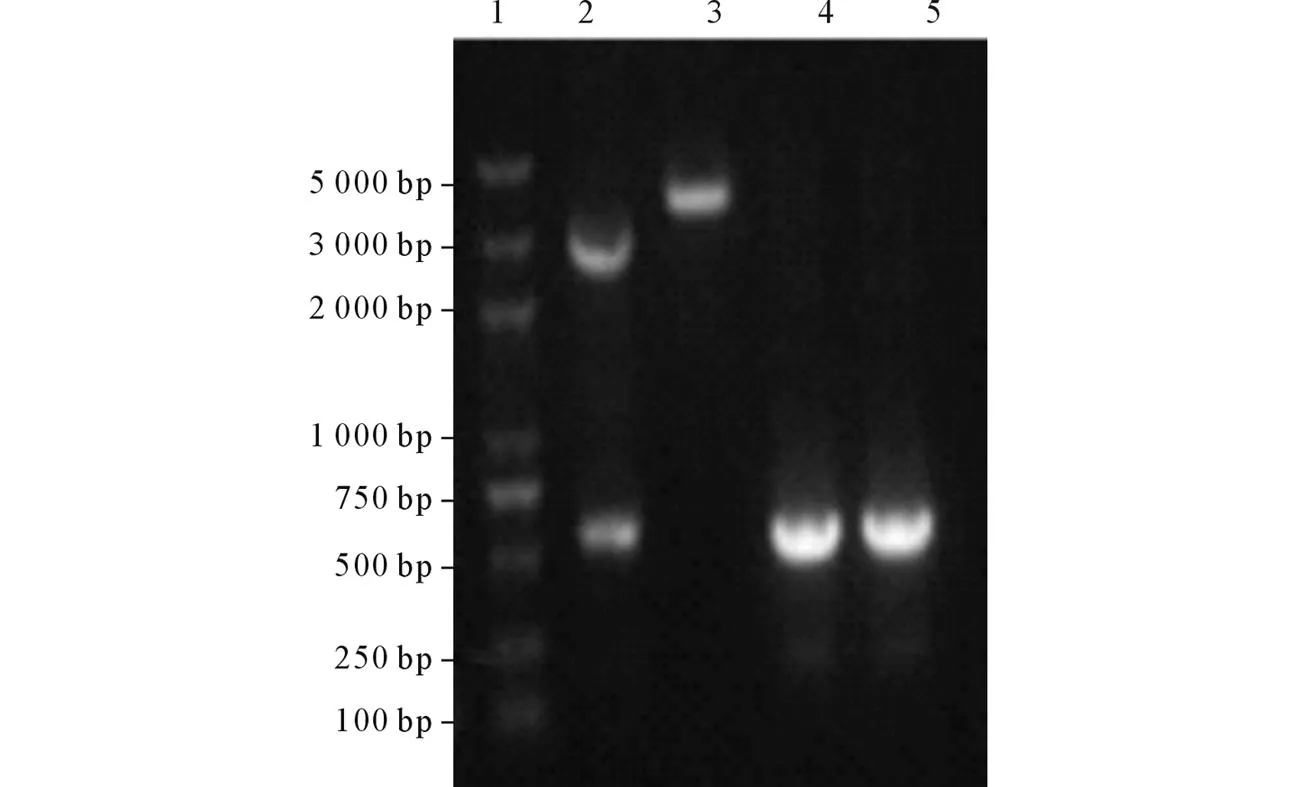
1: DNA Marker;2:质粒pNZ8149-SPusp45-lpp20双酶切;3:质粒pNZ8149-SPusp45-lpp20单酶切;4:以重组质粒为模板lpp20基因的 PCR产物;5:以H. pylori全基因组为模板lpp20 PCR产物。图3 重组质粒pNZ8149-SPusp45-lpp20的PCR和酶切鉴定

1:蛋白Marker;2:L.lactis NZ3900/pNZ8149-SPusp45-lpp20菌体总蛋白;3:L.lactis NZ3900/pNZ8149-SPusp45菌体总蛋白。 图4 L.lactis 重组菌株菌体蛋白样品的Western blot结果

1:蛋白Marker;2:L.lactis NZ3900/pNZ8149-SPusp45-lpp20 培养基上清蛋白;3:L.lactis NZ3900/pNZ8149-SPusp45培养基上清蛋白。图5 L.lactis 重组菌株培养基上清样品的Western blot结果
3讨论
临床上常用抗生素治疗H.pylori的感染,对这类疾病频繁采用抗生素治疗可致使细菌耐药性增加,而且对重复感染无预防作用[9],所以更有效的防治只能寄希望于疫苗研究的成功。在疫苗研究中,口服疫苗以其免疫途径安全、方便、合理等优点而受到关注,然而,缺乏安全有效的疫苗载体阻碍了口服疫苗研究发展。现有研究[10]多采用减毒伤寒沙门氏菌作为口服疫苗载体,由于沙门氏菌属于致病菌,减毒株不仅仍具有一定的毒性,而且还存在遗传稳定性问题,应用于人体时其安全性难以保证。而且这类疫苗应用于人体时,检测不到或仅引起微弱的免疫反应,免疫效果远低于动物实验[11]。因此,有必要探讨更安全有效的口服疫苗载体。
L.lactis是乳酸菌类的一个菌种,在食品加工中的应用已有悠久的历史,属于食品级的益生菌,安全性十分可靠,且其生长迅速,易于培养,遗传背景和调控机制相对清楚,作为口服疫苗载体具有很大潜力。在基因工程领域,已建立一系列基于乳酸菌的遗传转化系统,应用这些系统定向生产人类所需要的产品将成为热点。乳酸菌遗传转化系统中应用较多的是NICE系统。L.lactisNZ3900/pNZ8149是NICE系统中的一种,其诱导剂、筛选标记和宿主均为食品级,是食品级安全的外源基因表达系统,在安全性方面的优势十分突出[5-6,12]。作者所在的实验室前期为了扩大该系统表达外源基因的功能,通过在pNZ8149核苷酸序列中插入编码信号肽的SPusp45序列,以期得到能分泌表达外源基因的pNZ8149-SPusp45。该研究结果表明,pNZ8149-SPusp45能够在L.lactisNZ3900中分泌表达外源基因Lpp20,为口服疫苗研究提供了一种新的抗原表达载体系统。
从H.pylori疫苗保护性抗原的研究进展上看, 理想的疫苗候选抗原应该具有特异性、保守性、低毒性、能够定位于病原的表面等特征,H.pylori的Lpp20蛋白是定位于细菌外膜上的一种高度保守的脂蛋白,现有研究[13]显示Lpp20是一种理想的疫苗候选抗原。虽有研究[7]表明,分离自菌体外膜囊泡的Lpp20蛋白具有良好的免疫原性和免疫保护性,但由于采用这种方法制备疫苗抗原较困难,Lpp20抗原在疫苗方面应用研究受到限制。该研究构建的L.lactis重组表达系统为Lpp20制备提供了一种新的方法。
该研究构建的重组菌株L.lactisNZ3900/pNZ8149-SPusp45-lpp20中除H.pylori疫苗抗原基因lpp20外,其余成分均具有食品级安全性,极大限度地提高了该工程菌株作为疫苗菌株的安全性[6]。该实验结果表明该菌株能够分泌表达Lpp20蛋白,且表达的Lpp20蛋白与小鼠抗H.pylori血清发生较强的免疫反应。
综上所述,重组菌株L.lactisNZ3900/pNZ8149-SPusp45-lpp20不仅具有作为口服疫苗的应用潜力,而且有望作为发酵菌株,用于食品加工,尤其是乳制品发酵工艺中,生产具有防治幽门螺杆菌感染及相关胃肠疾病作用的保健食品,产生可观的社会经济效益。
参考文献
[1]DA COSTA DM,PEREIRA EDOS S,RABENHORST SH.What exists beyond cagA and vacA?Helicobacterpylorigenes in gastric diseases[J].World J Gastroenterol,2015,21(37):10563
[3]张万岱,胡伏莲,萧树东,等.中国自然人群幽门螺杆菌感染的流行病学调查[J].现代消化及介入诊疗,2010,15(5):265
[4]杨钰欣,李丹丹.幽门螺杆菌疫苗相关研究进展[J].中国免疫学杂志,2012,28(5):478
[5]ZHANG XJ,FENG SY,LI ZT,et al.Expression ofHelicobacterpylorihspA gene inLactococcuslactisNICE system and experimental study on its immunoreactivity[J].Gastroenterol Res Pract,2015,2015:750932
[7]KEENAN J,OLIARO J,DOMIGAN N,et al.Immune response to an 18-kilodalton outer membrane antigen identifies lipoprotein 20 as aHelicobacterpylorivaccine candidate[J].Infect Immun,2000,68(6):3337
[8]CHEN S,ZHANG R,DUAN G,et al.Food-grade expression ofHelicobacterpyloriureB subunit inLactococcuslactisand its immunoreactivity[J].Curr Microbiol,2011,62(6):1726
[9]KRISTENSEN D,CHEN D.Strategies to advance vaccine technologies for resource-poor settings[J].Vaccine,2013,31(Suppl 2):B157
[10]GUNN BM,WANDA SY,BURSHELL D,et al.Construction of recombinant attenuated Salmonella enterica serovar
typhimurium vaccine vector strains for safety in newborn and infant mice[J].Clin Vaccine Immunol,2010,17(3):354
[11]ANDERL F,GERHARD M.Helicobacterpylorivaccination: is there a path to protection?[J].World J Gastroenterol,2014,20(34):11939
[12]MIERAU I,KLEEREBEZEM M.10 years of the nisin-controlled gene expression system (Nice) inLactococcuslactis[J].Appl Microbiol Biotechnol,2005,68(6):705
[13]岳俊杰,李北平,周围,等.幽门螺杆菌Lpp20蛋白的生物信息学分析[J].生物技术通讯,2009,20(5):651
(2015-12-11收稿责任编辑李沛寰)
doi:10.13705/j.issn.1671-6825.2016.04.011
#通信作者:张荣光,男,1968年5月生,博士,副教授,研究方向:分子流行病学,E-mail:zrg@zzu.edu.cn;段广才,男,1958年8月生,博士,教授,研究方向:分子流行病学,E-mail: gcduan@zzu.edu.cn
中图分类号R183
关键词乳酸菌;lpp20基因;幽门螺杆菌;分泌表达;食品级
Expression of Helicobacter pylori lpp20 gene in food-grade Lactococcus lactis and its immunoreactivity
SUN Nan,ZHANG Rongguang,DUAN Guangcai,CHEN Shuaiyin,PENG Xiaoyan,FAN Qingtang,XI Yuanlin
DepartmentofEpidemiology,CollegeofPublicHealth,ZhengzhouUniversity;HenanKeyLaboratoryofMolecularMedicine,Zhengzhou450001
Key wordsLactococcus lactis;lpp20 gene;Helicobacter pylori;secretary expression;food-grade
AbstractAim: To construct a food-grade expression system of Helicobacter pylori(H. pylori) lpp20 gene in Lactococcus lactis(L.lactis) and evaluate its immunoreactivity with aim to establish basis for development of safe and efficient orally administrable vaccine against H. pylori. Methods: The lpp20 gene was obtained by PCR amplification from the genomic DNA of H. pylori, and ligated to plasmid pMD19-T and then to the expression vector pNZ8149-SPusp45. The recombinant pNZ8149-SPusp45-Lpp20 was electrotransformed into L.lactis NZ3900. The resultant recombinant strains were induced to express the exogenous gene with Nisin, and the expression products were assessed by Western blot. Results: The length of the amplified lpp20 gene by PCR was estimated 540 bp. The gene fragments were correctly inserted into the vector as identified by enzyme digestion, PCR and gene sequencing. The expression product of lpp20 gene was detected both in the bacterium digestion and the culture media samples, and with a relative molecular weight of 20 000,which was immunoreactive to anti-H. pylori mouse sera. Conclusion: The recombinant strain of L.lactis capable of secretary expression of H. pylori antigen Lpp20 has been successfully constructed and, shows potential for being an anti-H. pylori vaccine candidate.
*中国博士后科学基金资助项目20070410252

