慢性阻塞性肺疾病模型大鼠骨骼肌中Calpains的表达
刘待见,冯慧芬,刘剑波#
1)郑州大学第二附属医院呼吸内科 郑州 450014 2)郑州大学第五附属医院感染科 郑州 450052
慢性阻塞性肺疾病模型大鼠骨骼肌中Calpains的表达
刘待见1),冯慧芬2),刘剑波1)#
1)郑州大学第二附属医院呼吸内科 郑州 4500142)郑州大学第五附属医院感染科 郑州 450052
摘要目的:探讨Calpains在慢性阻塞性肺疾病(COPD)大鼠骨骼肌萎缩中的作用。方法:40只健康雄性Wistar大鼠随机分为COPD模型组及对照组,模型组采用气管内注入脂多糖加香烟烟雾染毒法建立大鼠COPD模型,HE染色法观察肺组织及骨骼肌(趾长伸肌、膈肌)组织的病理学改变;分别采用免疫组化和RT-PCR法测定骨骼肌组织中Calpains(μ-Calpain和m-Calpain)蛋白及mRNA的表达。结果:在COPD模型组大鼠观察到骨骼肌萎缩,对照组大鼠未见骨骼肌萎缩。与对照组比较,COPD模型组大鼠趾长伸肌及膈肌中μ-Calpain和m-Calpain蛋白及m-Calpain mRNA表达增强(P<0.05),而μ-Calpain mRNA的表达差异无统计学意义(P>0.05)。结论:Calpains在COPD模型大鼠骨骼肌中表达上调,可能参与COPD模型大鼠骨骼肌萎缩。
慢性阻塞性肺疾病(chronic obstructive pulmonary disease,COPD)是呼吸系统常见病,病变主要累及肺脏,也可引起全身不良效应[1],其中骨骼肌(包括膈肌)萎缩是重要表现之一,严重影响患者生活质量及预后。目前发现多种代谢途径通过肌纤维降解、肌细胞凋亡[2]或坏死参与骨骼肌萎缩,其中Ca2+依赖蛋白酶途径(Calpains途径)是重要调节机制之一,Calpains途径中的核心成员μ-Calpain和m-Calpain能够降解骨骼肌中的肌原纤维蛋白和骨架蛋白[3],参与肌细胞凋亡和坏死,介导多种病理情况下的骨骼肌萎缩。但两者是否参与COPD骨骼肌萎缩仍不清楚,为此,作者建立大鼠COPD模型,通过检测μ-Calpain和m-Calpain在趾长伸肌和膈肌中的表达,研究Calpains与COPD骨骼肌萎缩的关系,探索COPD骨骼肌萎缩的发生机制。
1材料与方法
1.1材料红旗渠牌香烟(尼古丁1.0 mg/支,焦油12 mg/支)购自河南中烟安阳卷烟厂;脂多糖(LPS)购自Sigma公司;μ-Calpain和m-Calpain兔抗鼠单克隆抗体、生物素标记羊抗兔单克隆抗体、逆转录试剂盒及辣根酶标记链酶卵白素均购自南京建成生物技术有限公司;Trizol购自Invitrogen有限公司。
1.2实验动物分组及模型建立40只10周龄健康雄性清洁级Wistar大鼠(河南省实验动物中心),体重197.8~246.1(228.7±17.0) g,采用随机数字表法分为COPD模型组和对照组各20只,适应性饲养大鼠7 d,模型组在第1天和第14天气管内注入LPS(配制质量浓度1 g/L,每只大鼠灌注200 μg),第2~13天及15~28天行红旗渠牌香烟烟雾暴露,2次/d,每次持续0.5 h。对照组在模型组气管内注入LPS当天以相同术式气管内注入等体积注射用生理盐水,余不做任何干预。
1.3标本收集及预处理造模成功后腹腔麻醉,腹主动脉抽血法处死大鼠,快速分离大鼠右侧趾长伸肌及膈肌,分别分成两部分,一部分投入液氮罐中冻存以备RT-PCR检测,另一部分置于40 g/L多聚甲醛液固定,待病理学及免疫组化检测。40 g/L多聚甲醛液注入右心室灌注双肺,直到双肺完全变白,于右肺垂直于支气管的矢状面最大周径处取材,放入40 g/L多聚甲醛液固定24 h以上。
1.4大鼠肺组织及骨骼肌组织病理检测将固定完成的肺组织和骨骼肌组织进行石蜡包埋切片,HE染色后电子显微镜下观察组织病理学改变。
1.5大鼠骨骼肌中μ-Calpain和m-Calpain蛋白表达的测定采用免疫组化SP法。操作严格按试剂盒说明书进行。骨骼肌中μ-Calpain和m-Calpain蛋白阳性反应产物均呈棕色颗粒状,每例骨骼肌标本各取4张阳性切片,每张切片选取5个视野,采用计算机多功能真彩图像分析系统(CMIAS)进行图像分析和数据处理,计算阳性细胞的平均灰度值。
1.6大鼠骨骼肌中μ-Calpain和m-Calpain mRNA表达的测定采用RT-PCR测定μ-Calpain和m-Calpain mRNA的表达水平,以β-actin为内参,严格遵照试剂盒说明操作。μ-Calpain上游引物序列5’-TCCCTCTGCAAACCAAAGTACA-3’,下游引物序列5’-ACTGCACTGAAACATGGGACCT-3’,扩增产物大小为207 bp。β-actin上游引物序列5’-ATCAT GTTTGAGACCTTCAACA-3’,下游引物序列5’- CATCTCTTGCTCGAAGTCTA-3’,扩增产物大小为388 bp。m-calpain上游引物序列5’-CATTTGACT GACCAACTGAGCC-3’,下游引物序列5’-ACGTTTG GAAGTGGATAAGGCA-3’,扩增产物大小为188 bp。产物经20 g /L琼脂糖凝胶电泳后置于暗箱式紫外透射仪中成像,扫描图像,输入计算机,应用专业凝胶图像分析处理软件测定其灰度值,结果均以β-actin为对照,计算灰度比值。
1.7统计学处理采用SPSS 17.0 进行分析。经方差齐性检验后,应用两独立样本t检验比较COPD模型组和对照组大鼠骨骼肌中Calpains蛋白及mRNA表达水平的差异,检验水准α=0.05。
2结果
2.1模型评价COPD模型组大鼠皮毛黄涩,反应迟钝,活动减少及有咳嗽、喘息、卧底弓背等呼吸困难表现。对照组动物毛色有光泽,反应灵敏,活动自如。造模结束当天,COPD模型组大鼠体重(257.0±18.9) g,对照组为(282.0±16.0) g,差异有统计学意义(t=4.515,P<0.001)。
2.2两组大鼠肺组织病理学改变模型组大鼠支气管黏膜结构紊乱,部分纤毛柱状上皮细胞缺失,柱状上皮细胞纤毛减少、粘连、倒伏,杯状上皮细胞显著增生;黏膜下层、肌层及细支气管周围有大量炎性细胞浸润,淋巴细胞为主;肺泡上皮细胞部分缺失,肺泡壁变薄,部分断裂,肺泡腔膨大,大小不均,形状不规则,部分损毁融合成大疱(图1A)。对照组大鼠支气管黏膜结构完整,纤毛柱状上皮细胞排列整齐,杯状细胞无增生;肺泡结构完整,肺泡腔大小均匀一致(图1B)。
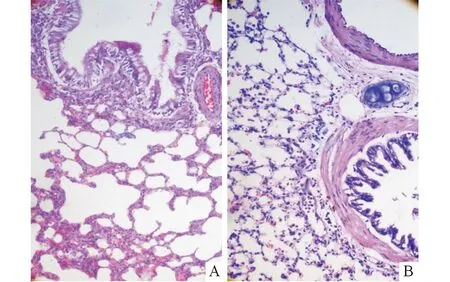
A:模型组;B:对照组。图1 两组大鼠肺组织病理结果(HE,×200)
2.3两组大鼠骨骼肌组织病理学改变见图2。模型组大鼠趾长伸肌及膈肌肌纤维排列紊乱、松弛,形态干瘪,局部有断裂,胞核排列紊乱,大小不一(图2A1、A2)。对照组大鼠骨骼肌肌纤维染色均匀,形态饱满,排列整齐,胞核规则排列于肌膜下,大小一致(图2B1、B2)。
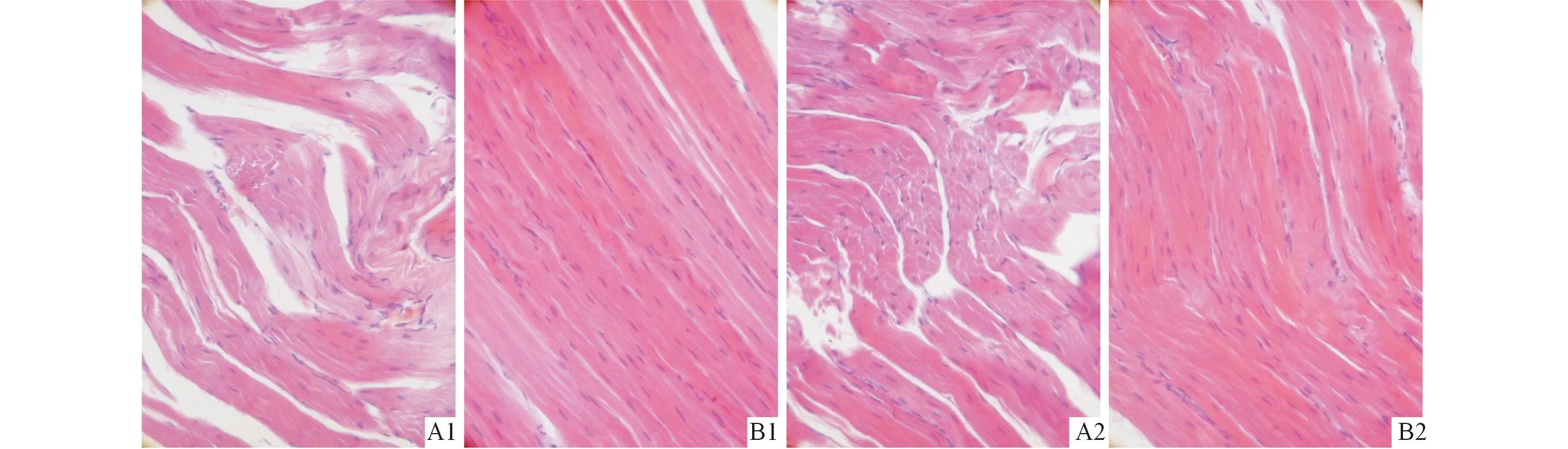
A:模型组;B:对照组;1: 趾长伸肌;2:膈肌。图2 两组大鼠骨骼肌组织病理学变化(HE,×200)
2.4两组大鼠骨骼肌中μ-Calpain和m-Calpain蛋白的表达见图3、表1。
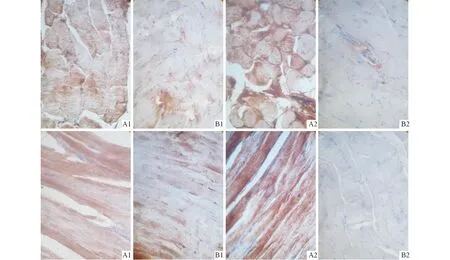
A:模型组;B:对照组;1: μ-Calpain蛋白;2:m-Calpain蛋白。图3 两组大鼠膈肌(上排)和趾长伸肌(下排)中Calpain蛋白的表达(SP,×400)
μ-Calpain和m-Calpain棕色颗粒主要集中在骨骼肌细胞胞质中,在间质内皮细胞及血管壁平滑肌细胞亦呈阳性表达。在模型组大鼠骨骼肌中,μ-Calpain和m-Calpain蛋白表达呈强阳性;对照组骨骼肌中见少量μ-Calpain表达阳性的棕色颗粒沉着,未见m-Calpain阳性染色。
2.5两组大鼠骨骼肌中μ-Calpain和m-Calpain mRNA的表达见图4、表2。
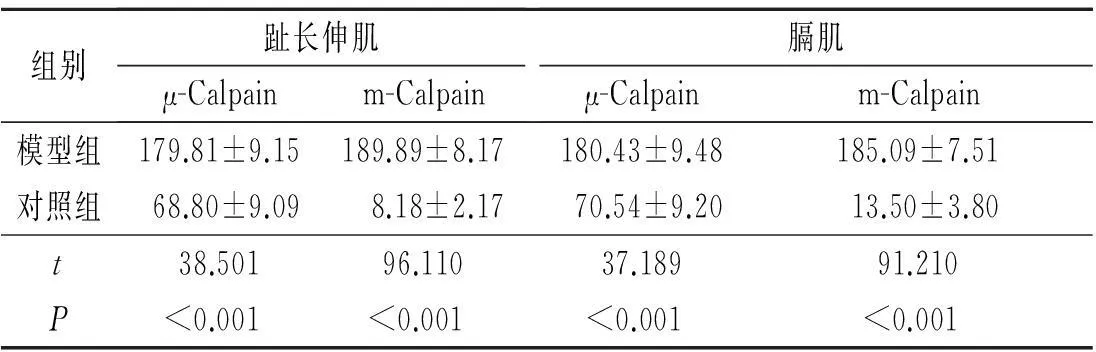
表1 两组大鼠骨骼肌中μ-Calpain和m-Calpain蛋白的表达(n=20)
图4 两组大鼠膈肌(上排)和趾长伸肌(下排)中Calpain mRNA的表达
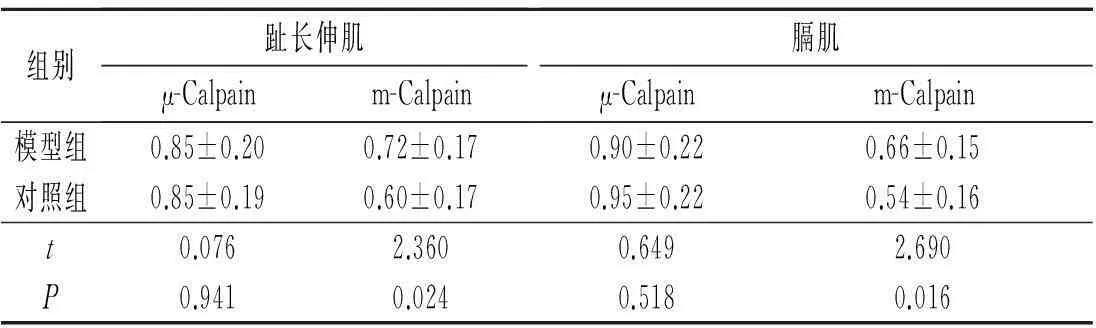
表2 两组大鼠骨骼肌中μ-Calpain和m-Calpain mRNA的表达(n=20)
3讨论
骨骼肌萎缩作为COPD主要的肺外不良效应,在COPD患者中普遍存在,与病死率高度相关[4]。研究[5-6]发现,骨骼肌萎缩最终取决于三个方面:蛋白质分解代谢增加,蛋白质合成代谢减少及肌细胞坏死和凋亡增加,其中蛋白质分解增加及合成减少是萎缩的主要原因。早在1992年,Koohmaraie[7]已经证明Calpains途径作为骨骼肌蛋白分解代谢的起始因子,通过降解结蛋白等肌纤维骨架蛋白,破坏肌小节结构,释放肌丝,启动肌纤维蛋白降解过程,同时激活其他蛋白降解途径,引起肌肉萎缩。Calpastatin为Calpains的专一性、内源性抑制剂,有研究[8]显示,过表达Calpastatin,同时耗竭细胞内ATP,能够减少肌纤维蛋白降解,从反面论证Calpains参与肌原纤维蛋白降解。另一项研究[9]同样发现抑制Calpains活性,可抑制骨骼肌中纤维蛋白和骨架蛋白的降解,更进一步证实Calpains可促进骨骼肌萎缩。有学者[10-11]通过显微镜观察到萎缩的骨骼肌纤维中存在纤维蛋白和骨架蛋白降解,肌小节完整性破坏,Z线结构扭曲,抑制Calpains活性能够减轻上述病理变化。还有研究[12-13]证实在COPD、类风湿关节炎、糖皮质激素、去神经、失重、烧伤等介导的病理性骨骼肌萎缩中,Calpains介导肌细胞凋亡,促进骨骼肌萎缩;Calpains还通过参与肌纤维坏死过程,促进肌营养不良综合征及少肌症发病[14-15]。
以上研究证实Calpains能够降解骨骼肌中的肌原纤维蛋白和骨架蛋白,参与肌细胞凋亡和坏死,介导多种病理情况下的骨骼肌萎缩。但Calpains是否参与COPD骨骼肌萎缩鲜见报道。该研究主要观察COPD大鼠骨骼肌病理改变及Calpains在COPD大鼠骨骼肌中的表达情况,结果显示:与对照组相比,COPD模型组大鼠存在骨骼肌萎缩,并在萎缩的骨骼肌中存在μ-Calpain和m-Calpain蛋白及m-Calpain mRNA的高表达,提示μ-Calpain和m-Calpain可能参与COPD骨骼肌萎缩,但具体机制有待进一步实验研究。此外,该研究结果还发现:对照组和COPD模型组大鼠骨骼肌中均见μ-Calpain蛋白表达,且在COPD模型组中的表达水平较对照组明显增加,推测μ-Calpain可能在生理情况下可发挥调节骨骼肌代谢的作用,病理情况下被异常激活,促进骨骼肌萎缩;而m-Calpain蛋白及mRNA在对照组大鼠骨骼肌中表达极少,在模型组表达明显增加,提示m-Calpain主要在COPD病理情况下促进大鼠骨骼肌萎缩。
综上说明,Calpains在COPD大鼠骨骼肌中表达增加,可能参与了COPD骨骼肌萎缩,但具体机制有待进一步明确。
参考文献
[1]中华医学会呼吸病学分会慢性阻塞性肺疾病学组.2013年慢性阻塞性肺疾病诊治指南(修订版)[J].中华结核和呼吸杂志,2013,36(4):255
[2]赵磊,姜东林,吕广明,等.单纯运动或感觉神经损伤在骨骼肌萎缩中的致凋亡作用[J].解放军医学杂志,2011,26(9):923
[3]PHELPS KJ,DROUILLARD JS,SILVA MB,et al.Effect of extended postmortem aging and steak location on myofibrillar protein degradation and Warner-Bratzler shear force of beef M. semitendinosus steaks[J].J Anim Sci,2016,94(1):412
[4]MATHUR S,BROOKS D,CARVALHO CR.Structural alterations of skeletal muscle in copd[J].Front Physiol,2014,5:104
[5]YU Y,CHU W,CHAI J,et al.Critical role of miRNAs in mediating skeletal muscle atrophy (Review)[J].Mol Med Rep,2016,13(2):1470
[6]LANGEN RC,GOSKER HR,REMELS AH,et al.The molecular basis of skeletal muscle atrophy[J].Int J Biochem Cell Biol,2013,45(10):2245
[7]KOOHMARAIE M.Ovine skeletal muscle multicatalytic proteinase complex (proteasome): purification, characterization, and comparison of its effects on myofibrils with mu-calpains[J].J Anim Sci,1992,70(12):3697
[8]KENT MP,SPENCER MJ,KOOHMARAIE M.Postmortem proteolysis is reduced in transgenic mice overexpressing calpastatin[J].J Anim Sci,2004,82(3):794
[9]PURINTRAPIBAN J,WANG MC,FORSBERG NE.Degradation of sarcomeric and cytoskeletal proteins in cultured skeletal muscle cells[J].Comp Biochem Physiol B Biochem Mol Biol,2003,136(3):393
[10]BELOZEROVA I,SHENKMAN B,MAZIN M,et al.Effects of long-duration bed rest on structural compartments of m. soleus in man[J].J Gravit Physiol,2001,8(1):P71
[11]FITTS RH,RILEY DR,WIDRICK JJ.Physiology of a microgravity environment invited review:microgravity and skeletal muscle[J].J Appl Physiol (1985),2000,89(2):823
[12]王富霞,夏熙郑,刘待见.慢性阻塞性肺疾病模型大鼠骨骼肌组织中Caspase-12和m-Calpain的表达[J].郑州大学学报(医学版),2014,49(4):508
[13]KRAMEROVA I,KUDRYASHOVA E,VENKATRAMAN G,et al.Calpain 3 participates in sarcomere remodeling by acting upstream of the ubiquitin-proteasome pathway[J].Hum Mol Genet,2005,14(15):2125
[14]TEIXEIRA VDE O,FILIPPIN LI,XAVIER RM.Mechanisms of muscle wasting in sarcopenia[J].Rev Bras Reumatol,2012,52(2):252
[15]DARGELOS E,POUSSARD S,BRULÉ C,et al.Calcium-dependent proteolytic system and muscle dysfunctions: a possible role of calpains in sarcopenia[J].Biochimie,2008,90(2):359
(2015-09-23收稿责任编辑赵秋民)
doi:10.13705/j.issn.1671-6825.2016.04.026
#通信作者,男,1964年2月生,博士,教授,主任医师,研究方向:慢性气道炎症性疾病,E-mail:jbliuzz@126.com
中图分类号R365
关键词慢性阻塞性肺疾病;骨骼肌萎缩;Calpain;大鼠
Expression of Calpains in skeletal muscle of rat COPD model
LIU Daijian1),FENG Huifen2),LIU Jianbo1)
1)DepartmentofRespiratoryDiseases,theSecondAffiliatedHospital,ZhengzhouUniversity,Zhengzhou4500142)DepartmentofInfectiousDiseases,theFifthAffiliatedHospital,ZhengzhouUniversity,Zhengzhou450052
Key wordsCOPD;skeletal muscle atrophy;Calpain;rat
AbstractAim: To study the role of Calpains in rat skeletal muscle atrophy of chronic obstructive pulmonary disease (COPD).Methods: Forty healthy male Wistar rats were randomly allocated into COPD group and control group. COPD model was established by dripping lipopolysacharide(LPS) into trachea and exposing to cigarettes smoking.The pathological changes of lung tissue and skeletal muscle were observed by HE staining. Immunohistochemistry and RT-PCR were performed respectively to determine protein and mRNA expression of Calpain in skeletal muscle(μ-Calpain and m-Calpain).Results: Skeletal muscle atrophy was observed in COPD group instead of control group.Compared with control group,the expression of μ-Calpain and m-Calpain protein in extensor digitorum longus muscle and diaphragm of COPD group was enhanced (P<0.05), as well as m-Calpain mRNA expression(P<0.05).Conclusion: The expression of Calpains in skeletal muscle of rats COPD model upregulated. Calpains may be involved in COPD skeletal muscle atrophy.

