PI3K/Nrf2通路在内毒素休克兔肾损伤中的作用*
陈牡林, 余剑波, 宫丽荣 , 史 佳
(1天津医科大学南开临床学院,天津市南开医院麻醉科,天津 300310; 2天津市西青医院麻醉科,天津 300380 )
PI3K/Nrf2通路在内毒素休克兔肾损伤中的作用*
陈牡林1, 2,余剑波1△,宫丽荣1,史佳1
(1天津医科大学南开临床学院,天津市南开医院麻醉科,天津 300310;2天津市西青医院麻醉科,天津 300380 )
[摘要]目的: 探讨磷脂酰肌醇3-激酶/核因子E2相关因子2(PI3K/Nrf2)信号通路在内毒素休克兔急性肾损伤中的作用。方法: 健康清洁级雄性新西兰大白兔50只,随机分为5组(每组10只):对照组(C组)、内毒素休克模型组(L组)、渥曼青霉素+内毒素休克组(WL组)、渥曼青霉素组(W组)和二甲基亚砜组(D组)。W组、WL组经耳缘静脉注射渥曼青霉素0.6 mg/kg,D组注射二甲基亚砜0.08 mL/kg,C组和L组注射等容量生理盐水。30 min后,L组和WL组静脉注射脂多糖5 mg/kg(溶于2 mL生理盐水),C组、W组和D组注射等容量生理盐水。注射脂多糖或生理盐水后6 h处死兔,取肾组织进行肾损伤评分(HSK),测定血尿素氮(BUN)、肌酐(Cr)和尿α1-微球蛋白(α1-MG)浓度,检测肾组织MDA含量及SOD活性,检测肾组织Nrf2和HO-1的mRNA总Akt蛋白、p-Akt蛋白、总Nrf2蛋白、p-Nrf2蛋白、核Nrf2蛋白和HO-1蛋白水平。结果: 与C组、W组及D组比较,L组和WL组HSK、BUN、Cr、α1-MG及MDA含量升高,SOD活性降低,肾组织Nrf2和HO-1的mRNA、p-Akt蛋白、Nrf2总蛋白、p-Nrf2蛋白、Nrf2核蛋白及HO-1蛋白的水平上调(P<0.05)。C组、W组和D组之间上述指标差异无统计学显著性。与L组比较,WL组HSK、BUN、Cr、α1-MG及MDA含量升高,SOD活性降低,肾组织Nrf2和HO-1的mRNA、p-Akt蛋白、Nrf2总蛋白、p-Nrf2蛋白、Nrf2核蛋白及HO-1蛋白的水平降低(P<0.05)。结论: PI3K/Nrf2通路激活是内毒素休克诱发兔急性肾损伤时机体的适应性调节反应机制之一。
[关键词]磷脂酰肌醇3-激酶;核因子E2相关因子2; 内毒素休克; 急性肾损伤
肾脏是内毒素休克最容易累及的器官之一,其机制不明,治疗棘手。研究表明[1],内毒素血症并发急性肾衰竭的病死率可高达74.5%。因而,探明内毒素休克肾损伤的机制,对预防和减轻急性肾损伤以改善内毒素休克预后有着十分重要的临床意义。核因子E2相关因子2/抗氧化反应元件(nuclear factor E2-related factor 2/antioxidant response element,Nrf2/ARE)是体内重要的防御性信号转导通路。我们前期研究已经证实,ARE其中重要之一的血红素加氧酶1(heme oxygenase-1,HO-1)可以减轻内毒素休克肾脏损伤[2]。本研究旨在评价其上游信号通路磷脂酰肌醇3-激酶(phosphatidylinositol 3-kinase,PI3K)/Nrf2在内毒素休克兔急性肾损伤中的作用,为内毒素休克肾损伤的防治提供理论基础和新思路。
材料和方法
1主要试剂与仪器
脂多糖(lipopolysaccharide,LPS)购自Sigma;渥曼青霉素(wortmannin)购自Selleck;总RNA提取试剂盒和real-time PCR试剂盒(北京天根生化科技有限公司);核蛋白及总蛋白提取试剂盒(Thermo);山羊抗兔lgG抗体(北京康为世纪生物科技有限公司); 抗兔HO-1多克隆抗体(Abcam );兔Nrf2多克隆抗体(Biorbyt); p-Akt(Ser470)抗体(博奥森公司);β-actin抗体(CST);丙二醛(malondialdehyde,MDA)含量测定试剂盒和超氧化物歧化酶(super-oxide dismutase,SOD)活性测定试剂盒(南京建成生物工程研究所)。BX51光学显微镜和荧光显微镜(Olympus);多功能酶标仪(BioTek);Quantity One凝胶成像分析系统(Bio-Rad);LineGene 9620实时定量PCR仪(杭州博日科技有限公司)。
2实验动物与分组
健康清洁级雄性新西兰大白兔50只,2月龄,体重1.5~2.0 kg。由天津市中国医学科学院生物工程研究所提供[许可证号:SCXK(京)2011-0008]。室温18~22 ℃,安静环境常规饲养,适应环境1周,实验前禁食24 h,自由饮水。采取随机数字表法,将其分为5组(n=10):对照(control,C)组、内毒素休克模型组(L组)、渥曼青霉素+内毒素休克组(WL组)、渥曼青霉素组(W组)和二甲基亚砜(dimthyl sulfoxide,DMSO)组(D组)。
3主要方法
3.1内毒素休克模型制备实验兔经耳缘静脉注射20%乌拉坦5 mL/kg麻醉后,仰卧固定于兔台上。耳缘静脉置管建立静脉输液通路。颈部备皮消毒,1%利多卡因局麻,剪开颈部正中皮肤,分离气管和左侧颈内动脉。行气管插管及左侧颈内动脉置管,保留自主呼吸,连续监测动脉血压。血压稳定后30 min,W组和WL组经耳缘静脉注射wortmannin 0.6 mg/kg(溶剂为DMSO 0.08 mL/kg),D组注射DMSO 0.08 mL/kg,C组和L组各注射等容量生理盐水。30 min后,L组和WL组静脉注射LPS 5 mg/kg(溶于2 mL生理盐水),C组、W组及D组注射等容量生理盐水。排除给予LPS 后2 h 内平均动脉压(mean arterial pressure,MAP)未下降到基础值75%及以下或给予LPS 后6 h 内死亡的动物,并予补充。
3.2标本采集与贮存静脉注射LPS或生理盐水后6 h经心脏采血5 mL,3 000 r/min 4 ℃离心15 min。取膀胱尿液3 mL。采用全自动生化分析仪测定血尿素氮(blood urea nitrogen,BUN)、肌酐(creatinine,Cr)浓度和尿α1-微球蛋白(α1-microglobulin,α1-MG)浓度。放血处死兔,留取双肾,4 ℃磷酸盐缓冲盐水冲洗肾组织表面,右肾组织用4%甲醛溶液固定,左肾组织液氮罐速冻后保存于-80 ℃低温冰箱。
3.3肾组织病理观察与损伤评分取4%甲醛固定的右肾组织,石蜡包埋、切片(厚5 μm)、HE 染色。参照文献[3-4]介绍的方法,每张切片随机选取10个视野于光学显微镜下观察(×200),进行肾组织损伤评分。肾组织损伤评分标准:(1)近曲小管改变:小管上皮扇贝样改变,伴有细胞刷状缘着色斑片状脱失为1分;上皮细胞肿胀或增厚,伴有刷状缘着色部分脱失为2分;上皮细胞显著肿胀或有空泡形成,刷状缘着色脱失>50%为3分。(2)小管扩张和上皮增厚: <25%为1分;25%~50%为2分;>50%为3分。(3)小管坏死/细胞碎裂: <25%为1分; 25%~50%为2分;>50% 为3分。(4)小管上皮/基底膜剥离:偶发为1分;片状(尤其在肾髓质)为2分; 肾髓质和皮质多发为3分。(5)小管上皮细胞凋亡: <10%为1分;10%~50%为2分;>50% 为3分。
3.4肾组织MDA含量及SOD活性的测定取-80 ℃中保存的左肾组织制备肾组织匀浆,采用黄嘌呤氧化酶法测定SOD活性,采用硫代巴比妥酸法测定MDA含量。
3.5实时荧光定量PCR法测定HO-1及Nrf2的mRNA表达水平按照总RNA提取试剂盒的操作步骤提取肾组织总RNA,用分光光度法测定其浓度及纯度,逆转录合成cDNA,以其为模板进行实时荧光定量PCR。采用Primer Premier 5.0引物设计软件,根据NCBI公布的兔基因序列设计引物,通过NCBI中的BLAST功能,检测引物的特异性。HO-1的上游引物为5’-GTCTACGCCCCGCTCTACTTCCCG-3’,下游引物为5’-TAGCCTCTTCCACCACCCTCTGCC-3’,产物片段长度为394 bp;Nrf2上游引物为5’-TTAGTGCTTTTGAGGATTCTTTCGG-3’,下游引物为5’ -AATTCTGTGCTTTCAGGGTGGTTCT-3’,产物片段长度为262 bp;β-actin上游引物为5’-AAACGAGACGAGATTGGCATGGCTTTA-3’,下游引物为5’-GGGATGCTCGCTCCAACGACTGCT-3’,产物片段长度为143 bp。PCR反应体系为QuantiTectTMSYBR Green PCR Mix 10 μL,上游引物1.0 μL,下游引物1.0 μL,cDNA模板2.0 μL,RNase-free ddH2O 6.0 μL;反应条件为95 ℃ 10 min;95 ℃ 20 s,60 ℃ 30 s,共40个循环。采用荧光定量PCR仪测定β-actin、HO-1及Nrf2的Ct值,采用SDS软件以2-ΔΔCt法相对定量分析HO-1和Nrf2 的mRNA表达水平[5]。
3.6Western blot法测定肾组织HO-1蛋白、总Nrf2蛋白、p-Nrf2蛋白、核Nrf2蛋白、总Akt蛋白及p-Akt的蛋白水平取-80 ℃保存的左肾组织,按说明提取组织总蛋白及核蛋白,离心取上清液进行蛋白定量,取80 μg蛋白加入5×SDS上样缓冲液,95 ℃变性10 min,经10% SDS-PAGE分离蛋白,转膜30 min,封闭2 h后,加入兔HO-1多克隆抗体(1∶1 000)、Nrf2多克隆抗体(1∶1 000)和Akt多克隆抗体(1∶1 000),4 ℃孵育过夜,TBST漂洗3次后加入辣根过氧化物酶标记的山羊抗兔lgG抗体(1∶3 000),室温避光摇床孵育1 h后漂洗。于暗室中用增强化学发光液进行显色与曝光,采用Quantity One凝胶成像分析系统进行扫描,以目的蛋白与内参照β-actin条带积分吸光度值的比值反映目的蛋白的表达水平。
4统计学处理
采用SPSS 18.0统计学软件进行分析,正态分布的计量资料以均数±标准差(mean±SD)表示,组间比较采用单因素方差分析,组间两两比较采用SNK-q检验,以P<0.05为差异有统计学意义。
结果
1血BUN、Cr及尿α1-MG浓度
与C组比较,L组和WL组血Cr、BUN及尿α1-MG浓度升高(P<0.05);W组和D组上述指标无统计学差异。与L组比较,WL组血Cr、BUN及尿α1-MG浓度升高(P<0.05),见表1。
表1各组兔血肌酐、尿素氮及尿α1-MG浓度
Table 1.The concentrations of blood urea nitrogen (BUN), creatinine (Cr) and urinary α1-microglobulin (α1-MG) in each group (Mean±SD.n=10)
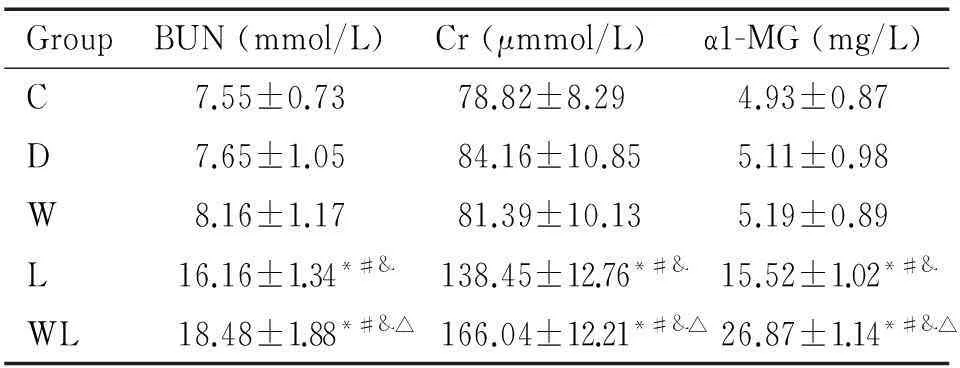
GroupBUN(mmol/L)Cr(μmmol/L)α1-MG(mg/L)C7.55±0.7378.82±8.294.93±0.87D7.65±1.0584.16±10.855.11±0.98W8.16±1.1781.39±10.135.19±0.89L16.16±1.34*#&138.45±12.76*#&15.52±1.02*#&WL18.48±1.88*#&△166.04±12.21*#&△26.87±1.14*#&△
*P<0.05vsgroup C;#P<0.05vsgroup D;&P<0.05vsgroup W;△P<0.05vsgroup L.
2肾组织HSK、MDA含量及SOD活性
与C组比较,L组和WL组肾组织的HSK和MDA含量升高,SOD活性降低(P<0.05);W组和D组上述指标差异无统计学意义。与L组比较,WL组肾组织的HSK和MDA含量升高,SOD活性降低(P<0.05),见表2。
表2肾组织损伤评分、肾组织丙二醛含量及超氧化物歧化酶活性的观察
Table 2.The changes of histological scores, MDA content and SOD activity of the kidney (Mean±SD.n=10)
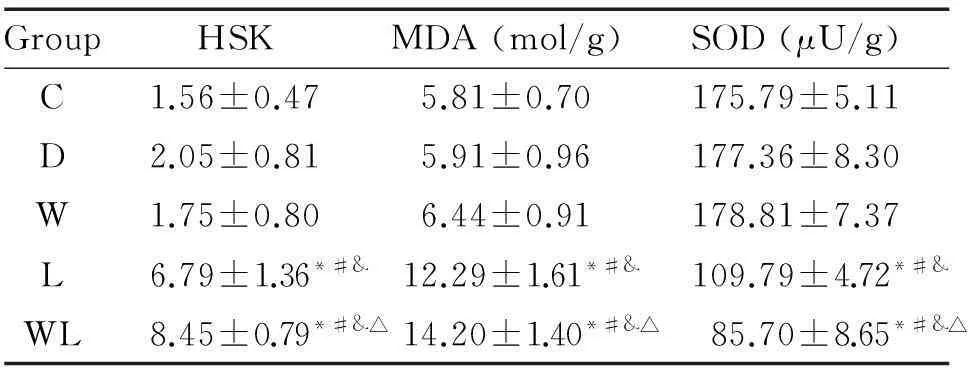
GroupHSKMDA(mol/g)SOD(μU/g)C1.56±0.475.81±0.70175.79±5.11D2.05±0.815.91±0.96177.36±8.30W1.75±0.806.44±0.91178.81±7.37L6.79±1.36*#&12.29±1.61*#&109.79±4.72*#&WL8.45±0.79*#&△14.20±1.40*#&△85.70±8.65*#&△
*P<0.05vsgroup C;#P<0.05vsgroup D;&P<0.05vsgroup W;△P<0.05vsgroup L.
3Real-time PCR结果
与C组比较,L组和WL组肾组织Nrf2及HO-1的mRNA表达上调(P<0.05);D组和W组上述指标间差异无统计学意义。与L组比较,WL组肾组织Nrf2及HO-1的mRNA表达下调(P<0.05),见表3。
表3肾组织Nrf2及HO-1的mRNA表达水平
Table 3.The mRNA expression of HO-1 and Nrf2 in the renal tissues (Mean±SD.n=10)

GroupNrf2mRNAHO-1mRNAC1.00±0.041.00±0.05D0.98±0.070.96±0.05W1.02±0.090.99±0.09L3.04±0.14*#&3.10±0.12*#&WL2.08±0.90*#&△1.90±0.07*#&△
*P<0.05vsgroup C;#P<0.05vsgroup D;&P<0.05vsgroup W;△P<0.05vsgroup L.
4Western blot结果
与C组比较,L组和WL组肾组织的p-Akt蛋白、总Nrf2蛋白、p-Nrf2蛋白、核Nrf2蛋白及HO-1蛋白水平上升(P<0.05);D组和W组上述指标无统计学差异。与L组比较,WL组的p-Akt蛋白、总Nrf2蛋白、p-Nrf2蛋白、核Nrf2蛋白及HO-1蛋白水平下降(P<0.05),见图1,表4和表5。

Figure 1.The protein levels of HO-1, total Nrf2, p-Nrf2, nu-clear Nrf2, total Akt and p-Akt in the renal tissues determined by Western blot.
图1肾组织HO-1、总Nrf2、p-Nrf2、核Nrf2、总Akt及p-Akt蛋白水平的检测
表4肾组织总Akt、p-Akt及HO-1蛋白水平的观察
Table 4.The protein levels of total Akt, p-Akt and HO-1 in the renal tissues (Mean±SD.n=10)

GroupTotalAktproteinp-AktproteinHO-1proteinC0.56±0.030.31±0.040.34±0.07D0.56±0.060.32±0.060.36±0.04W0.54±0.040.32±0.040.36±0.08L0.57±0.050.50±0.09*#&0.56±0.07*#&WL0.55±0.030.42±0.04*#&△0.45±0.10*#&△
*P<0.05vsgroup C;#P<0.05vsgroup D;&P<0.05vsgroup W;△P<0.05vsgroup L.
表5肾组织总Nrf2、p-Nrf2及核Nrf2蛋白水平的观察
Table 5.The protein levels of total Nrf2, p-Nrf2 and nuclear Nrf2 in the renal tissues (Mean±SD.n=10)

GroupTotalNrf2proteinp-Nrf2proteinNuclearNrf2proteinC0.43±0.030.36±0.050.34±0.04D0.46±0.040.36±0.040.35±0.08W0.47±0.040.38±0.040.36±0.06L0.71±0.07*#&0.62±0.06#&0.61±0.07*#&WL0.59±0.09*#&△0.53±0.04*#&0.51±0.08*#&△
*P<0.05vsgroup C;#P<0.05vsgroup D;&P<0.05vsgroup W;△P<0.05vsgroup L.
讨论
脓毒症是由病原微生物入侵机体后引起的全身炎症反应综合征,可进展为脓毒性休克和多器官功能障碍综合征,其中肾脏是易受攻击的靶器官之一。研究认为[6],肾脏有效灌注不足,内毒素含量增高,凝血机制失调及细胞凋亡等机制参与了脓毒症所致肾损伤,其中内毒素是引起脓毒症急性肾损伤过程的重要介质。内毒素可通过TLR4激活NF-κB信号通路,启动炎症级联放大反应,增加核内细胞因子和炎症介质的基因表达,释放大量炎症因子(TNF-α、内皮素1等),作用于肾脏的系膜细胞及免疫细胞系统,引起器官组织血流低灌注、强烈的炎症反应以及氧自由基损伤等,造成肾脏功能损伤[7]。内毒素休克模型是实验室常用模型,本实验参照文献[8]中介绍的方法经耳缘静脉注射LPS 5 mg/kg制备兔内毒素休克模型,以给予LPS 2 h内MAP下降至基础值的75%及以下为内毒素休克模型制备成功的标准。本实验中,L组和WL 组给予LPS后2 h内,MAP均下降至基础值的75%及以下,且肾组织损伤评分升高、血BUN、Cr、尿α1-MG浓度及肾组织MDA含量升高,提示内毒素休克诱发兔急性肾损伤模型制备成功。
Wortmannin是非ATP竞争型PI3K抑制剂,可与PI3K的110 kD催化亚基结合,特异性抑制PI3K,从而抑制PI3K/Akt信号通路[9]。文献报道[10]使用wortmannin 0.6 mg/kg可成功阻断兔心肌细胞PI3K/Akt信号通路,且无死亡及急性毒性反应,结合预实验结果,本实验采用wortmannin 0.6 mg/kg作为实验剂量。结果显示,与C组比较,W组及D组血清BUN、血清Cr、尿α1-MG浓度及肾组织MDA含量均无显著差异,可以排除实验剂量wortmannin及DMSO对肾损伤的影响。
PI3K是存在于体内多种细胞的一种脂激酶。Akt又称蛋白激酶B(protein kinase B,PKB),是PI3K信号传导途径中一个重要的下游靶激酶。细胞内外刺激可通过酪氨酸蛋白激酶激活PI3K生成PIP3,与Akt结合并暴露其活性位点,在磷脂酰肌醇依赖型蛋白激酶催化和辅助下, Akt上Ser 473和(或)Thr 308位点磷酸化而被激活。活化的Akt可引起下游磷酸化级联反应和靶蛋白之间的相互作用,调控细胞增殖与凋亡、生长与存活等一系列生物学效应[11-12]。Nrf2是CNC(cap′n′collar)家族中活力最强的转录调节因子。生理状态下,Nrf2以Keap-1-Nrf2异二聚体的形式存在于细胞质中,以Keap-1介导的蛋白酶体泛素化反应的方式降解,处于低浓度非活性状态;在氧化应激状态下,Keap-1构象改变,或者Nrf2磷酸化,Nrf2从胞浆蛋白Keap-1中解离,易位至细胞核与抗氧化基因启动子区域的ARE结合,激活下游的抗氧化蛋白如SOD、HO-1及过氧化氢酶(catalase,CAT)等的活性表达,维持机体氧化还原稳态[13]。Nrf2的活化受蛋白磷酸化的调控,目前认为,丝裂原活化蛋白激酶(mitogen-activated protein kinases,MAPK)、PI3K、蛋白激酶C(protein kinase C,PKC)等信号通路分子广泛参与了Nrf2的活化和核转位过程, 诱导Nrf2核转位的信号通路类型与诱导剂及细胞种类等因素相关[14]。PI3K可通过调整肌动蛋白微丝的排列,调节肌动蛋白解聚,导致Nrf2与Keap-1复合体解体,增加Nrf2核转位[15]。
本研究结果显示,给予内毒素后肾组织Nrf2和HO-1的mRNA表达上调, p-Akt、总Nrf2蛋白、p-Nrf2、核Nrf2蛋白及HO-1蛋白水平增加,SOD活性增强,表明内毒素作用下,PI3K/Akt-Nrf2通路激活,抗氧化蛋白表达增加,机体抗氧化损伤能力增强。内毒素休克兔给予PI3K特异性阻断剂wrotmannin后,肾组织Nrf2及HO-1的mRNA表达下调,p-Akt、总Nrf2蛋白、核Nrf2蛋白及HO-1蛋白水平减少,SOD活性减弱,表明抑制PI3K/Akt后,Nrf2及其下游蛋白表达减少,机体抗氧化损伤能力下降,内毒素休克所致肾损伤加重。但抑制PI3K/Akt后,肾组织Nrf2/ARE通路相关蛋白表达并未完全阻断,表明肾组织Nrf2/ARE通路的激活可能存在除PI3K以外的其它调控因素。关于PI3K以外相关信号通路调控肾组织Nrf2/ARE通路的具体机制有待进一步研究。
综上所述,PI3K/Nrf2通路激活是兔内毒素休克诱发急性肾损伤时机体的适应性调节反应机制之一。
[参考文献]
[1]Van Biesen W, Van Massenhove J, Lameire N, et al. Does urinary neutrophil gelatinase-associated lipocalin really solve the issue of discriminating prerenal from intrinsic acute kidney injury?[J]. Kidney Int, 2012, 81(3):321.
[2]Yu JB, Zhou F, Yao SL, et al. Effect of heme oxygenase-1 on the kidney during septic shock in rats[J]. Transl Res, 2009, 153(6):283-287.
[3]胡菁梦,刘宏宝,王强,等. 重复电针刺激肾腧穴预处理对大鼠肾缺血再灌注损伤的影响[J]. 中华麻醉学杂志, 2012 , 32 (8):1002-1005.
[4]Blydt-Hansen TD, Katori M, Lassman C, et al. Gene transfer-induced local heme oxygenase-1 overexpression protects rat kidney transplants from ischemia/ reperfusion injury [J]. J Am Soc Nephrol, 2003, 14(3):745-754.
[5]Schmittgen TD, Livak KJ. Analyzing real-time PCR data by the comparativeCTmethod[J]. Nat Protoc, 2008, 3(6): 1101-1108.
[6]周树根,吴俭. 小儿脓毒症致急性肾损伤发病机制的研究进展[J]. 南昌大学学报:医学版, 2014, 54(7):96-99.
[7]Hoshino K, Takeuchi O, Kawai T, et al. Cutting edge: Toll-like receptor 4 (TLR4)-deficient mice are hyporesponsive to lipopolysaccharide: evidence for TLR4 as the Lps gene product[J]. J Immunol, 1999, 162(7):3749-3752.
[8]Yu JB, Dong SA, Luo XQ, et al. Role of HO-1 in protective effect of electro-acupuncture against endotoxin shock-induced acute lung injury in rabbits[J]. Exp Biol Med (Maywood), 2013, 238(6):705-712.
[9]Walker EH, Pacold ME, Perisic O, et al. Structural determinants of phosphoinositide 3-kinase inhibition by wortmannin, LY294002, quercetin, myricetin, and staurospo-rine[J]. Mol Cell, 2000, 6(4):909-911.
[10]刘国利, 张锦英, 沈图. 异氟醚后处理对兔心肌缺血-再灌注损伤的影响[J]. 临床麻醉学杂志, 2011, 27(11):1116-1118.
[11]Foster FM, Traer CJ, Abraham SM, et al. The phosphoinositide (PI) 3-kinase family[J].J Cell Sci, 2003, 116(Pt 15):3037-3040.
[12]Eisenreich A, Rauch U. PI3K inhibitors in cardiovascular disease [J]. Cardiovasc Ther, 2011, 29(1):29-36.
[13]Piao MS, Park JJ, Choi JY, et al. Nrf2-dependent and Nrf2-independent induction of phase 2 detoxifying and antioxidant enzymes during keratinocyte differentiation[J]. Arch Dermatol Res, 2012, 304(5):387-395.
[14]Shen G, Jeong WS, Hu R, et al. Regulation of Nrf2,NF-κB,and AP-1 signaling pathways by chemopreentive agents[J]. Antioxid Redox Signal, 2005, 7(11-12): 1648-1663.
[15]Kang KW, Lee SJ, Park JW, et al. Phosphatidylinositol 3-kinase regulates nuclear translocation of NF-E2-related factor 2 through actin rearrangement in response to oxidative stress[J]. Mol Pharmacol, 2002, 62(5):1001-1010.
(责任编辑: 林白霜, 罗森)
Role of PI3K/Nrf2 signaling pathway in endotoxin-induced acute kidney injury in rabbits
CHEN Mu-lin1, 2, YU Jian-bo1, GONG Li-rong1, SHI Jia1
(1DepartmentofAnesthesiology,TianjinNankaiHospital,NankaiClinicalCollegeofTianjinMedicalUniversity,Tianjin300310,China;2DepartmentofAnesthesiology,TianjinXiqingHospital,Tianjin300380,China.E-mail:jianboyu99@sina.com)
[ABSTRACT]AIM: To evaluate the role of phosphatidylinositol 3-kinase/nuclear factor E2-related factor 2 (PI3K/Nrf2) signaling pathway in endotoxin-induced acute kidney injury in rabbits. METHODS: Healthy male New Zealand white rabbits were randomly divided into 5 groups: control group (group C), LPS group (group L), wortmannin+LPS group (group WL), wortmannin group (group W) and dimthyl sulfoxide (DMSO) group (group D). Wortmannin at dose of 0.6 mg/kg was injected via the auricular vein in groups W and WL, DMSO at concentration of 0.08 mL/kg was injected in group D, while normal saline (0.08 mL/kg) was injected in groups C and L. LPS at dose of 5 mg/kg was injected via the auricular vein in groups L and WL 30 min later, and equal volume of normal saline was injected in group C, D and W for control. The rabbits were sacrificed 6 h after LPS or normal saline administration. The kidneys were removed for microscopic examination and the determination of histological scores of kidney (HSK). The concentrations of blood urea nitrogen (BUN) and creatinine (Cr), urinary α1-microglobulin (α1-MG), MDA content, SOD activity, the mRNA expression of Nrf2 and HO-1, and the protein levels of total Akt, p-Akt, total Nrf2, p-Nrf2, nuclear Nrf2 and HO-1 in the renal tissues were also detected. RESULTS: Compared with groups C, D and W, the concentrations of BUN and Cr, urinary α1-MG concentration, MDA content and HSK were significantly increased, while SOD activity was significantly decreased (P<0.05). The mRNA expression of Nrf2 and HO-1, and the protein levels of p-Akt, total Nrf2, p-Nrf2, nuclear Nrf2 and HO-1 in the renal tissues were significantly increased in groups L and WL. No significant change among groups C, D and W was observed. Compared with group L, the concentrations of BUN and Cr, urinary α1-MG concentration, MDA content and HSK were significantly increased, while SOD activity, the mRNA expression of Nrf2 and HO-1, and the protein levels of p-Akt, total Nrf2, p-Nrf2, nuclear Nrf2 and HO-1 in the renal tissues were significantly decreased in group WL. CONCLUSION: Activation of PI3K/Nrf2 signaling pathway may be one of the regulatory mechanisms of the body adapting to the endotoxin-induced acute kidney injury in rabbits.
[KEY WORDS]Phosphatidylinositol 3-kinase; Nuclear factor E2-related factor 2; Endotoxic shock; Acute kidney injury
[文章编号]1000- 4718(2016)01- 0129- 05
[收稿日期]2015- 03- 11[修回日期] 2015- 10- 22
*[基金项目]国家自然科学基金资助项目(No. 81372096)
通讯作者△Tel: 022-27435289; E-mail: jianboyu99@sina.com
[中图分类号]R363.2; R515.3
[文献标志码]A
doi:10.3969/j.issn.1000- 4718.2016.01.022

