EGCG通过调控SIRT1-P53通路诱导人卵巢癌SKOV-3细胞凋亡*
尤慧敏, 康祥锦, 杨 洁, 林燕珊, 刘见桥, 杜红姿
(广州医科大学附属第三医院生殖医学中心,广东省生殖医学重点实验室,广东省产科重大疾病重点实验室,广东省普通高校生殖与遗传重点实验室, 广东 广州 510150)
EGCG通过调控SIRT1-P53通路诱导人卵巢癌SKOV-3细胞凋亡*
尤慧敏,康祥锦,杨洁,林燕珊,刘见桥,杜红姿△
(广州医科大学附属第三医院生殖医学中心,广东省生殖医学重点实验室,广东省产科重大疾病重点实验室,广东省普通高校生殖与遗传重点实验室, 广东 广州 510150)
[摘要]目的: 研究表没食子儿茶素没食子酸酯(epigallocatechin gallate,EGCG)调控人卵巢癌SKOV-3细胞活力和凋亡的分子机制。方法: SKOV-3细胞给予EGCG(0~50 μmol/L)、SIRT1激动剂SRT1720(1 μmol/L)和SIRT1抑制剂EX527(1 μmol/L)处理后,用CCK-8法检测细胞活力,流式细胞术检测细胞凋亡,real-time PCR检测Bax和Bcl-2 mRNA的表达水平;采用SIRT1去乙酰化酶活性检测试剂盒检测SIRT1酶活性;使用Western blot法检测SIRT1、乙酰化P53和P53的蛋白表达变化。结果: 与正常对照组相比,单独给予EGCG或EX527处理之后SKOV-3细胞活力下降,凋亡率增加;SIRT1的酶活性和蛋白表达水平均明显下降;P53的乙酰化水平显著增加。与EGCG组相比,SRT1720预处理组的细胞活力上升,凋亡率下降,Bax/Bcl-2的相对比值及激活型caspase-3的蛋白水平明显下降,并且SIRT1的酶活性和蛋白表达水平显著增加,P53的乙酰化水平下降。结论: EGCG可通过调控SIRT1-P53通路抑制卵巢癌SKOV-3细胞活力并诱导其凋亡。
[关键词]表没食子儿茶素没食子酸酯; SKOV-3细胞; 细胞凋亡; SIRT1-P53通路
卵巢癌是妇科常见肿瘤之一,其死亡率高居女性生殖系统恶性肿瘤榜首,且呈逐年上升趋势。因为卵巢癌缺乏早期症状和早期诊断的检测手段,往往在首次确诊时,病灶已扩散至卵巢外。目前采用手术治疗虽可以起到较好的疗效,但通常会在短时间内复发和转移[1]。除手术治疗外,临床上主要使用以铂类和紫杉醇为基础的联合化疗方案,可延长患者的生存时间,提高生活质量。然而由于化疗的耐药时常发生,并且这种治疗方法存在神经系统、骨髓抑制等严重不良反应,许多患者难以承受,长期生存率未获改变[2-3]。因此,寻找新型高效、低毒的化疗药物是目前卵巢癌研究的主要方向之一。
天然产物大多具有低毒的特点。近年来研究发现,很多天然植物分离提取物具有抑制肿瘤细胞增殖的作用,一些已进入临床试验阶段,其中表没食子儿茶素没食子酸酯(epigallocatechin gallate,EGCG)是目前研究较多的一个[4]。EGCG是绿茶茶多酚的主要成份,具有抗氧化、清除自由基等多种生物活性[5]。研究表明,EGCG对包括卵巢癌在内的多种肿瘤细胞均有明显的抑制作用,有望成为新型的抗肿瘤化疗药物[5-6]。然而,到目前为止,EGCG调控卵巢癌细胞增殖与凋亡的具体分子机制并不十分清楚。本实验使用卵巢癌细胞株SKOV-3作为研究对象,通过观察不同浓度EGCG对SKOV-3细胞SIRT1-P53通路的调控作用,初步探讨EGCG抑制卵巢癌的分子机制,为进一步将EGCG应用于卵巢癌临床治疗提供实验依据。
材料和方法
1主要试剂和药品
人卵巢癌细胞株SKOV-3购自上海中科院细胞研究所;高糖培养基DMEM和新生牛血清分别购自Gibco;EGCG(纯度>98%)购自Sigma,用超纯水配成100 mmol/L,-20 ℃避光保存;CCK-8试剂盒购自日本Dojindo;细胞凋亡Annexin V-FITC荧光检测试剂盒购自南京凯基生物科技发展有限公司;SIRT1去乙酰化酶活性检测试剂盒购自Cycle;SIRT1兔多抗、cleaved caspase-3兔多抗和乙酰化P53 (acetyla-ted P53,Ac-P53)兔多抗购自CST;β-actin小鼠单抗、P53小鼠单抗、辣根过氧化物酶标记的羊抗鼠和羊抗兔II抗为Santa Cruz产品;SIRT1激动剂SRT1720和抑制剂EX527均购自Selleck,用DMSO配成1 mmol/L,-20 ℃避光保存。各目的基因及内参引物以Primer Premier 5.0 软件设计,由上海生工生物工程技术服务有限公司合成,具体序列见表1。

表1 引物序列
2主要方法
2.1细胞培养与处理人卵巢癌细胞株SKOV-3使用含10%新生牛血清的DMEM 高糖培养基培养。将细胞根据实验要求接种至不同规格的培养板中,待细胞贴壁后血清饥饿12 h,随后加入指定浓度的EGCG(0~50 μmol/L)、SIRT1激动剂SRT1720(1 μmol/L)或SIRT1抑制剂EX527(1 μmol/L)培养预定时间,培养结束后进行后续实验。
2.2SIRT1去乙酰化酶活性检测接种细胞至60 mm培养皿中,按照实验要求加入EGCG、SIRT1激动剂SRT1720或SIRT1抑制剂EX527处理细胞,给药结束后检测SIRT1酶活性。检测步骤按照SIRT1去乙酰化酶活性测定试剂盒说明书进行。弃培养基,PBS洗3次,裂解液冰上裂解5~10 min,超声处理15 s,4 ℃ 14 000×g离心10 min,取上清。加入1 μg SIRT1抗体,4 ℃慢摇2 h,加入15 μL Protein G琼脂糖微球,4 ℃摇摆过夜,4 ℃ 14 000×g离心30 s,弃上清,用裂解液洗涤沉淀,按照说明书要求配制去乙酰化酶反应体系,充分混匀后加入避光的96孔板中,采用Tecan多功能酶标仪检测荧光强度[激发光波长为(490±10) nm;发射光波长为(530±10) nm]。
2.3Western blot检测蛋白表达细胞无血清处理之后,按照实验要求加入EGCG、SIRT1激动剂SRT1720或SIRT1抑制剂EX527处理细胞,给药结束后,弃培养基,加入RIPA裂解液提取总蛋白,依次进行聚丙烯酰胺凝胶电泳、电转、封闭,4 ℃孵育I抗过夜,室温孵育II抗1 h,并采用化学发光法检测蛋白表达情况,使用ImageJ软件进行条带灰度分析。
2.4CCK-8法检测细胞活力接种SKOV-3细胞于96孔板,血清饥饿完成之后,按照实验要求加入EGCG、SIRT1激动剂SRT1720或SIRT1抑制剂EX527处理细胞,每组设6个平行孔。处理结束后,每孔加入10 μL CCK-8试剂,继续在CO2培养箱内孵育1 h,450 nm波长处检测吸光度值A,并计算细胞增殖。细胞活力(%)=实验组A450/对照组A450×100%。
2.5流式细胞术检测细胞凋亡接种SKOV-3细胞至60 mm平皿中,按照实验要求加入EGCG、SIRT1激动剂SRT1720或SIRT1抑制剂EX527处理细胞,处理完成后,弃培养基。收集细胞并计数,按照Annexin V/PI双染流式细胞检测试剂盒说明书对SKOV-3细胞进行染色后,上机检测,分析细胞凋亡率。
2.6Real-time PCR检测mRNA的表达按照实验要求加入EGCG、SIRT1激动剂SRT1720或SIRT1抑制剂EX527处理细胞,给药结束后,使用TRIzol 试剂(Invitrogen)从SKOV-3细胞中提取总RNA,将RNA 逆转录成cDNA,采用能与双链DNA 结合便可发出荧光的荧光染料SYBR Green(TaKaRa)进行PCR 扩增,通过检测PCR 反应中荧光信号强度,对目的基因进行准确定量。以GAPDH 为内参照。
3统计学处理
使用SPSS 13.0 软件进行统计学分析,各组数据以均值±标准差(mean±SD)表示,采用单因素方差分析(one-way ANOVA)进行多组间分析,各组数据间两两比较采用Bonferroni校正的t检验,以P<0.05为差异有统计学意义。
结果
1EGCG对人卵巢癌SKOV-3细胞株SIRT1-P53通路的影响
不同浓度EGCG(0、12.5、25和50 μmol/L)处理SKOV-3细胞24 h后,采用SIRT1去乙酰化酶活性检测试剂盒检测细胞中SIRT1的去乙酰化酶活性,利用Western blot实验检测SIRT1、Ac-P53和P53的蛋白水平。结果显示,随着EGCG浓度增加,SIRT1的去乙酰化酶活性和蛋白表达显著下降(P<0.05),并且P53的乙酰化水平显著增加(P<0.05),见图1。

Figure 1.The effect of EGCG on SIRT1-P53 signaling pathways in ovarian cancer cell line SKOV-3. SKOV-3 cells were treated with various concentrations (0~50 μmol/L) of EGCG for 24 h. A: SIRT1 deacetylase activity was measured by SIRT1 deacetylase fluorometric assay kit; B: the protein levels of SIRT1, Ac-P53 and P53 were examined by Western blot. Mean±SD.n=3.*P<0.05vs0 μmol/L.
图1EGCG 对卵巢癌SKOV-3细胞SIRT1-P53通路的影响
2EGCG通过抑制SIRT1诱导人卵巢癌SKOV-3细胞凋亡
为了明确SIRT1在EGCG诱导SKOV-3细胞凋亡中的作用,SKOV-3细胞单独给予SIRT1抑制剂EX527处理,或使用SIRT1的激动剂SRT1720(1 μmol/L)预处理SKOV-3细胞之后,再给予EGCG(50 μmol/L)处理24 h,采用CCK-8法检测SKOV-3细胞活力,并使用流式细胞仪检测细胞凋亡。结果显示,在SKOV-3细胞中给予SRT1720预处理之后,EGCG抑制细胞活力和诱导细胞凋亡的作用被取消(P<0.05)。而单独给予EX527处理能够模拟EGCG的作用,从而抑制SKOV-3的细胞活力,并诱导凋亡,见图2。
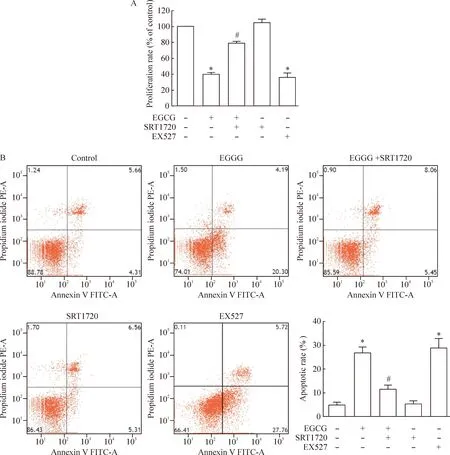
Figure 2.SIRT1 participated in the effect of EGCG on the activity and apoptosis of ovarian cancer cell line SKOV-3. SKOV-3 cells were treated with 1 μmol/L EX527 or pretreated with 1 μmol/L SRT1720 for 1 h followed by stimulation with EGCG (50 μmol/L) for 24 h. A: cell viability was measured by CCK-8 assay; B: apoptosis was assessed by flow cytometric analysis. Mean±SD.n=3.*P<0.05vscontrol group;#P<0.05vsEGCG group.
图2SIRT1参与了EGCG对人卵巢癌细胞SKOV-3活力和凋亡的调控
3SIRT1参与了EGCG对SKOV-3细胞凋亡相关基因的影响
为了进一步明确SIRT1在EGCG诱导SKOV-3细胞凋亡中的作用,SKOV-3细胞单独给予SIRT1抑制剂EX527处理,或给予SRT1720预处理细胞1 h后,再给予EGCG(50 μmol/L)处理24 h,并分别采用real-time PCR和Western blot的方法检测凋亡相关基因Bax、Bcl-2和cleaved caspase-3的水平。结果表明EGCG可显著增加Bax的mRNA表达,降低Bcl-2的mRNA表达,Bax/Bcl-2的比值明显增加(P<0.05),并且cleaved caspase-3的蛋白水平显著上升(P<0.05)。而SRT1720预处理可逆转EGCG对Bax、Bcl-2以及cleaved caspase-3水平的影响(P<0.05)。单独给予EX527处理能够模拟EGCG的作用,增加Bax/Bcl-2的比值和cleaved caspase-3的蛋白水平,见图3。
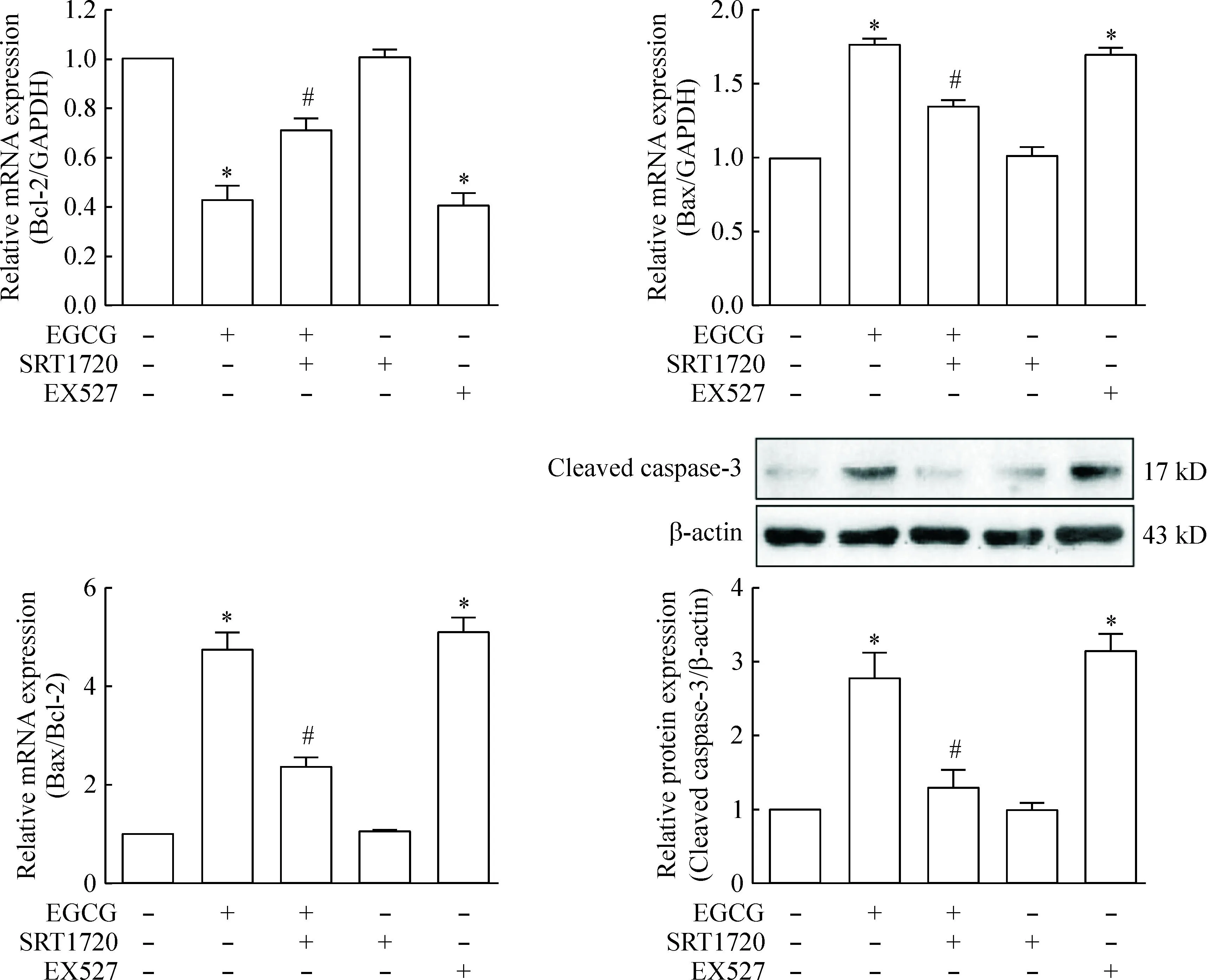
Figure 3.SIRT1 participated in the effect of EGCG on the expression of apoptosis-related genes in ovarian cancer cell line SKOV-3. SKOV-3 cells were treated with 1 μmol/L EX527 or pretreated with 1 μmol/L SRT1720 for 1 h followed by stimulation with EGCG (50 μmol/L) for 24 h. Mean±SD.n=3.*P<0.05vscontrol group;#P<0.05vsEGCG group.
图3SIRT1参与了EGCG对人卵巢癌细胞SKOV-3凋亡相关基因表达的调控
4EGCG通过抑制SIRT1调控P53的乙酰化水平
为了进一步研究EGCG调控SKOV-3细胞凋亡的分子机制,SKOV3细胞单独给予SIRT1抑制剂EX527处理,或给予SRT1720预处理1 h,再给予EGCG处理24 h之后,我们分别检测了SIRT1的去乙酰化酶活性以及SIRT1和Ac-P53的蛋白水平。结果表明SRT1720可取消EGCG对SIRT1去乙酰化酶活性以及SIRT1和Ac-P53蛋白水平的影响(P<0.05),而单独给予EX527处理能够抑制SIRT1酶活性和蛋白表达,增加P53的乙酰化水平,提示SIRT1参与了EGCG对其下游P53乙酰化水平的调控作用,见图4。
讨论
卵巢癌因发病隐匿,易于转移,已成为死亡率最高的妇科恶性肿瘤。目前,卵巢癌术后化疗药物的毒副作用及耐药性使得预后较差。因此,需要寻找高效低毒的药物与放疗联合应用来提高卵巢癌的治疗效果。而EGCG正具备这样2个特点。大量研究证明EGCG可抑制多种肿瘤细胞增殖诱导凋亡并具有阻止肿瘤细胞的侵袭等生物学作用[6-8]。在临床试验中,受试者单次服用EGCG剂量达1 600 mg或每日服用800 mg,连续服药1个月,除可见轻度胃肠道反应外,没有出现明显的毒副反应,提示EGCG的安全性高[4, 9]。关于EGCG在卵巢癌中的作用也有一定的报道。EGCG可通过激活p38 MAPK通路,下调MMP-2的蛋白表达从而抑制卵巢癌细胞株OVCAR-3增殖并诱导其凋亡[10]。最近的研究发现EGCG还可增加顺铂对卵巢癌细胞株的敏感性[7]。在本实验中,我们也发现50 μmol/L的EGCG能够显著抑制人卵巢癌SKOV-3的细胞活力,诱导细胞凋亡,提示EGCG可能是一个潜在的治疗卵巢癌的化疗药物。然而,关于EGCG调控卵巢癌细胞增殖与凋亡的具体分子机制并不十分清楚,值得进一步研究。
近年来,SIRT1因在肿瘤形成过程中扮演的重要角色而引起人们的广泛关注[11]。SIRT1 属于烟酰胺(NAD+)依赖的Ⅲ型组蛋白去乙酰化酶sirtuin家族,哺乳动物sirtuin家族包含7个成员(SIRT1~7)[12]。在sirtuin家族成员中,SIRT1是调控物质代谢、寿命长短以及细胞衰老的重要因子[13]。研究表明SIRT1可通过使肿瘤抑制蛋白P53第382位的赖氨酸残基发生去乙酰化作用,从而降低P53的活性,因此使细胞绕过P53介导的凋亡而继续存活[14]。目前,SIRT1在卵巢癌细胞中的作用研究较少。在卵巢癌组织中,有研究表明SIRT1的蛋白表达及去乙酰化酶活性均显著增加[15]。而de Jong等[16]发现一种花生四烯酸代谢物15d-PGJ2能够通过抑制SIRT1的表达进而诱导卵巢癌细胞A2780凋亡。以上结果提示SIRT1在卵巢癌的发生和发展过程中发挥重要作用。然而,EGCG是否能够调控SIRT1-P53通路?SIRT1-P53信号通路是否参与了EGCG诱导人卵巢癌细胞SKOV-3凋亡的过程?这些问题都需要进一步研究。在本实验中,我们首次发现EGCG可剂量依赖性地抑制SKOV-3细胞中SIRT1的去乙酰化酶活性和蛋白表达水平,并增加SIRT1下游P53的乙酰化水平。为了进一步明确SIRT1-P53通路在EGCG调控人卵巢癌SKOV-3细胞增殖和凋亡中的作用,我们给予SKOV-3细胞SIRT1的特异性激动剂SRT1720预处理,发现SRT1720可显著逆转EGCG对SKOV-3细胞活力和凋亡的影响,进一步的研究表明SRT1720还可拮抗EGCG对SIRT1-P53通路的调控作用。而单独给予SIRT1的抑制剂EX527可诱导SKOV3细胞凋亡,抑制SIRT1去乙酰化酶活性从而增加P53的乙酰化水平。
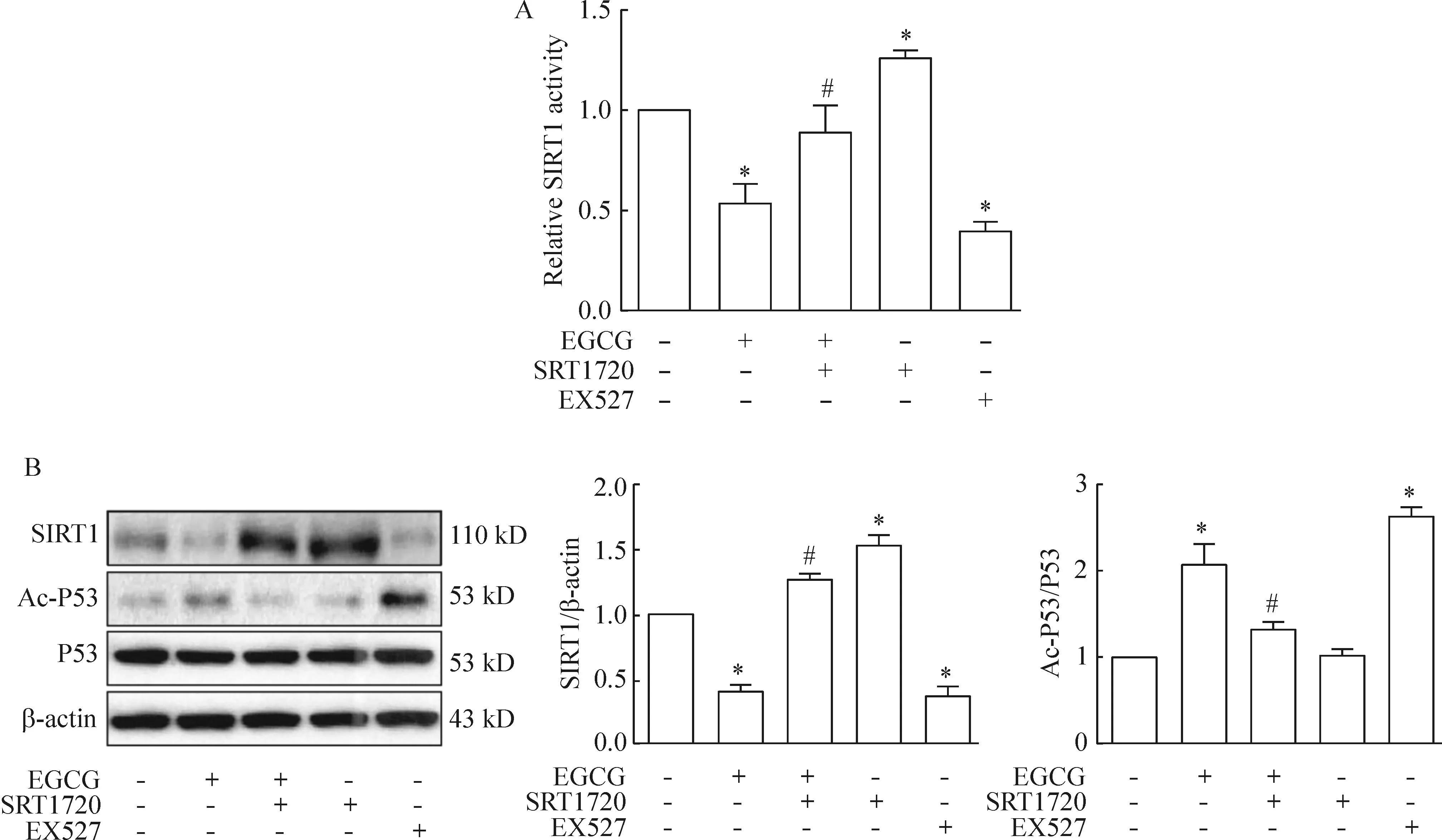
Figure 4.EGCG regulated the P53 acetylation through SIRT1 inhibition. SKOV-3 cells were treated with 1 μmol/L EX527 or pretreated with 1 μmol/L SRT1720 for 1 h followed by stimulation with EGCG (50 μmol/L) for 24 h. A: SIRT1 deacetylase acti-vity was measured by SIRT1 deacetylase fluorometric assay kit; B: the protein levels of SIRT1, Ac-P53 and P53 were exa-mined by Western blot. Mean±SD.n=3.*P<0.05vscontrol group;#P<0.05vsEGCG group.
图4EGCG通过抑制SIRT1调控P53的乙酰化水平
综上所述,本实验证明SIRT1-P53通路参与了EGCG诱导人卵巢癌SKOV-3细胞凋亡的病理过程,我们的研究为EGCG在卵巢癌防治中的应用提供了必要的实验资料和理论依据。
[参考文献]
[1]邓晓慧,宋海岩,孙春莉. 槲皮素对人卵巢癌 SKOV-3细胞增殖的影响[J]. 中国病理生理杂志,2013,29(1): 99-102.
[2]Du FF, Liu YJ, Jiang L, et al. Effects of PI3K inhibitor LY294002 on human paclitaxel-resistant ovarian cancer cell proliferation and migration[J]. Chin Pharmacol Bull, 2013, 29(12):1771-1772.
[3]Salzano G, Navarro G, Trivedi MS, et al. Multifunctional polymeric micelles co-loaded with anti-survivin siRNA and paclitaxel overcome drug resistance in an animal model of ovarian cancer[J]. Mol Cancer Ther, 2015, 14(4):1075-1084.
[4]Chow HH,Cai Y,Hakim IA, et al. Pharmacokinetics and safety of green tea polyphenols after multiple-dose administration of epigallocatechin gallate and polyphenon E in healthy individuals[J]. Clin Cancer Res, 2003, 9(9):3312-3319.
[5]Zhou H, Chen JX, Yang CS, et al. Gene regulation mediated by microRNAs in response to green tea polyphenol EGCG in mouse lung cancer[J]. BMC Genomics, 2014, 15 (Suppl 11):S3.
[6]Luo HQ, Xu M, Zhong WT, et al. EGCG decreases the expression of HIF-1α and VEGF and cell growth in MCF-7 breast cancer cells[J]. J BUON, 2014, 19(2): 435-439.
[7]Wang X, Jiang P, Wang P, et al. EGCG enhances cisplatin sensitivity by regulating expression of the copper and cisplatin influx transporter CTR1 in ovary cancer[J]. PLoS One, 2015, 10(4):e0125402.
[8]Zhao H, Xie P, Li X, et al. A prospective phase II trial of EGCG in treatment of acute radiation-induced esophagitis for stage III lung cancer[J]. Radiother Oncol, 2015, 114(3):351-356.
[9]Ullmann U, Haller J, Decourt JP, et al. A single ascen-ding dose study of epigallocatechin gallate in healthy volunteers[J]. J Int Med Res, 2003, 31(2): 88-101.
[10]Wang F, Chang Z, Fan Q, et al. Epigallocatechin-3-gallate inhibits the proliferation and migration of human ovarian carcinoma cells by modulating p38 kinase and matrix metalloproteinase-2[J]. Mol Med Rep, 2014, 9(3):1085-1089.
[11]Yang H, Bi Y, Xue L, et al. Multifaceted modulation of SIRT1 in cancer and inflammation[J]. Crit Rev Oncog, 2015, 20(1-2):49-64.
[12]夏洪娟,王延鹏,朱伟,等. 白藜芦醇通过上调SIRT1抑制阿霉素诱导的H9C2细胞损伤[J].中国药理学通报,2014,30(2):220-224.
[13]杜月光,柴可夫,钱俊文,等. SIRT1通过降低NF-κB p65乙酰化减轻高糖应激引起的大鼠肾小球系膜细胞损伤[J]. 中国病理生理杂志, 2014, 30(4): 664-669.
[14]Vaziri H, Dessain SK, Ng Eaton E, et al.hSIR2SIRT1functions as an NAD-dependent p53 deacetylase[J]. Cell, 2001, 107(2):149-159.
[15]Jang KY, Kim KS, Hwang SH, et al. Expression and prognostic significance of SIRT1 in ovarian epithelial tumours[J]. Pathology, 2009, 41(4): 366-371.
[16]de Jong E, Winkel P, Poelstra K, et al. Anticancer effects of 15d-prostaglandin-J2in wild-type and doxorubicin-resistant ovarian cancer cells: novel actions on SIRT1 and HDAC[J]. PLoS One, 2011, 6(9):e25192.
(责任编辑: 陈妙玲, 罗森)
Epigallocatechin gallate induces apoptosis of ovarian cancer cell line SKOV-3 via regulation of SIRT1-P53 pathways
YOU Hui-min, KANG Xiang-jin, YANG Jie, LIN Yan-shan, LIU Jian-qiao, DU Hong-zi
(CenterforReproductiveMedicine,ThirdAffiliatedHospitalofGuangzhouMedicalUniversity,KeyLaboratoryforReproductiveMedicineofGuangdongProvince,KeyLaboratoryforMajorObstetricDiseasesofGuangdongProvince,KeyLaboratoryofReproductionandGeneticsofGuangdongHigherEducationInstitutes,Guangzhou510150,China.E-mail:hongzidgzmu@163.com)
[ABSTRACT]AIM: To study the effect of epigallocatechin gallate (EGCG) on the growth and apoptosis of ova-rian cancer cell line SKOV-3 and its molecular mechanism. METHODS: SKOV-3 cells were treated with different concentrations of EGCG (0~50 μmol/L), SRT1720 (1 μmol/L) or EX527 (1 μmol/L) for 24 h. The cell activity was evaluated by CCK-8 assay. The apoptosis of SKOV-3 cells was analyzed by flow cytometry. The mRNA expression of Bcl-2 and Bax was detected by real-time PCR. SIRT1 deacetylase fluorometric assay kit was used to detect the activity of SIRT1. The protein levels of SIRT1 and acetylated P53 (Ac-P53) were determined by Western blot. RESULTS: EGCG or EX527 decreased the deacetylase activity and protein expression of SIRT1, and increased the level of Ac-P53 in a dose-dependent manner. Moreover, SRT1720 abrogated the effects of EGCG on the activity, apoptosis and SIRT1-P53 pathways in ovarian cancer cell line SKOV-3. CONCLUSION: EGCG inhibits the activity and induces apoptosis of ovarian cancer cell line SKOV-3 by regulating SIRT1-P53 pathways.
[KEY WORDS]Epigallocatechin gallate; SKOV-3 cells; Apoptosis; SIRT1-P53 pathway
[文章编号]1000- 4718(2016)01- 0076- 07
[收稿日期]2015- 07- 23[修回日期] 2015- 10- 23
*[基金项目]国家自然科学基金资助项目(No. 81401254);广东省中医药局建设中医药强省科研项目(No. 20142097);广州市教育局市属高校科研项目(No. 1201430205)
通讯作者△Tel: 020-81292233; E-mail: hongzidgzmu@163.com
[中图分类号]R730.23; R737.31
[文献标志码]A
doi:10.3969/j.issn.1000- 4718.2016.01.013

