过表达IGF-1对脐带间充质干细胞氧化损伤的抑制作用*
赵 雷, 陈 昕, 冯业童, 刘朋飞
(暨南大学第二临床医学院,深圳市人民医院 1 麻醉科, 2检验科,广东 深圳 518020; 3中山大学人类病毒学研究所,广东 广州 510080; 4吉林大学药学院再生医学系,吉林 长春 130021)
过表达IGF-1对脐带间充质干细胞氧化损伤的抑制作用*
赵雷1,陈昕2,冯业童3,刘朋飞4△
(暨南大学第二临床医学院,深圳市人民医院1麻醉科,2检验科,广东 深圳 518020;3中山大学人类病毒学研究所,广东 广州 510080;4吉林大学药学院再生医学系,吉林 长春 130021)
[摘要]目的: 分析过表达胰岛素样生长因子1(IGF-1)对脐带间充质干细胞(UC-MSCs)氧化损伤的抑制作用,开发UC-MSCs新的应用模式。方法: 通过酶消化法,从脐带组织中分离UC-MSCs,并采用流式细胞术对细胞的表面特异标志物进行鉴定,通过逆转录病毒感染体系,构建过表达IGF-1的UC-MSCs(UC-MSCs-IGF-1),并进一步通过实时荧光定量PCR和流式细胞术对UC-MSCs-IGF-1的IGF-1表达水平进行评价,同时分析UC-MSCs-IGF-1的表面标志物及成骨成脂分化能力;用不同浓度的H2O2(0 μmol/L、10 μmol/L、50 μmol/L和100 μmol/L)处理细胞,分析UC-MSCs-IGF-1在增殖活力维持、抗氧化损伤和抗凋亡方面的优势。结果: UC-MSCs表面标志物CD29、CD90和CD105的表达均呈阳性,而CD34的表达为阴性,符合正常间充质干细胞的表型特征;实时荧光定量PCR和流式细胞术结果表明,应用逆转录病毒感染体系构建的UC-MSCs-IGF-1在IGF-1表达方面远高于正常UC-MSCs,同时干细胞表型与UC-MSCs一致,且具备正常的成脂成骨分化能力;在H2O2的氧化损伤作用下,与UC-MSCs相比,UC-MSCs-IGF-1具有较强的增殖活力和抗氧化、抗凋亡功能,同时细胞中的SOD活性略高于UC-MSCs。结论: 过表达IGF-1对UC-MSCs的氧化损伤及氧化引起的凋亡均具有一定的防护作用,与正常UC-MSCs相比,UC-MSCs-IGF-1可能在临床应用方面具有一定的优势。
[关键词]脐带间充质干细胞; 胰岛素样生长因子1; 氧化损伤;细胞凋亡
近年来,以干细胞特别是成体干细胞为基础的新型治疗模式,已在多种疾病的治疗上进行了深入研究[1-4]。脐带间充质干细胞(umbilical cord mesenchymal stem cells,UC-MSCs)具有多向分化潜能,还能够迁移至受损组织处,通过分泌营养因子促进损伤组织修复,在体内发挥功能的过程中未见成瘤性[5-6]。同时,UC-MSCs的免疫学特性也在很大程度上扩宽了它的应用范围,这种细胞不仅具有免疫调节能力,而且,基于自身的低免疫源性特点,该细胞在异体移植方面也具有着较好的应用前景[3, 7-9]。
胰岛素样生长因子1(insulin like growth factor-1,IGF-1)是一种结构类似胰岛素的多肽类细胞因子,主要在肝脏合成,是具有促进细胞分化和增殖作用的单链蛋白,生物作用广泛,参与机体多种器官功能调节,在人和脊椎动物的胚胎发育和机体正常成长发育过程中起着重要作用[10]。近年来,研究人员发现IGF-1具有一定的抗氧化损伤的作用,该功能在多种细胞氧化损伤的抑制方面均得到了一定验证,即在细胞培养体系中加入IGF-1,可以起到抵抗氧化损伤的作用[11-12]。但是,IGF-1对UC-MSCs的氧化损伤抑制作用尚不明确。此外,这种技术模式需要持续给予外源的IGF-1,对许多应用方面具有一定的局限性。
针对这些问题,本课题组拟通过基因调控技术,使UC-MSCs能持续表达IGF-1,探索过表达IGF-1的UC-MSCs在抗氧化功能方面的优越性,为UC-MSCs在临床方面的合理化应用提供一定的理论参考和技术支持。
材料和方法
1主要试剂和仪器
DMEM/F12培养基及胎牛血清购自Gibco;TRIzol RNA提取液购自Invitrogen;RNA反转录试剂盒和实时定量PCR试剂盒均购自TaKaRa;所有引物序列均由上海生工生物工程有限公司合成;CCK-8试剂盒购自Dojindo;人源CD29-FITC、CD34-FITC、CD90-FITC、CD105-FITC和IGF-1-PE单克隆抗体均购自BD;碱性磷酸酶(alkaline phosphatase,AP)染色试剂盒、油红O(oil red O)染色试剂盒、丙二醛(malondialdehyde,MDA)测定试剂盒和超氧化物歧化酶(superoxide dismutase,SOD)分型测试盒购自南京建成生物工程研究所。
IX-70倒置相差显微镜及正置生物学显微镜均购自日本 Olympus;PCR仪购自北京东胜创新生物科技有限公司;CFX96实时定量PCR仪购自Bio-Rad;FACSCalibur 流式细胞仪购自BD;EXL-808酶标检测仪购自Bio-Tek。
2实验方法
2.1人源UC-MSCs的分离和鉴定取分娩后的脐带组织,用PBS液清洗组织3遍,用眼科剪刀将组织标本剪碎;加IV型胶原蛋白酶(2 g/L)与剪碎组织混匀,置于37 ℃、5% CO2培养箱消化4 h,3 000 r/min室温下离心10 min,弃上清液;再添加I型脱氧核糖核酸酶(1 g/L)重悬细胞沉淀,置于37 ℃、5% CO2培养箱消化15 min,按上述离心条件再次离心,弃上清液;添加0.25%胰酶重悬组织细胞,置于37 ℃、5% CO2培养箱消化15 min,再次离心弃上清液;添加UC-MSCs细胞培养液(DMEM/F12+10%胎牛血清)重悬组织细胞,应用40 μm细胞容器过滤组织块,将滤液移入铺有明胶的培养皿中,置于37 ℃、5% CO2培养箱培养。
收集第3代的UC-MSCs进行后续的检测和评价。在表面特异标记检测方面,将1×106UC-MSCs悬浮于0.1 mL PBS中,人源CD29-FITC、CD34-FITC、CD90-FITC和CD105-FITC单克隆抗体均按1∶50的稀释比例与UC-MSCs混合,室温孵育30 min后,用PBS清洗2次,通过流式细胞仪检测细胞表面标记。另一方面,对细胞在成骨分化和成脂分化方面的能力进行评价,分别采用成骨分化培养基(在基础培养基中,附加地塞米松10-4mmol/L、β-甘油磷酸钠10 mmol/L和维生素C 50 mg/L)和成脂分化培养基(在基础培养基中,附加地塞米松10-3mmol/L、胰岛素10 mg/L、IBMX 0.5 mmol/L和吲哚美辛0.2 mmol/L)对细胞进行培养,隔日换液1次,培养3~4周后,分别用AP染色和油红O染色评价细胞的分化潜能,具体分化方法及检测同参考文献[4]。
2.2过表达IGF-1的UC-MSCs的构建pMX-IGF-1过表达载体由吉林大学药学院生物工程实验中心提供。本课题中采用293T细胞制备逆转录病毒,通过逆转录病毒感染的方法构建过表达IGF-1的UC-MSCs(UC-MSCs-IGF-1)。具体实验方法同参考文献[13-14]。
对本课题所构建的UC-MSCs-IGF-1其细胞表面标记、成骨分化能力和成脂分化能力进行评价,方法同2.1。此外,分别通过实时荧光定量PCR和流式细胞术方法检测细胞过表达IGF-1的程度。同时,通过实时荧光定量PCR检测UC-MSCs-IGF-1干细胞标志物的表达情况。收集构建的UC-MSCs-IGF-1,用TRIzol裂解,提取细胞RNA,并进一步通过反转录试剂盒获得细胞基因组cDNA,采用实时荧光定量PCR检测UC-MSCs-IGF-1中相关基因的表达程度,检测过程中以正常UC-MSCs和转染空载体的UC-MSCs-vector为对照组,具体操作按照试剂盒说明书进行,引物序列见表1。
2.3过表达IGF-1的UC-MSCs的抗氧化损伤能力分析分别将正常UC-MSCs、UC-MSCs-vector和UC-MSCs-IGF-1,以每孔2×103cells的数量接种到96孔板中,每组细胞进一步用不同浓度的H2O2(0 μmol/L、10 μmol/L、50 μmol/L和100 μmol/L)进行作用处理,采用CCK-8试剂盒检测细胞在H2O2作用24 h、48 h后的细胞活力,评价各实验组的抗氧化能力,用仅含培养基的组作为背景组,测量绝对吸光度(实验组绝对吸光度值=实验组吸光度值-空白组吸光度值),每组设4个复孔,具体操作按CCK-8试剂盒说明书进行。另一方面,将细胞以每孔2×105cells的数量接种到6孔板中,处理方法及分组同上,直接用细胞计数器在镜下计数细胞,结合CCK-8实验观察的细胞活力结果,观察UC-MSCs-IGF-1的增殖能力。
收集各实验组细胞,采用MDA测定试剂盒和SOD分型测试盒检测各组细胞MDA 的含量及SOD的活性,观察过表达IGF-1对细胞凋亡和SOD活性的影响,进一步明确各组细胞的抗氧化能力。具体操作按试剂盒说明书进行。
2.4过表达IGF-1的UC-MSCs在抗氧化损伤过程中的凋亡相关基因分析在H2O2作用48 h后,收集各个实验组的RNA,反转录后检测各组细胞凋亡基因caspase-3、bax和抗凋亡基因bcl-2的表达程度,从而明确各组细胞的凋亡情况。在凋亡基因检测中,以β-actin作为内参照,将正常UC-MSCs作为空白对照组,并将基因在空白对照组的表达水平作为“1”,通过等比例比较各实验组的基因表达水平。实时荧光定量PCR所用引物序列见表1。
3统计学处理
(2)改善钻井液润滑性。施工中通过加入1%油基润滑剂来优化钻井液润滑性,作用机理是在亲水性的井壁和钻具表面形成一层疏水性油膜,在增强吸附表面润滑性的同时,也有助于抑制泥页岩吸水膨胀分散,降低摩阻。若是摩阻较大的定向井,可向钻井液中加入10% 原油,并使其充分乳化,以改善钻井液的润滑性能和摩阻,阻止压差卡钻现象的发生[1]。
应用SPSS 17.0软件进行统计学分析。数据以均数±标准差(mean±SD)表示;多组均数间比较采用单因素方差分析,并用SNK-q检验进行各组之间的两两比较。以P<0.05表示差异有统计学意义。

表1 引物序列
F: forward; R: reverse.
结果
1人源UC-MSCs的分离和鉴定结果
分离的人源UC-MSCs在培养1 d后,呈长梭形贴壁状态生长,随着培养时间的延长,可见细胞生长密度逐渐增大,由此说明细胞具有一定的增殖能力。此外,通过流式细胞术检测可见UC-MSCs表达CD29、CD90和CD105(表达效率分别为98.1%、97.2%和90.2%),基本不表达CD34(表达效率为0.52%),这种表面标记特征与正常的间充质干细胞相符合,满足本课题后续研究的需要。同时,细胞具备成骨分化和成脂分化的能力,可见分化后的细胞AP染色和油红O染色均为阳性,见图1。
2过表达IGF-1的UC-MSCs的构建及鉴定
将基因在UC-MSCs-IGF-1组的表达水平定为“1”,通过等比例比较各实验组的基因表达水平。实时荧光定量PCR结果表明,IGF-1逆转录病毒感染后的UC-MSCs,在IGF-1表达方面远高于正常UC-MSCs以及UC-MSCs-vector,差异有统计学意义(P<0.05)。流式细胞术的检测结果与实时荧光定量PCR的结果相一致,与阴性对照组相比,UC-MSCs、UC-MSCs-vector和UC-MSCs-IGF-1的IGF-1表达效率分别为0.25%、0.32%和97.5%,UC-MSCs-IGF-1中IGF的表达效率远高于正常UC-MSCs以及UC-MSCs-vector。上述结果证明本课题中所采用的逆转录病毒过表达体系效果明显,可以成功构建过表达IGF-1的UC-MSCs,见图2。

Figure 1.The morphology and identification of human UC-MSCs and UC-MSCs-IGF-1.
图1人源UC-MSCs及UC-MSCs-IGF-1的形态及鉴定结果
3过表达IGF-1的UC-MSCs抗氧化损伤的能力评价结果
细胞计数分析结果的大体趋势与CCK-8的结果基本一致。在用10 μmol/L H2O2处理细胞时,细胞的增殖能力并未见显著变化,随着H2O2浓度的提高,各实验组细胞的增殖能力逐渐下降;在用50 μmol/L H2O2处理时,UC-MSCs和UC-MSCs-vector均呈现一定的增殖抑制现象,而UC-MSCs-IGF-1仍然可以呈现一定程度的增殖趋势;在用100 μmol/L H2O2处理时,各实验组均呈现明显的细胞生长抑制,但是,各实验组的抑制程度具有显著区别,作用48 h后,UC-MSCs和UC-MSCs-vector的抑制效率[抑制效率=(0 h相对吸光度-48 h相对吸光度)/0 h相对吸光度×100%]分别为51.9%和51.7%,而UC-MSCs-IGF-1组的抑制效率为16.4%,明显低于UC-MSCs和UC-MSCs-vector,由此表明UC-MSCs-IGF-1具有一定的抗氧化损伤的作用,见图3。
对各实验组SOD的检测结果表明,UC-MSCs-IGF-1中SOD的活性水平略高于UC-MSCs和UC-MSCs-vector(P<0.05),所以UC-MSCs-IGF-1可以在一定程度上抵抗H2O2的氧化损伤,维持细胞活力,见图4。

Figure 2.Evaluation of UC-MSCs-IGF-1 establishment. Mean±SD.n=3.*P<0.05vsUC-MSCs;#P<0.05vsUC-MSCs-vector.
图2UC-MSCs-IGF-1的构建评价
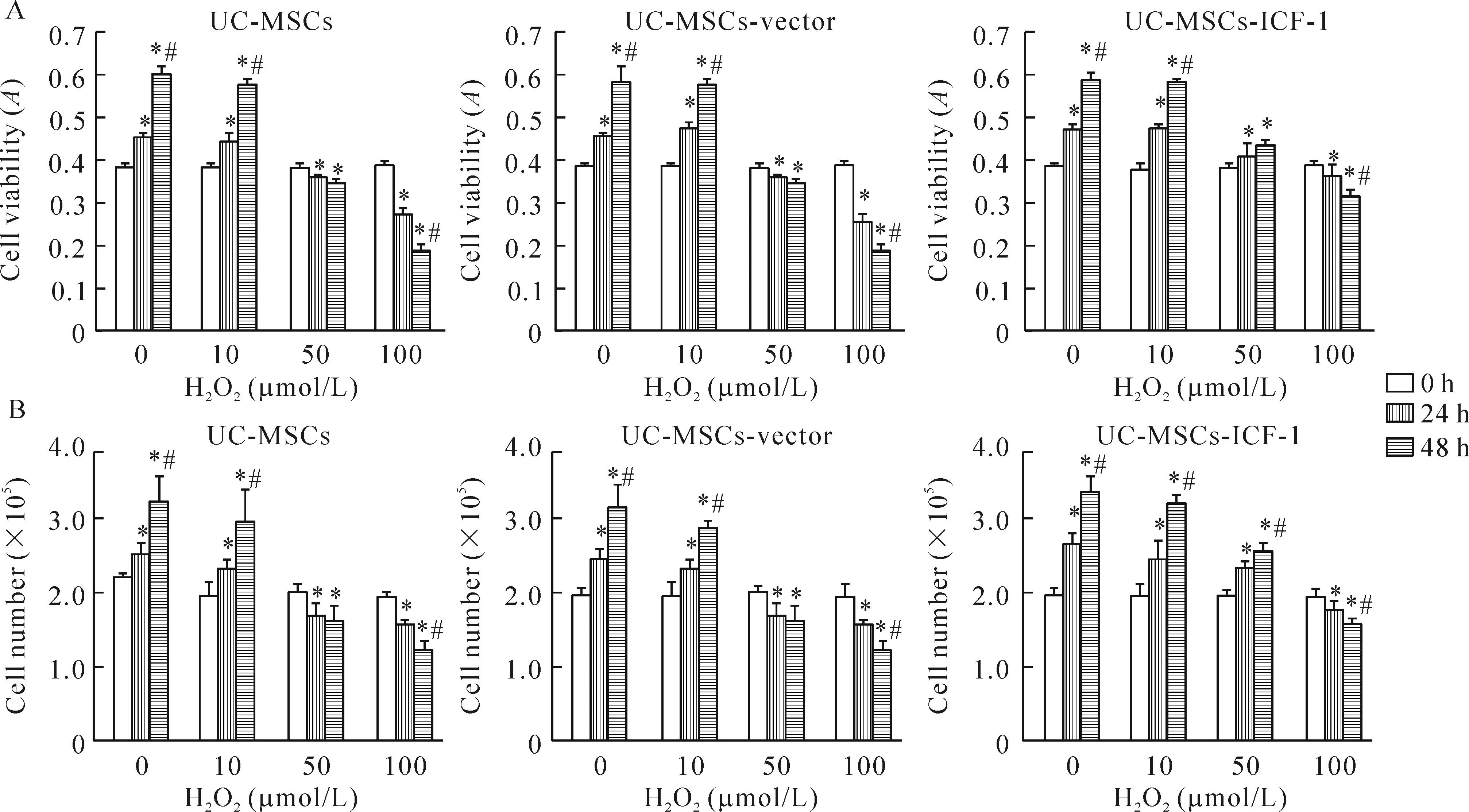
Figure 3.The proliferation of UC-MSC, UC-MSCs-vector and UC-MSCs-IGF-1 treated with H2O2at different concentrations.A: CCK-8 assay; B: cell counting. Mean±SD.n=4.*P<0.05vs0 h;#P<0.05vs24 h.
图3在不同浓度H2O2的作用下UC-MSCs、UC-MSCs-vector和UC-MSCs-IGF-1的增殖变化

Figure 4.The SOD activity in each group. Mean±SD.n=4.*P<0.05vsUC-MSCs;#P<0.05vsUC-MSCs-vector.
图4各实验组SOD活性的检测结果
4过表达IGF-1的UC-MSCs在抗氧化损伤过程中凋亡相关基因的表达
实时荧光定量PCR检测的结果表明,在未经H2O2处理或10 μmol/L H2O2处理细胞时,UC-MSCs、UC-MSCs-vector以及UC-MSCs-IGF-1的凋亡基因caspase-3和bas均保持较低水平,而抗凋亡基因bcl-2处于较高的水平,各实验组未见明显差异;随着H2O2浓度的增大,由H2O2引起细胞凋亡逐渐显著,可见各实验组均有caspase-3和bax上调,以及bcl-2下调的趋势,但是,各实验组的细胞凋亡程度各不一致,与UC-MSCs和UC-MSCs-vector相比,UC-MSCs-IGF-1中的caspase-3和bax的上调程度和bcl-2的下调程度均较弱,且差异有统计学意义(P<0.05)。同时,MDA的检测结果表明,UC-MSCs-IGF-1中MDA的含量略低于UC-MSCs和UC-MSCs-vector(P<0.05),由此表明UC-MSCs-IGF-1可以在一定程度上抵抗氧化损伤引起的细胞凋亡,见图5。

Figure 5.Detection of apoptosis-associated gene expression and MDA in each group treated with H2O2at different concentrations. Mean±SD.n=3.*P<0.05vsUC-MSCs;#P<0.05vsUC-MSCs-vector.
图5在不同浓度H2O2的作用下各实验组凋亡相关基因mRNA表达及MDA的检测结果
讨论
本研究利用逆转录病毒构建了UC-MSCs-IGF-1,由于逆转录病毒感染体系属于基因组插入模式,所以,所构建的UC-MSCs-IGF-1是稳定表达IGF-1的UC-MSCs。结果表明,与正常UC-MSCs相比,UC-MSCs-IGF-1在生长形态、表面标记、细胞增殖及成骨成脂分化等方面,未见显著区别。由此可见,利用逆转录病毒感染体系实现的IGF-1过表达,不会影响干细胞的基本生物特性。
IGF-1对细胞氧化损伤的抑制作用已逐渐为研究人员所证实,但是,如何将这一科学理论应用于临床实践尚不明确。目前研究表明,通过体外调控,可以优化UC-MSCs的某些生物学特性,同时,UC-MSCs通过静脉途径进入体内,对多种疾病均有较好的治疗效果[3, 7, 15-16]。但是,正常情况下,人体血液内的IGF-1浓度较低,必须在给予UC-MSCs的同时补充IGF-1才能起到抗氧化损伤的效果,这种方法在很大程度上增加了治疗成本,同时还需要考虑外源IGF-1在体内的作用剂量和作用时间。针对这一问题,本课题采用基因调控手段构建UC-MSCs-IGF-1,证明UC-MSCs-IGF-1在抗氧化损伤、维持细胞增殖活力、抗凋亡等方面,均具有一定的优势。同时,课题组对所建立的UC-MSCs-IGF-1进行了一定时期的体外培养,在构建后传代5次,IGF-1仍然具有较高的表达水平,与初始构建的UC-MSCs-IGF-1并无明显差别。这些特点均在一定程度上为UC-MSCs的临床合理化应用提供了一定的技术基础。但是,本课题对于基因调控方面的机理机制分析较少,尚不明确过表达IGF-1对细胞内其它信号通路及UC-MSCs生物活性的影响;同时,在UC-MSCs-IGF-1抗氧化损伤的能力方面,本课题所建立的体系仍有待进一步优化;特别是本课题仍处于体外研究阶段,UC-MSCs-IGF-1相关的体内功能仍需要进一步的探索和研究。
[参考文献]
[1]Chou YH, Pan SY, Yang CH, et al. Stem cells and kidney regeneration[J]. J Formosan Med Assoc, 2014, 113(4):201-209.
[2]Beiral HJ, Rodrigues-Ferreira C, Fernandes AM, et al. The impact of stem cells on electron fluxes, proton translocation, and ATP synthesis in kidney mitochondria after ischemia/reperfusion[J]. Cell Transplant, 2014, 23(2): 207-220.
[3]Liu Z, Meng F, Li C, et al. Human umbilical cord mesenchymal stromal cells rescue mice from acetaminophen-induced acute liver failure [J]. Cytotherapy, 2014, 16(9):1207-1219.
[4]Liu P, Feng Y, Dong C, et al. Administration of BMSCs with muscone in rats with gentamicin-induced AKI improves their therapeutic efficacy[J]. PLoS One, 2014, 9(5):e97123.
[5]Fong CY, Subramanian A, Gauthaman K, et al. Human umbilical cord Wharton’s jelly stem cells undergo enhanced chondrogenic differentiation when grown on nanofibrous scaffolds and in a sequential two-stage culture medium environment [J]. Stem Cell Rev, 2012, 8(1):195-209.
[6]Chen G, Yue A, Ruan Z, et al. Human umbilical cord-derived mesenchymal stem cells do not undergo malignant transformation during long-term culturing in serum-free medium [J]. PLoS One, 2014, 9(6):e98565.
[7]Qiu Z, Zhou D, Sun D. Effects of human umbilical cord mesenchymal stem cells on renal ischaemia-reperfusion injury in rats [J]. Int Braz J Urol, 2014, 40(4):553-561.
[8]Kim ES, Ahn SY, Im GH, et al. Human umbilical cord blood-derived mesenchymal stem cell transplantation atte-nuates severe brain injury by permanent middle cerebral artery occlusion in newborn rats [J]. Pediatr Res, 2012, 72(3):277-284.
[9]Anzalone R, Lo Iacono M, Loria T, et al. Wharton’s jelly mesenchymal stem cells as candidates for beta cells rege-neration: extending the differentiative and immunomodulatory benefits of adult mesenchymal stem cells for the treatment of type 1 diabetes [J]. Stem Cell Rev, 2011, 7(2):342-363.
[10]Ren J, Anversa P. The insulin-like growth factor I system: Physiological and pathophysiological implication in cardiovascular diseases associated with metabolic syndrome [J]. Biochem Pharmacol, 2015, 93(4):409-417.
[11]Drexler AL, Pietri JE, Pakpour N, et al. Human IGF1 regulates midgut oxidative stress and epithelial homeostasis to balance lifespan andPlasmodiumfalciparumresistance inAnophelesstephensi[J]. PLoS Pathog, 2014, 10(6):e1004231.
[12]Kokoszko A, Dabrowski J, Lewinski A, et al. Effects of growth hormone and insulin-like growth factor-I on the iron-induced lipid peroxidation in the rat liver and porcine thyroid homogenates [J]. Neuro Endocrinol Lett, 2010, 31(4): 517-523.
[13]Cai J, Li W, Su H, et al. Generation of human induced pluripotent stem cells from umbilical cord matrix and amniotic membrane mesenchymal cells [J]. J Biol Chem, 2010, 285(15):11227-11234.
[14]Esteban MA, Wang T, Qin B, et al. Vitamin C enhances the generation of mouse and human induced pluripotent stem cells [J]. Cell Stem Cell, 2010, 6(1):71-79.
[15]周志刚,李志忠,林永新,等. TNF-α增强人脐带间充质干细胞条件培养基的体外造血支持功能[J]. 中国病理生理杂志, 2013, 29(9):1679-1684.
[16]曾慧兰,卜欠欠,陈慧中,等. 尼古丁对人脐带间充质干细胞增殖和迁移的影响[J]. 中国病理生理杂志, 2013, 29(5):778-783.
(责任编辑: 卢萍, 罗森)
Inhibitory effect of IGF-1 overexpression on oxidative damage in umbilical cord mesenchymal stem cells
ZHAO Lei1, CHEN Xin2, FENG Ye-tong3, LIU Peng-fei4
(1DepartmentofAnesthesiology,2DepartmentofLaboratoryMedicine,SecondClinicalMedicalCollegeofJinanUniversity,ShenzhenPeople’sHospital,Shenzhen518020,China;3InstituteofHumanVirology,SunYat-senUniversity,Guangzhou510080,China;4DepartmentofRegenerativeMedicine,SchoolofPharmaceuticalScience,JilinUniversity,Changchun130021,China.E-mail:rockman123456@sina.com)
[ABSTRACT]AIM: To analyze the inhibitory effect of insulin-like growth factor-1 (IGF-1) overexpression in umbilical cord mesenchymal stem cells (UC-MSCs) on oxidative damage and to develop new application model for UC-MSCs. METHODS: UC-MSCs were isolated from human umbilical cord with enzymatic digestion, and further characte-rized with flow cytometry. IGF-1-overexpressing UC-MSCs (UC-MSCs-IGF-1) were established by retrovirus infection. IGF-1 expression of UC-MSCs-IGF-1 was evaluated by real-time quantitative PCR and flow cytometry, and its surface markers, as well as osteogenic and adipogenic differentiation ability, were further analyzed. The proliferation, anti-oxidative damage and anti-apoptosis abilities of UC-MSCs-IGF-1 were evaluated when treated with H2O2 at different concentrations (0 μmol/L, 10 μmol/L, 50 μmol/L and 100 μmol/L). RESULTS: UC-MSCs showed positive expression of CD29, CD90 and CD105, but negative expression of CD34, which coincided with the normal phenotype of mesenchymal stem cells. UC-MSCs-IGF-1 established with retrovirus infection showed much higher expression of IGF-1 compared with normal UC-MSCs, and expressed the same surface markers as UC-MSCs.The osteogenic and adipogenic differentiation abilities were also observed. With the oxidative damage by H2O2treatment, UC-MSCs-IGF-1 showed more strong proliferation, anti-oxidative damage and anti-apoptosis abilities as compared with normal UC-MSCs. In addition, the activity of SOD in UC-MSCs-IGF-1 was a little higher than that in control group. CONCLUSION: IGF-1 overexpression in UC-MSCs inhibits oxidative damage and cell apoptosis. UC-MSCs-IGF-1 may have more advantagies in clinical application.
[KEY WORDS]Umbilical cord mesenchymal stem cells; Insulin-like growth factor-1; Oxidative damage; Apoptosis
[文章编号]1000- 4718(2016)01- 0160- 07
[收稿日期]2015- 06- 02[修回日期] 2015- 11- 05
*[基金项目]深圳市知识创新计划 (No. JCYJ20140416122812052);吉林大学研究生创新基金资助项目(No. 2015009);深圳市卫生计生系统科研项目 (No. 201401010)
通讯作者△Tel: 0431-85619715; E-mail: rockman123456@sina.com
[中图分类号]R392.32
[文献标志码]A
doi:10.3969/j.issn.1000- 4718.2016.01.028

