脂肪源性干细胞对多发性硬化患者Th17的免疫调控作用*
林晓滨, 陈 颖, 杨德壕, 谢甬淋, 毕 涌, 柯建明, 陈志博, 苏中钱, 厉 向, 张 旭△
(温州医科大学附属第一医院 1超声影像科,2神经内科,浙江 温州 325000; 3武警浙江省总队杭州医院康复科,浙江 杭州 310000)
脂肪源性干细胞对多发性硬化患者Th17的免疫调控作用*
林晓滨1,陈颖2,杨德壕2,谢甬淋3,毕涌2,柯建明2,陈志博2,苏中钱2,厉向2,张旭2△
(温州医科大学附属第一医院1超声影像科,2神经内科,浙江 温州 325000;3武警浙江省总队杭州医院康复科,浙江 杭州 310000)
[摘要]目的: 探讨人脂肪源性干细胞(hASCs)对多发性硬化(MS)患者外周血辅助性T细胞17(Th17)的免疫调控作用机制。方法: 分离、纯化脂肪组织中的hASCs。采用密度梯度离心法分离MS患者外周血单个核细胞(PBMCs),磁珠分选CD4+T细胞,体外刺激细胞向Th17极化,并加入不同比例的hASCs(hASCs∶CD4+T为1∶4和1∶10)共培养4 d,设立添加anti-LIF抗体组;流式细胞术检测共培养后Th17细胞占CD4+T细胞的比例,real-time PCR检测白细胞介素6受体(IL-6R)、白细胞介素23受体(IL-23R)、白血病抑制因子受体(LIFR)、维甲酸相关孤儿受体γt(RORγt)及白血病抑制因子(LIF)的mRNA水平变化;ELISA法检测共培养体系上清液中LIF的水平。结果: 分离的hASCs经流式细胞术鉴定可基本判定为hASCs;PBMCs经磁珠法分选后获得90%以上纯度的CD4+T细胞。共培养后,1∶4组和1∶10组中Th17细胞所占比例下降,且存在高浓度抑制效应;共培养后RORγt、IL-6R和IL-23R的mRNA表达水平下降,LIFR和LIF的mRNA表达水平均升高;加入anti-LIF抗体后,Th17细胞比例回升至对照组水平;RORγt和IL-6R的mRNA表达水平回升;ELISA检测各组LIF的水平,共培养组LIF分泌均较对照组明显增多,加入anti-LIF抗体后明显减少。结论: hASCs可抑制MS患者Th17细胞的分化,其作用可能与其分泌LIF、通过IL-6/LIF轴竞争性抑制有关。
[关键词]多发性硬化; 脂肪源性干细胞; Th17细胞; 白血病抑制因子; 白细胞介素6
多发性硬化(multiple sclerosis,MS)是一种中枢神经系统(central nervous system,CNS)慢性脱髓鞘性的自身免疫性疾病。参与此自身免疫应答过程的众多效应细胞中,辅助性T细胞17(T helper 17 cells,Th17)细胞起着最关键的决定性作用[1]。近年来,间充质干细胞(mesenchymal stem cells,MSCs)移植为神经系统疾病如MS、脑卒中等治疗带来了希望[2]。人脂肪源性干细胞(human adipose-derived stem cells,hASCs)是来源于脂肪的间充质干细胞,具有免疫调节效应,其调节能力涉及多种免疫细胞[3],其机制包括细胞之间的接触作用和分泌可溶性的免疫调节因子[4]。白血病抑制因子(leukemia inhibitory factor,LIF)是hASCs分泌的其中一种免疫调节因子,可通过LIF-LIF受体(LIF receptor,LIFR)机制抑制CD4+T细胞向Th17细胞分化,并且诱导T细胞无能而抑制免疫反应的进展[5],而且在ASCs介导的抑制淋巴细胞增殖中起着关键作用[6]。MSCs对Th17细胞的免疫调节作用研究结论尚不统一,且hASCs对Th17细胞分化的作用及确切机制,目前相关报导较少。因此,本研究主要为体外利用 hASCs与MS患者外周血CD4+T细胞体外共培养,检测Th17细胞细胞数量的变化,及细胞信号通路的变化,并进一步探讨hASCs调控Th17细胞分化的可能机制,是否与分泌LIF相关。
材料和方法
1标本与试剂
人脂肪组织标本取自我院整形外科抽脂手术患者。排除患有传染病、自身免疫性疾病以及其它重大疾病的患者,捐赠者签署知情同意书。外周血来自我院住院且符合McDonald诊断标准的多发性硬化患者,经患者知情同意及通过医院伦理委员会批准。高糖DMEM培养基(Hyclone);胰蛋白酶(Anleresco);I型胶原酶(博蕴公司);胎牛血清(Gibco);hASCs表型鉴定流式抗体、细胞因子、LIF ELISA试剂盒(ebioscience);淋巴细胞分离液(天津灏洋生物);CD4+T Cell Isolation Kit II(美天妮);Th17表面流式抗体(BD); anti-LIF(R&D);逆转录试剂盒(Thermo);SYRB Green染料(ABI);刺激剂PMA/Ionomycin mixture和阻断剂BFA/Monensin mixture(联科生物);固定破膜剂(BD)。
2方法
2.1hASCs的体外培养和生物学鉴定从抽脂手术患者中得到废弃的脂肪组织,分离、纯化hASCs,进行原代与传代培养后,并观察其生物性状。选取3~5代hASCs,进行免疫细胞化学染色鉴定加入抗人CD44-FITC、CD105-APC、CD29-FITC、CD73-PE、CD31-PE、HLA-DR-APC、CD13-FITC、CD34-APC和CD49d-PE,对照组加入FITC-IgG1、APC-IgG1和PE-IgG1作为同型对照。
2.2人外周血提取外周血单个核细胞(peripheral blood mononuclear cells,PBMCs)无菌采集患者静脉血,采用淋巴细胞分离液进行密度梯度离心法获得单个核细胞,用红细胞裂解液去除掺杂的红细胞,用台盼蓝染液染色检查PBMCs细胞存活率,镜检要求细胞存活率应在95 %以上。
2.3磁珠分选(magnetic-activated cell sorting,MACS)CD4+T细胞分离得到的外周血单个核细胞反复洗涤去除血小板,采用免疫磁珠法分选CD4+T细胞阴选的试剂盒,按说明选择合适的分离柱和分选器进行分选,最后获得的细胞加入CD4-PE-cy5.5抗体,用流式细胞术检测分选前后CD4+T细胞纯度。
2.4hASCs与CD4+T细胞体外共培养分离出MS患者的CD4+T细胞调整至4×108/L,接种于24孔培养板,用anti-CD3/CD28刺激增殖,添加促进Th17细胞分化的细胞因子白细胞介素1β(interleukin-1β,IL-1β)、白细胞介素6(interleukin-6,IL-6)、转化生长因子β(transforming growth factor β,TGF-β)和白细胞介素23(interleukin-23,IL-23),使细胞向Th17细胞极化,再与hASCs共培养4 d。实验组分别为hASCs∶CD4+T为1∶4、1∶10和1∶4加anti-LIF组;对照组为hASCs组和CD4+T组。取第3~5代hASCs按比例加入各孔,共培养4 d后,收集各个孔细胞用于流式检测Th17细胞。
2.5Real-time PCRTRIzol法提取各组细胞的RNA,用分光光度计检测其总RNA浓度和纯度。取所提的RNA 1 μg参照逆转录试剂盒将其逆转录合成双链cDNA,real-time PCR检测,其体系为:SYBR Green 10 μL,上游引物(10 pmol/L)1 μL,下游引物(10 pmol/L)1 μL,cDNA模板1 μL,ddH2O 7 μL。引物序列见表1。应用Applied Biosystems 7500 Real-Time PCR System对其进行分析。分析维甲酸受体相关孤儿受体γt(retinoid-related orphan receptor,RORγt)、白细胞介素6受体(interleukin-6 receptor,IL-6R)、白细胞介素23受体(interleukin-23 receptor,IL-23R)、LIF和LIFR的mRNA表达情况。
2.6ELISA法检测上清中LIF的表达收集各组培养的上清液,参照试剂盒说明进行操作,设置3个复孔。在酶标仪上检测450 nm处测量A值,计算标本浓度。
3统计学处理
采用SPSS 20.0软件对数据进行统计学分析,检验实验结果正态性和方差齐性,计量资料均以均数±标准差(mean±SD)表示,各组间的均数比较采用单因素方差分析,各组均数两两比较采用SNK-q检验,以P<0.05为差异有统计学意义。

表1 引物序列
结果
1hASCs的体外培养和生物学鉴定
分离的hASCs呈现类似纤维细胞样的生长状态,细胞贴壁良好,倒置显微镜下呈长梭形、编织状,随培养时间的延长及数次传代后其细胞形态逐渐变得均一,可以分离出纯度较高的hASCs。本实验分离得的细胞表面高表达CD44、CD29、CD73、CD105和CD13,阳性率达95%以上,CD49d部分表达,几乎不表达CD31、CD34和HLA-DR,基本可判定为hASCs,见图1。

Figure 1.Morphological observation and surface marker detection of human adipose-derived stem cells (hASCs). A: hASCs at passage 3 under microscope (×100); B: the characteristics of the surface markers on hASCs detected by flow cytometry. The images showed that isolated hASCs positively expressed CD13, CD29, CD44, CD73 and CD105, but hardly expressed CD31, CD34 and HLA-DR.
图1第3代hASCs细胞形态观察及其表面标志物表达情况
2hASCs对Th17细胞的免疫调控作用
2.1人外周血单个核细胞的分离离心20 min后,取出离心管观察,离心管内分为4层,自上而下分别为淡黄色的血浆层、乳白色云雾状的淋巴细胞层、透明的淋巴细胞分离液层和红细胞层。吸取淋巴细胞层,清洗后得到PBMCs。台盼蓝染色后显微镜下观察细胞存活率达95%以上。
2.2流式细胞术检测分选前后CD4+T细胞分选前,PBMCs经流式细胞术检测显示有3群细胞,左下角为红细胞群与细胞碎片,中间为淋巴细胞群,右上角为单核细胞群,选中淋巴细胞群,设门分析,结果显示CD4+T细胞在PBMCs中所占比例为25%~35%。分选后,目的细胞经过流式细胞术检测,显示2群细胞,左侧为细胞碎片,右侧为淋巴细胞群,选中淋巴细胞群,设门分析显示CD4+T细胞所占比例为90%以上,这表明分选后所得的细胞大部分为CD4+T细胞,见图2。
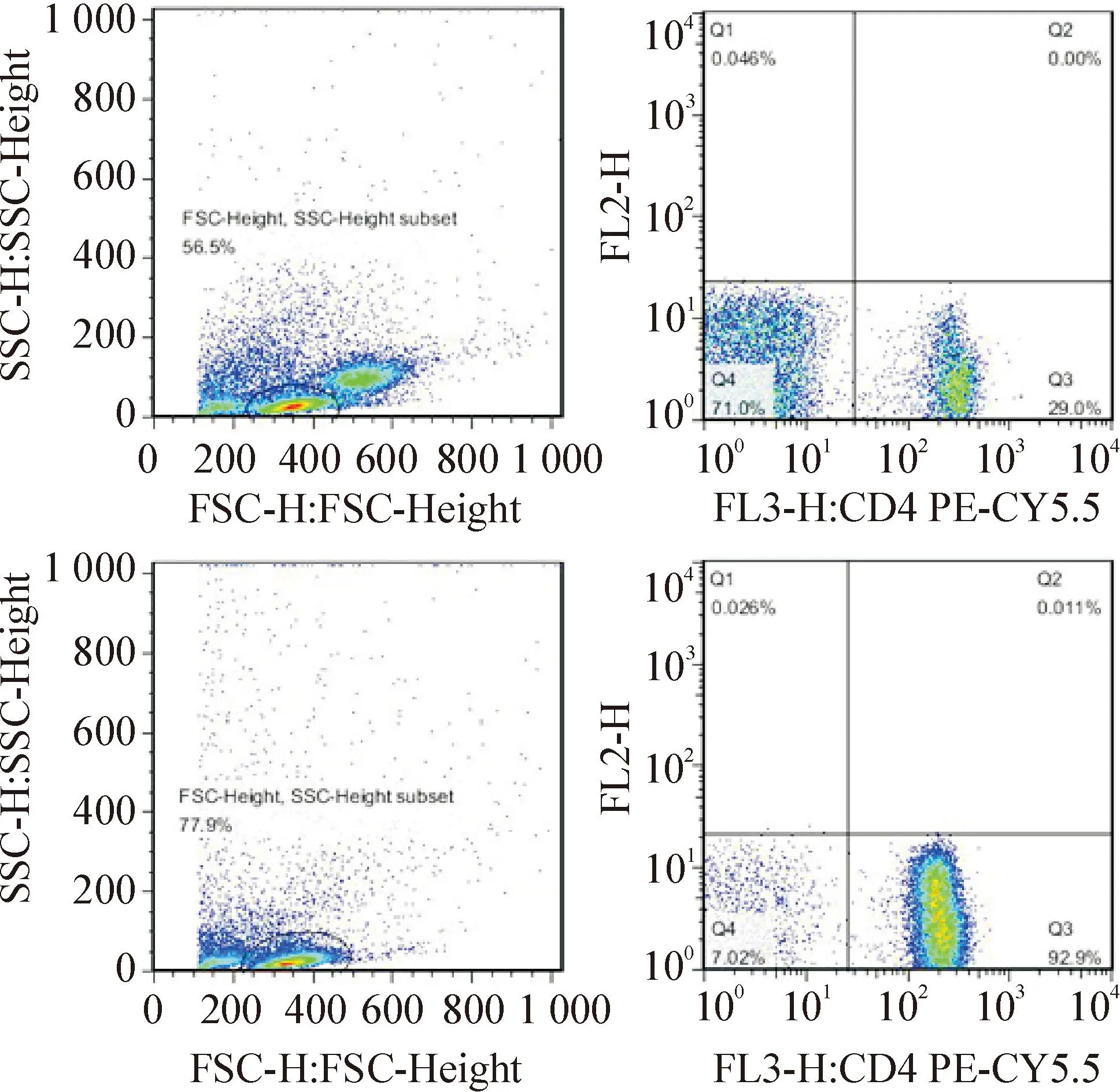
Figure 2.The percentage of CD4+T cells before (upper panel) and after (bottom panel) magnetic-activated cell sorting (MACS) detcted by flow cytometry, suggestting that the percentage of CD4+T cells in the PBMCs was 25%~35% before MACS and above 90% after MACS.
图2流式细胞术检测分选前后CD4+T细胞比例
2.3共培养体系细胞形态学特征CD4+T淋巴细胞呈悬浮状态,不贴壁,为均匀透亮的圆形细胞;hASCs为长梭形的贴壁细胞;共培养第2天开始观察,淋巴细胞活化后形态发生变化,体积逐渐变大,数量增多;hASCs仍贴壁生长,体积增大,见图3。
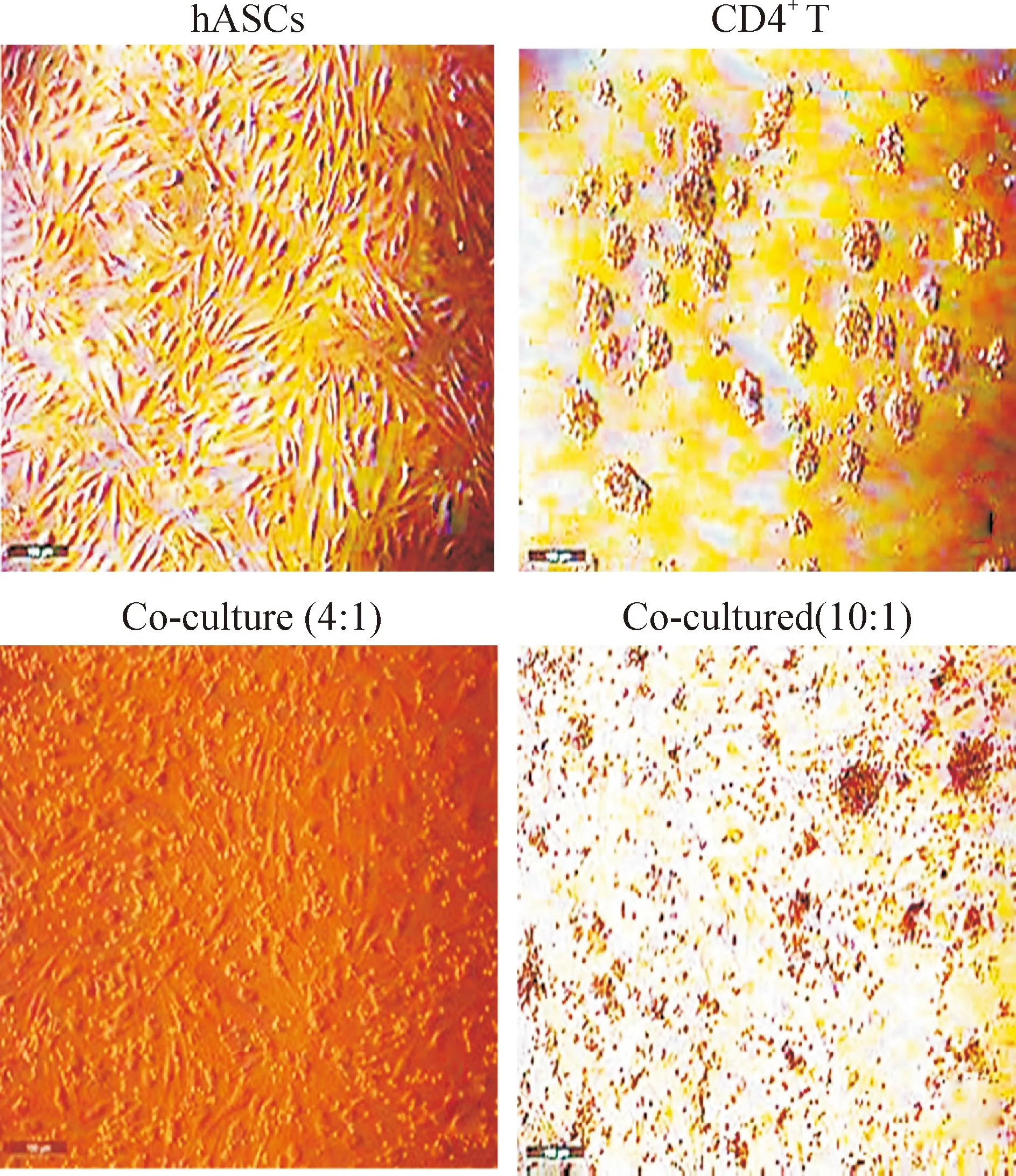
Figure 3.The images of cultured hASCs, CD4+T cells as control groups and co-cultured CD4+T cells with hASCs in the ratio of 4∶1 or 10∶1.
图3对照组与实验组细胞形态观察
2.4hASCs对Th17细胞的抑制作用共培养4 d后,流式细胞术分别检测实验组和对照组中Th17细胞(IL-17A+CD4+)占CD4+T细胞的比例。对照组Th17细胞的比例为(10.99±2.33)%,实验组中hASCs∶CD4+T为1∶4组Th17细胞的比例为(6.64±2.74)%,1∶10组Th17细胞的比例为(8.03±2.27)%。其中1∶4组、1∶10组与对照组相比,差异有统计学意义(P<0.01),实验组中1∶4组与1∶10组的Th17细胞比例差异有统计学意义(P<0.05)。结果表明hASCs抑制Th17细胞的分化,且hASCs所占比例越大,抑制作用越明显,呈浓度依赖性,见图4。

Figure 4.Flow cytometry was used to analyze the proportion of Th17 (IL-17A+CD4+) cells in each group. The numbers represents the percentage of double-positive cells. Mean±SD.n=4.**P<0.01vs0;△P<0.05vs1∶4.
图4流式细胞术检测实验组和对照组Th17细胞的比例
2.5Real-time PCR检测IL-6R、RORγt、IL-23R、LIFR和LIF的mRNA表达与hASCs共培养后,1∶4组和1∶10组的CD4+T细胞中IL-6R、IL-23R和RORγt的mRNA表达量均较对照组降低;而LIFR的mRNA表达量较对照组升高(P<0.01)。共培养后的1∶4组和1∶10组的hASCs中LIF的mRNA表达量较不参与共培养的hASCs显著升高(P<0.01)。IL-6R、RORγt、IL-23R、LIFR和LIF的mRNA表达在1∶4与1∶10实验组间差异无统计学意义(P>0.05),见图5。
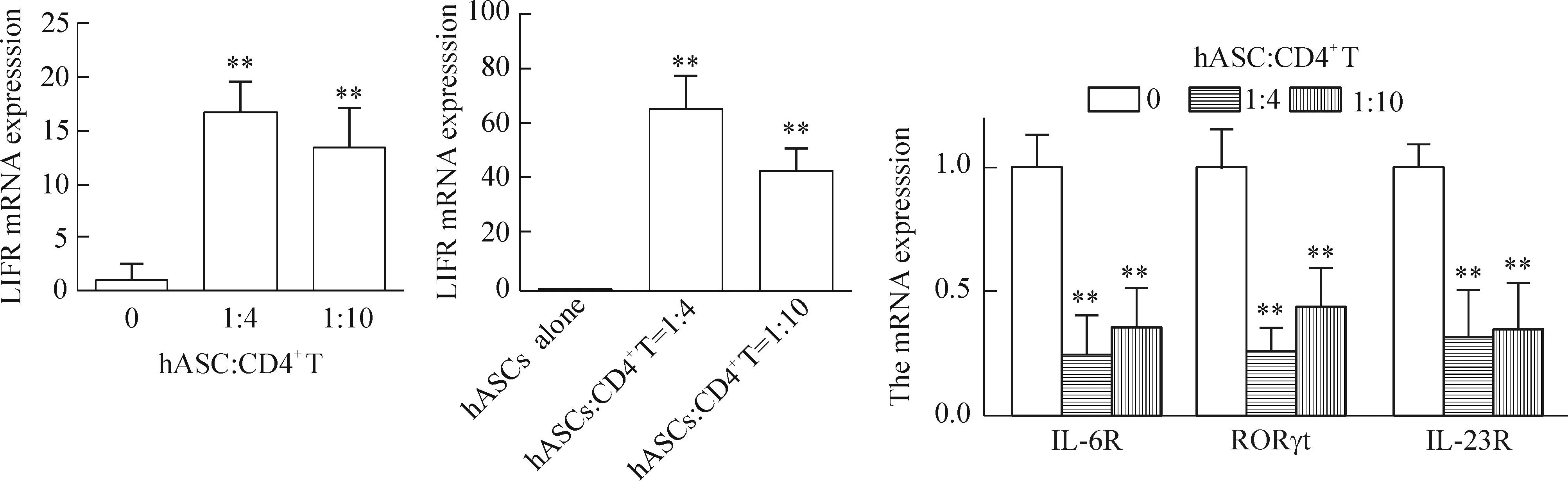
Figure 5.Real-time PCR was used to detect the mRNA expression of RORγt, IL-6R, LIFR, IL-23R and LIF in each group.Mean±SD.n=4.**P<0.01vs0 or hASCs alone.
图5Real-time PCR检测LIFR、LIF、IL-6R、 RORγt和IL-23R的mRNA表达水平
3hASCs抑制Th17细胞分化的可能机制
3.1流式细胞术检测各组Th17细胞选择hASCs与CD4+T比例为1∶4的组进行抗体中和实验。共培养4 d 后,取各组细胞用于流式检测,对照组Th17细胞占CD4+T细胞的比例为(12.90±0.40)%,与hASCs共培养组Th17细胞的比例为(7.48±1.14)%,添加anti-LIF组Th17细胞的比例为(13.20±1.04)%;和hASCs共培养组与对照组相比,Th17细胞比例减低,而加入anti-LIF中和LIF后,Th17细胞上调(P<0.01)。结果说明,hASCs能抑制Th17细胞的分化,而anti-LIF则能解除hASCs的抑制作用,见图6。

Figure 6.CD4+T cells were cultured with or without hASCs in the presence or absence of anti-LIF antibody, and flow cytometry was used to determine the proportion of Th17 (IL-17A+CD4+) cells. When the anti-LIF antibody was added into co-culture system, the ratio of Th17 cells increased and reached to the control level. Mean±SD.n=4.**P<0.01vsCD4+T;△△P<0.01vsCD4+T+hASCs.
图6流式细胞术检测Th17细胞占CD4+T细胞的比例情况
3.2ELISA检测各组LIF的分泌水平共培养4 d 后,通过ELISA分别检测对照组(CD4+T组、hASCs组)、与hASCs共培养组(hASCs∶CD4+T为1︰4)和添加anti-LIF组上清液中LIF的分泌,测得CD4+T组中LIF的浓度为(598.68±285.90)ng/L,hASCs组中LIF的浓度为(430.60±317.86)ng/L,与hASCs共培养组中LIF的浓度为(1 049.74±37.26)ng/L,添加anti-LIF组LIF的浓度为(103.76±67.85)ng/L;与hASCs共培养组分泌的LIF与对照组相比明显增多,加anti-LIF中和LIF后,LIF分泌量较与hASCs共培养组明显下降,差异有统计学意义(P<0.05),见图7。
3.3Real-time PCR检测RORγt和IL-6R的mRNA表达Real-time PCR结果显示,与对照组相比,hASCs共培养组中 RORγt的mRNA的表达量下降,差异有统计学显著性(P<0.01);加anti-LIF后,RORγt的mRNA表达水平上调,与对照组相比,差异无统计学意义。与对照组相比,与hASCs共培养组中IL-6R mRNA的表达量减低(P<0.01);加anti-LIF后,IL-6R的mRNA表达水平上调,与对照组相比,差异无统计学意义,见图7。

Figure 7.The level of LIF in the supernatant and the mRNA expression of IL-6R and RORγt were tested by ELISA and real-time PCR, respectively. Mean±SD.n=4.**P<0.01vsCD4+T;△P<0.05,△△P<0.01vsCD4+T+hASCs.
图7各组LIF的分泌水平及RORγt和IL-6R的mRNA表达情况
讨论
近年来成体干细胞-间充质干细胞的免疫调节功能被越来越多地认识和研究,成为当今热门的学科。相对于骨髓MSCs来讲,hASCs可以避免取材带来的痛苦;hADSs来源相对丰富,且取材方便,体外分离和培养方法成熟;hASCs较骨髓来源的MSCs有更强大的体外克隆能力,因此脂肪间充质干细胞作为理想种子细胞应用于临床治疗具有良好医学前景。Najar等[6]研究证明hASCs相较MSCs具有更强的免疫调节效应,其调节能力涉及多种免疫细胞,包括抑制T淋巴细胞、B淋巴细胞、NK细胞的免疫效应,并且诱导免疫耐受等[3],目前hASCs被视为治疗多种自身免疫疾病如MS、移植物抗宿主病、类风湿性关节炎等较为理想的细胞[7]。Th17细胞亚群是MS免疫反应和髓鞘脱失最主要的效应细胞,IL-17A是Th17细胞分泌的主要炎症因子,因此,抑制Th17细胞介导的炎症反应是治疗MS的关键突破。黄雪琼等[8]研究发现MSCs能抑制CD4+T细胞亚群向Th17方向分化,纠正Th17/Treg 失衡。本实验通过体外分离、纯化hASCs,实现在体外扩增,再通过体外实验证明hASCs能抑制CD4+T细胞向Th17细胞分化的免疫调节并探索其可能的机制。流式细胞技术检测hASCs的表面分子,均高表达CD44、CD105、CD29和CD73,这些是基质细胞基本的表面标志分子;而内皮祖细胞的表面标记分子CD31表达很低,HLA-DR几乎无表达[9],可基本判断为hASCs,这为后续实验的准确和可靠性提供了保障。
Th17细胞亚群是初始CD4+T细胞在 TGF-β、IL-6和IL-21协同刺激下,激活STAT3磷酸化,进而激活标志性转录因子RORγt后分化产生, RORγt诱导IL-17A和IL-17E的表达,促进Th17分化,且Th17细胞的扩增需要IL-23维持[10]。而TGF-β和IL-6同时存在是可以大量诱导RORγt的表达,进一步诱导IL-17A和IL-17E的产生,加重炎症和自身免疫反应。Th17细胞分泌独特的促炎因子IL-17A、IL-17F、IL-21和IL-22,IL-17是Th17细胞分泌导致MS炎症损伤最主要的炎症介质。因此,抑制Th17细胞介导的炎症反应是治疗MS的关键突破。本研究通过体外实验证明hASCs能抑制CD4+T细胞向Th17细胞分化,这种抑制作用存在高浓度抑制效应,即加入的hASCs比例越大,抑制作用越明显。Najar等[6]在hASCs对T淋巴细胞增殖的抑制作用实验中认为,hASCs∶T为1∶20时,无抑制作用,这将为hASCs用于体内实验和移植治疗的剂量选择做一参考。
本实验研究发现加入hASCs后RORγt mRNA表达减少,这表明hASCs可减少Th17特异性转录因子RORγt表达,并且伴随IL-6R和IL-23R的mRNA表达水平下调,但LIFR的mRNA表达水平升高;然而基因水平的改变与hASCs浓度并无明显关系,这表明Th17抑制减低可能与RORγt、IL-6R、IL-23R和LIFR改变相关。本研究结果发现了hASCs使CD4+T细胞的IL-6R mRNA表达水平下调而LIFR mRNA表达水平上调的结果,据此我们进一步探索hASCs可能的免疫调节机制。
LIF是hASCs分泌的可溶性细胞因子, hASCs可通过分泌LIF抑制淋巴细胞增殖[6],但是hASCs抑制Th17细胞分化的机制是否与分泌LIF有关,尚缺乏相关报道。本研究显示,hASCs与CD4+T细胞共培养组中,LIF的分泌量较对照组(CD4+T组、hASCs)明显升高,加入可溶性中和抗体anti-LIF中和LIF后,LIF浓度下降,与此同时,hASCs对Th17细胞分化的抑制作用亦解除。我们通过real-time PCR进一步从分子水平检测 RORγt和IL-6R的表达水平,发现人Th17细胞特异性的转录因子 RORγt及IL-6R的mRNA表达与Th17细胞比例水平一致,随着LIF分泌的增多,IL-6R表达受抑制,当中和LIF后,IL-6R的表达水平上升。LIF是一种多功能的细胞因子,属于IL-6家族中的成员,gp130受体是IL-6家族成员信号转导通路的基本亚单位,IL-6R是由gp130组成的二聚体,LIF受体则是由gp130/gp190组成的异物二聚体,在特定环境下,IL-6和LIF通过相互竞争受体而拮抗对方的效应[11]。研究表明,LIF是体内一种重要的免疫负调因子,LIF基因敲除鼠的皮炎严重程度远远高于正常鼠,而慢病毒携带LIF转染小鼠后,症状明显减轻,这与早期的研究认为LIF治疗可减少同种异体皮肤移植的免疫排斥反应是相一致的[12]。体外研究认为LIF诱导初始CD4+T细胞向Foxp3+Treg细胞分化,发挥免疫耐受作用,而IL-6是重要的促炎因子,诱导初始CD4+T细胞向Th17细胞分化,是MS、类风湿性关节炎等自身免疫性疾病的重要炎症因子[13]。IL-6/LIF轴与Th17细胞和Treg细胞的分化密切相关,IL-6与IL-1β、IL-23共同参与促进Th17细胞分化,LIF则单独参与激活Treg细胞特异性的转录因子Foxp3,促进Treg细胞的分化。利用IL-6/LIF轴在治疗MS等自身免疫性疾病中取得了重大突破。本研究认为hASCs通过分泌LIF,作用于CD4+T细胞表面的LIFR受体,与IL-6受体IL-6R相互拮抗,从而抑制CD4+T细胞向Th17细胞分化。但是,LIF是否通过增加Treg细胞的表达从而抑制Th17细胞,未来可进一步深入研究。
本实验成功分离、纯化及鉴定了hASCs,建立了免疫磁珠法分选外周血,成功获得高纯度CD4+T细胞作为后续研究。体外开展的hASCs和CD4+T细胞共培养证明了hASCs可以抑制MS患者Th17细胞分化,机制可能与其分泌LIF,通过IL-6/ LIF轴竞争性抑制有关。利用hASCs的免疫调节作用可以降低MS的Th17细胞分化,改善免疫炎症。已有研究发现骨髓MSCs在MS动物模型和临床试验中已初显成效,对MS有一定治疗作用[14]。运用hASCs移植来治疗MS患者将会有广阔的临床应用前景。
[参考文献]
[1]Axtell RC, de Jong BC, Boniface K, et al. T helper type 1 and 17 cells determine efficacy of interferon-β in multiple sclerosis and experimental encephalomyelitis[J]. Nat Med, 2010, 16(4):406-412.
[2]Uccelli A, Laroni A, Freedman MS. Mesenchymal stem cells for the treatment of multiple sclerosis and other neurological diseases[J]. Lancet Neurol, 2011, 10(7):649-656.
[3]Akiyama K, Chen C, Wang DD, et al. Mesenchymal-stem-cell-induced immunoregulation involves FAS-ligand-/FAS-mediated T cell apoptosis[J]. Cell Stem Cell, 2012, 10(5):544-555.
[4]English K. Mechanisms of mesenchymal stromal cell immunomodulation[J]. Immunol Cell Biol, 2013, 91(1):19-26.
[5]Gao W, Thompson L, Zhou Q, et al. Treg versus Th17 lymphocyte lineages are cross-regulated by LIF versus IL-6[J]. Cell Cycle, 2009, 8(9):1444-1450.
[6]Najar M, Raicevic G, Boufker HI, et al. Adipose-tissue-derived and Wharton′s Jelly-derived mesenchymal stromal cells suppress lymphocyte responses by secreting leukemia inhibitory factor[J]. Tissue Eng Part A, 2010, 16(11): 3537-3546.
[7]Gruber HE, Deepe R, Hoelscher GL, et al. Human adipose-derived mesenchymal stem cells: direction to a phenotype sharing similarities with the disc, gene expression profiling, and coculture with human annulus cells[J]. Tissue Eng Part A, 2010, 16(9):2843-2860.
[8]黄雪琼,檀卫平,吴葆菁,等. 骨髓间充质干细胞对重症哮喘患儿外周血 Th17/Treg的免疫调节作用[J]. 中国病理生理杂志, 2014, 30(9):1694-1697,1702.
[9]Mitchell JB,McIntosh K,Zvonic S,et al. Immunophenotype of human adipose-derived cells: temporal changes in stromal-associated and stem cell-associated markers[J]. Stem Cells, 2006, 24(2):376-385.
[10]Zhu JF,Yamane H, Paul WE. Differentiation of effector CD4+T cell population[J]. Annu Rev Immunol, 2010, 28:445-489.
[11]Metcalfe SM. LIF in the regulation of T-cell fate and as a potential therapeutic[J]. Genes Immun, 2011, 12(3):157-168.
[12]Zhu M, Oishi K, Lee SC, et al. Studies using leukemia inhibitory factor (LIF) knockout mice and a LIF adenoviral vector demonstrate a keyanti-inflammatory role for this cytokine in cutaneous inflammation[J]. J Immunol, 2001, 166(3):2049-2054.
[13]Bettelli E, Carrier Y, Gao W, et al. Reciprocal developmental pathways for the generation of pathogenic effector TH17 and regulatory T cells[J]. Nature, 2006, 441(7090):235-238.
[14]郝飞,梁战华,李爱萍,等. 骨髓间充质干细胞应用于多发性硬化的基础及临床研究进展[J]. 中国病理生理杂志, 2014, 21(2):134-137.
(责任编辑: 林白霜, 罗森)
Adipose-derived stem cells mediate immunosuppression of Th17 in multiple sclerosis
LIN Xiao-bin1, CHEN Ying2, YANY De-hao2, XIE Yong-lin3, BI Yong2, KE Jian-ming2, CHEN Zhi-bo2, SU Zhong-qian2, LI Xiang2, ZHANG Xu2
(1DepartmentofUltrasound,2DepartmentofNeurology,TheFirstAffiliatedHospital,WenzhouMedicalUniversity,Wenzhou325000,China;3DepartmentofRehabilitation,ZhejiangProvincialHospitalofChineseArmedPoliceForce,Hangzhou310000,China.E-mail:drzhangxu@live.cn)
[ABSTRACT]AIM: To investigate how human adipose-derived stem cells (hASCs) regulates the differentiation of Th17 cells in multiple sclerosis. METHODS: hASCs were isolated from the adipose tissues. Magnetic-activated cell sorting (MACS) kit was used to isolate CD4+ T cells from peripheral blood mononuclear cells (PBMCs) which were isolated by density gradient centrifugation. The percentage of CD4+ T cells was detected by flow cytometry. The activated CD4+ T cells were co-cultured with hASCs for about 4 d at different ratios of hASCs to CD4+ T cells (1∶4 and 1∶10) in a Th17 polarised condition. Another group adding anti-leukemia inhibitory factor (LIF) antibody was set up. Th17 cell proportion of the CD4+ T cells was determined by flow cytometry. The level of LIF in the supernatant of co-cultured system was measured by ELISA. The mRNA expression of retinoid-related orphan receptor γt (RORγt), interleukin-6 receptor (IL-6R), interleukin-23 receptor (IL-23R), LIF and leukemia inhibitory factor receptor (LIFR) was detected by real-time PCR. RESULTS: The result of flow cytometry suggested there were mainly hASCs, and the percentage of CD4+ T cells in the PBMCs were above 90% after MACS. The Th17 cell proportion decreased in 1∶4 and 1∶10 co-cultured groups in a dose-dependent manner. The mRNA expression of IL-6R, IL-23R and RORγt was downregulated and the expression of LIFR and LIF was up-regulated. When the anti-LIF was added into the co-cultured system, the ratio of Th17 cells increased and reached to the control level. The protein level of LIF obviously increased after co-cultured. After anti-LIF added, the mRNA expression of RORγt and IL-6R was up-regulated. CONCLUSION: hASCs inhibits the differentiation of Th17 cells from multiple sclerosis patients through the competitive inhibition of LIF/IL-6 by secreting LIF.
[KEY WORDS]Multiple sclerosis; Adipose-derived stem cells; Th17 cells; Leukemia inhibitory factor; Interleukin-6
[文章编号]1000- 4718(2016)01- 0051- 07
[收稿日期]2015- 07- 13[修回日期] 2015- 10- 08
*[基金项目]浙江省自然科学基金资助项目(No. LY14H130002; No. LY13H090010);温州市科技计划(No. Y20140278)
通讯作者△Tel: 0577-55579372; E-mail: drzhangxu@live.cn
[中图分类号]R741.05
[文献标志码]A
doi:10.3969/j.issn.1000- 4718.2016.01.009

