小鼠iPSCs诱导分化为胰岛素分泌细胞及治疗糖尿病的实验研究*
任丽伟, 魏 培, 杨晓菲, 杨 璐, 邓春艳, 齐 晖, 李富荣△
(1暨南大学第二临床医学院,深圳市人民医院干细胞与细胞治疗重点实验室,广东 深圳 518020; 2暨南大学医学院,广东 广州 510632)
小鼠iPSCs诱导分化为胰岛素分泌细胞及治疗糖尿病的实验研究*
任丽伟1, 2,魏培1,杨晓菲1, 2,杨璐1, 2,邓春艳1,齐晖1,李富荣1△
(1暨南大学第二临床医学院,深圳市人民医院干细胞与细胞治疗重点实验室,广东 深圳 518020;2暨南大学医学院,广东 广州 510632)
[摘要]目的: 利用3步法诱导方案,使小鼠诱导多能干细胞(induced pluripotent stem cells,iPSCs)分化为胰岛素分泌细胞(insulin-producing cells,IPCs),观察诱导效率和成熟度,并观察其对糖尿病小鼠治疗效果。方法: 本实验室通过piggyBac转座子将C57/C雄性小鼠来源胚胎成纤维细胞(mouse embryonic fibroblasts,MEFs)构建为小鼠iPSCs,利用3步法诱导方案分化为IPCs,观察细胞分化过程中的形态变化;RT-PCR和免疫荧光检测其胰岛β细胞发育相关基因和蛋白的表达;流式细胞术分析分化效率;葡萄糖刺激实验检测胰岛素和C肽分泌水平。将IPCs移植入C57/C雄性糖尿病小鼠模型左肾包膜下,监测血糖和血清中胰岛素含量28 d,观察逆转高糖血症的效果。结果: 建立的3步诱导方案可以将小鼠iPSCs诱导分化为IPCs,其表达胰岛β细胞的标志性基因(Pdx1、Ngn3、Pax6和Ins2)和蛋白(Pdx1、Nkx6.1和胰岛素),在葡萄糖刺激下可分泌胰岛素和C肽。流式细胞术结果表明诱导分化的效率达28%。移植后3 d糖尿病小鼠血糖即降低至接近正常水平,血清胰岛素含量明显升高,对葡萄糖的调控能力明显增强。病理学观察IPCs细胞移植28 d后仍存活。结论: 建立的3步诱导法可将iPSCs高效定向诱导分化为IPCs,明显缩短了诱导分化的时间,移植至近交系同性别小鼠体内可逆转糖尿病的高糖血症。
[关键词]诱导多能干细胞; 胰岛素分泌细胞; 糖尿病
Ⅰ型糖尿病是一种以胰岛β细胞受损为特征的自身免疫性疾病。同种异体胰岛移植被认为是最有可能治愈糖尿病的方法之一[1-2],但移植后的免疫排斥和炎症反应都可能引起移植的胰岛细胞功能丧失[3-4]。新近研究发现的诱导多能干细胞(induced pluripotent stem cells,iPSCs)具有类似胚胎干细胞(embryonic stem cells,ESCs)增殖和分化为特定细胞的能力[5-7]。并有研究验证iPSCs可以诱导分化为胰岛素分泌细胞(insulin-producing cells,IPCs)[8-9]。用iPSCs作为一种胰岛来源细胞,不仅在伦理学上不受限制,并且个体特异来源的iPSCs不会引起免疫排斥反应[10-12],可成为移植治疗糖尿病的理想种子细胞。近年来报道的ESCs和iPSCs诱导分化为胰岛素分泌细胞的方案中,胰岛素阳性细胞展示了一些胰岛细胞的特征,这些细胞大多数释放胰岛素和C肽,表达胰岛转录因子和含有分泌颗粒。然而,这些分化的胰岛素阳性细胞效率低下,成熟度差[8, 13-14]。在此,我们建立了一种3步诱导小鼠iPSCs诱导分化为胰岛素分泌细胞的方法,可明显缩短诱导时间并增加成熟度。经肾包膜下移植糖尿病小鼠模型,可逆转糖尿病小鼠的高糖血症。
材料和方法
1实验材料
1.1动物和细胞Oct4-GFP转基因雄性C57/C小鼠分离胚胎成纤维细胞(mouse embryonic fibroblasts,MEFs),经携带Oct4、c-Myc、Klf4和Sox2的 piggyBac 转座子对MEFs重编程的iPSCs为本实验室构建和鉴定,相关结果未发表。C57/C小鼠(8周龄,雌性),体重18~22 g,购自广东省动物实验中心,饲养于深圳北京大学香港科技大学医学中心动物实验室(SPF级)。动物实验经过本单位伦理委员会批准,对动物处置方法符合动物伦理学要求。
1.2主要试剂和仪器6孔培养板、T25培养瓶、离心管等培养耗材均购自BD;胎牛血清、DMEM/F12、DMEM/H、胰蛋白酶、L-谷氨酰胺和β-巯基乙醇均购自Gibco;总RNA提取试剂TRIzol购自Invitrogen;维甲酸、尼克酰胺和链脲菌素购自Sigma;bFGF、HGF和activin A购自Peprotech;胰岛素ELISA 试剂盒和C肽ELISA 试剂盒购自Mercodia;豚鼠抗鼠胰岛素抗体、兔抗鼠Pdx1抗体和兔抗鼠Nkx6.1抗体均购自Abcam;兔抗小鼠C肽抗体购自Santa Cruz;FITC标记羊抗兔抗体购自Rockland;小鼠胰岛素ELISA试剂盒购自Mercodia。Axiovert 200荧光显微镜和LSM 510激光共聚焦显微镜均为Zeiss产品。血糖仪和血糖试纸为Lifescan产品。
2iPSCs诱导分化为胰岛素分泌细胞
收集培养3 d左右的小鼠iPSCs,将细胞接种到悬浮培养皿内。第1步:诱导为拟胚体4 d,更换培养基(DMEM/F12培养基含10%胎牛血清、双抗工作液、 L-谷氨酰胺、非必须氨基酸和β-巯基乙醇)。48 h后,收集拟胚体,种植在1% Matrigel预先包被的培养皿内,2 h左右更换培养基成分(DMEM/F12培养基,含20%胎牛血清、1%双抗工作液、100 μg/L activin A和非必须氨基酸)继续培养48 h。第2步:诱导为胰腺前体细胞4 d,更换培养基(DMEM/F12培养基,含10%胎牛血清、双抗工作液、10-6mol/L 维甲酸和非必须氨基酸)培养24 h;再更换培养基成分(DMEM/F12,含10% 胎牛血清、双抗工作液、10 μg/L bFGF和非必须氨基酸)培养3 d。第3步:诱导为胰岛素分泌细胞3 d,更换培养基成分(DMEM/F12,含N2 supplement、B27 supplement、50 μg/L HGF、1 mg/L laminin、10 μg/L bFGF、10 mmol/L尼克酰胺、非必需氨基酸和双抗工作液)培养3 d。对细胞形态进行观察,并进行相关鉴定。
3分化的IPCs鉴定
3.1RT-PCR检测胰岛β细胞相关基因的表达取分化的IPCs,弃去培养基,用无菌DEPC水配制预冷的PBS溶液洗涤2次,用TRIzol试剂处理细胞,提取总RNA。按照PrimeScriptTMRT reagent试剂盒说明将RNA反转录为cDNA,进行PCR扩增,将扩增的DNA加样到配制的2%的琼脂糖凝胶中,进行电泳。电泳结束后,取出凝胶拍照。所用引物序列见表1。
3.2免疫荧光检测胰岛素、Pdx1和Nkx6.1蛋白的表达取分化的IPCs玻片加入4%多聚甲醛进行固定,固定10 min;弃去多聚甲醛,用PBS溶液洗涤3次,每次5 min;用透膜封闭液(PBS配制含0.2%的Triton Χ-100和2%BSA)室温孵育30 min;分别加入相应比例稀释 I 抗(抗胰岛素抗体、抗Pdx1抗体和抗Nkx6.1抗体),避光,4 ℃孵育过夜;弃去染色液,用PBS溶液洗涤,加入相应比例稀释的荧光Ⅱ抗,室温孵育60 min;加入1∶200稀释的DAPI溶液,室温孵育5 min;抗淬灭剂封片,荧光显微镜下观察。

表1 引物序列
3.3分化效率检测收集分化的IPCs,调整细胞数为1×109/L,取100 μL细胞悬液,加入兔抗小鼠C肽抗体,4 ℃孵育30 min,PBS洗涤2次,加入FITC标记羊抗兔抗体,室温孵育30 min,1 000 r/min离心5 min,用1%多聚甲醛重悬细胞,流式细胞仪检测细胞C肽表达阳性率。同时设置同型对照管。
3.4葡萄糖刺激实验收集分化后的IPCs,PBS洗涤,调整细胞数为1×109/L, 将1 mL细胞悬液加入24孔培养板,以含5.5 mmol/L葡萄糖(低)或25 mmol/L葡萄糖(高)的DMEM/F12培养液1 mL孵育1 h,收集培养液。成年小鼠胰岛细胞作为对照组。按照小鼠ELISA试剂盒说明检测胰岛素和C肽释放水平。
4IPCs移植治疗糖尿病小鼠模型的疗效观察
4.1小鼠糖尿病模型制备及细胞移植C57/C雄鼠禁食12 h,连续3 d腹腔注射2% 链脲菌素溶液(150 mg/kg),尾静脉采血用血糖仪监测血糖,连续3 d测得血糖浓度大于300 mg/dL为糖尿病小鼠造模成功。糖尿病小鼠随机分为2组:IPCs移植组每只小鼠左肾包膜下注射1×107个IPCs;糖尿病组每只小鼠左肾包膜下注射0.1 mL PBS。另取正常BALB/c小鼠为正常组。
4.2移植后功能学检测移植后每3 d对各组禁食6 h的C57/C小鼠进行断尾取血测血糖;每次随机检测5只小鼠,如果连续2次<250 mg/dL,则定义为血糖正常。在移植后第7、14、21、28天,各组小鼠眶周采血0.5 mL,离心分离血清-20 ℃保存,采用小鼠ELISA法检测血清中胰岛素水平。在移植后第7天和21天,小鼠禁食6~8 h后,腹腔注射10%葡萄糖溶液(2 mg/kg)进行葡萄糖耐量试验。第28天时摘取小鼠左肾,石蜡包埋,组织切片,HE染色,以及免疫组织荧光,观察移植细胞存活以及胰岛素和胰高血糖素表达情况。评价指标至第30天。
5统计学处理
全部数据采用SPSS 13.0统计软件进行统计学分析。所有结果以均数±标准差(mean±SD)表示,组间均数采用单因素方差分析(one-way ANOVA),2组间比较采用独立样本t检验,2组以上的组间比较采用SNK-q检验,以P<0.05为差异有统计学意义。
结果
1小鼠iPSCs诱导分化为IPCs形态学变化
利用建立的3步诱导法,在11 d内将iPSCs诱导分化为IPCs。在诱导小鼠iPSCs分化的过程中,细胞从最初在饲养层细胞上贴壁生长,形成拟胚体后转为悬浮生长,再将其种植在用1% Matrigel预先包被的培养皿内,细胞开始贴壁,并呈现分散趋势进行生长。经过进一步诱导分化,细胞集落从4周开始缓慢铺展开来,出现有上皮样的形态。在诱导分化的最后阶段,细胞呈现类似细胞团样的结构,见图1。
2iPSCs来源的IPCs具有胰岛β细胞特征
在iPSCs诱导分化为IPCs过程中,在第2步和第3步诱导结束时对细胞进行胰岛β细胞发育相关基因与蛋白的检测。PCR的结果显示,在诱导1步结束后细胞表达内胚层细胞的标志基因Sox17,诱导第2、3步细胞表达一些胰岛β细胞标志性基因,包括有胰十二指肠同源盒 1 (pancreatic and duodenal homeobox factor 1,Pdx1)、神经元素 3(neurogenin 3,Ngn3)、配对盒基因 6(paired box gene,Pax6)和前胰岛素原 2 (preproinsulin 2,Ins2),而Sox17的表达,其中Ins2 在第3阶段表达比第2阶段的细胞明显增强。免疫荧光检测诱导分化后的IPCs,也表达β细胞标志性相关蛋白,发现Pdx1(红色)、Nkx6、1(绿色)和insulin(红色)呈阳性,表明分化后的细胞具有表达胰岛素的能力。利用流式细胞术对分化的IPCs检测C肽,发现阳性细胞为28%。葡萄糖刺激实验观察IPCs细胞的成熟度,发现在高低糖刺激下均会分泌胰岛素和C肽,在高糖(25 mmol/L)刺激下胰岛素的分泌量约为低糖(5.5 mmol/L)的4~5倍,C肽的分泌量约为低糖(5.5 mmol/L)的4~5倍,但只有正常小鼠胰岛分泌胰岛素和C肽能力的1/8和1/5。表明建立的3步诱导法分化效率明显提高,但成熟度尚未达到正常胰岛功能。

Figure 1.The strategy and morphological changes during the inducing processes of iPSCs to IPCs. A: the diagrammatic drawing of 3-step method; B: the morphological changes of the inducing processes. a1, a2: iPSCs colonies attached to the plate; b1, b2: embryoid body was formed after suspension culture; c1, c2: the cells of embryoid body were diffused and the morphology was different after cultured in Matrigel-coated plate; d1: the induced cells appeared to be epithelioid; d2: the final morphology of the cells by the 3-step method induction.
图13步法诱导iPSCs为IPCs步骤示意图及此过程中细胞团的形态变化

Figure 2.Identification of insulin-producing cells (IPCs) derived from iPSCs . A: the mRNA expression of Pdx1, Ngn3, Ins2 and Pax6 in different stages detected by RT-PCR; B: flow cytometry detection of C-peptide in the IPCs with the percentages of 28%; C: immunofluorescence staining of iPSC-derived IPCs with antibodies against Pdx1, Nkx6.1 and insulin; D,E: comparison of insulin and C-peptide levels with different concentrations of glucose stimulation detected by ELISA. Mean±SD.n=10.$P<0.05vs0 d group;#P<0.05vs4 d group;&P<0.05vs8 d group;△P<0.05vs11 d group;*P<0.05vs5.5 mmol/L glucose group.
图2经诱导分化的IPCs基因和蛋白表达特点、诱导效率及不同浓度葡萄糖刺激下胰岛素和C肽的分泌水平
3IPCs移植治疗糖尿病实验研究
为了验证IPCs治疗糖尿病模型效果,将IPCs移植到C57/C雄性糖尿病小鼠模型左肾包膜下,发现在移植后第3天血糖开始明显下降,降至160~200 mg/dL水平,并持续维持在此水平,但没有降到正常小鼠的血糖水平,在28 d摘除小鼠左肾后,血糖快速升至糖尿病小鼠的血糖水平。在移植后第7、14、21和28天眼眶采血,检测血清胰岛素水平,发现较糖尿病小鼠明显升高(P<0.05),与血糖水平减低相对应。在移植后第28天进行葡萄糖耐量实验,显示IPCs组小鼠血糖调控能力较糖尿病组明显改善。病理学观察发现移植到小鼠左肾包膜下的IPCs仍存活,没有发生明显排斥反应,仍表达胰岛素,见图3。
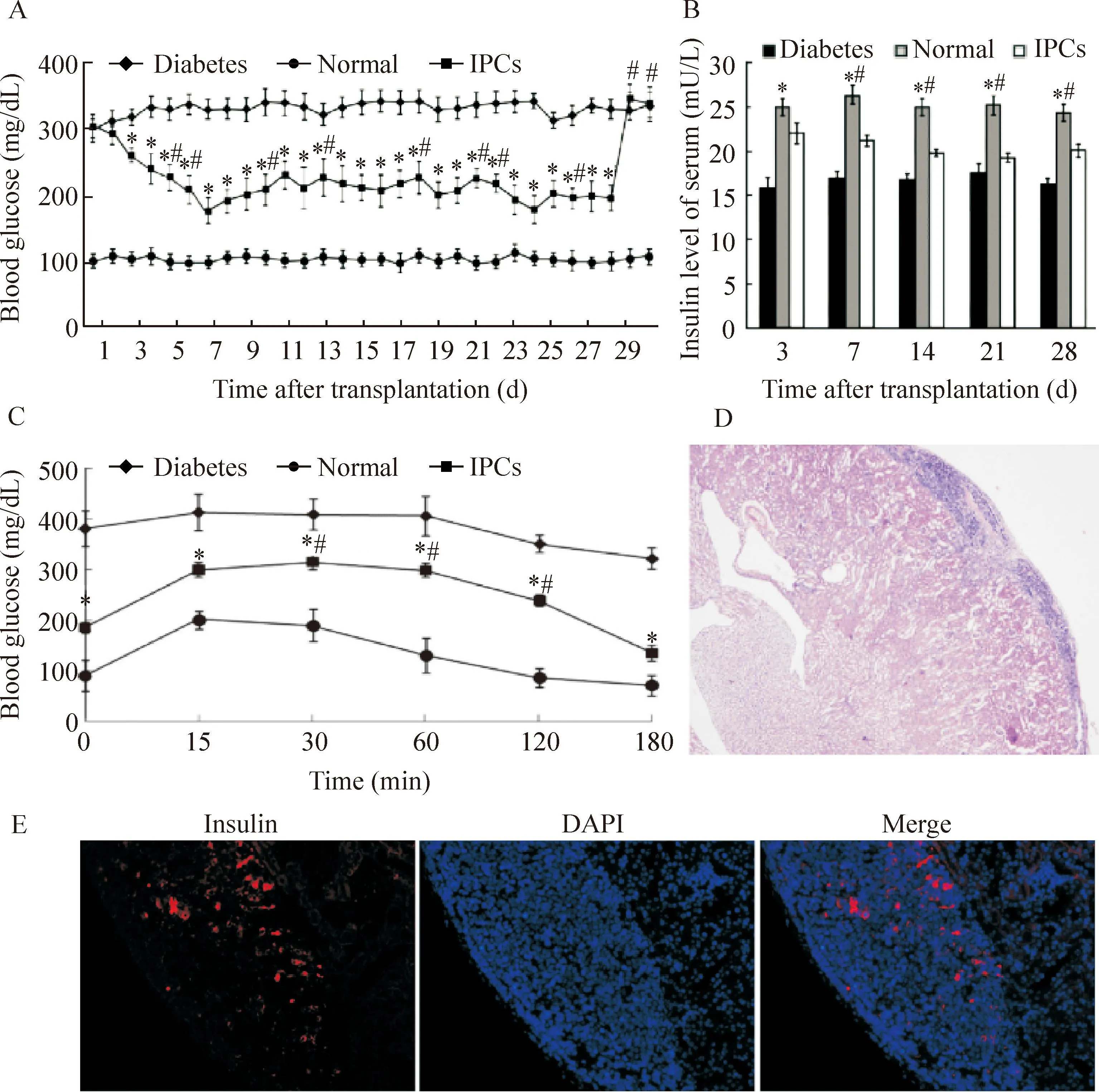
Figure 3.Therapeutic effect of IPCs transplantation on the diabetic mice. A: the changes of blood glucose after IPCs transplantation; B: insulin levels 3, 7, 14, 21 and 28 d after IPCs transplantation detected by ELISA; C: glucose tolerance test of diabetic mice 28 d after IPCs transplantation; D: HE staining showing that IPCs existed under the capsual of removed kidney (×40); E: insulin was still excreted in the transplanted site after 28 d of transplantation (×200). Mean±SD.n=10.*P<0.05vsdiabetes group;#P<0.05vsnormal group.
图3IPCs移植后对糖尿病模型小鼠降糖效果的评价
讨论
研究发现小鼠MEFs来源的iPSCs能够在特定诱导条件下分化为胰岛素分泌细胞,并通过肝门静脉移植入糖尿病小鼠体内,能够控制小鼠的血糖水平和糖化血红蛋白的水平[9]。目前,建立的4步诱导法将IPSCs诱导分化为IPCs时间约为21 d左右[8, 15-16],但仍然存在诱导时间过长,分化效率只有25%,阻碍IPCs在临床研究上的应用。本研究在ESCs和iPSCs诱导分化方案的基础上,建立了一个高效快速地将iPSCs分化为IPCs的诱导方案,即3步法诱导方案。通过流式细胞术检测,诱导分化效率为28%,诱导分化时间为11 d。第1步分化为拟胚体,第2步分化为胰腺祖细胞,第3步分化为胰岛素分泌细胞。由于activin A和维甲酸在诱导胰岛β细胞过程中具有关键作用[16],在第2步缩短了activin A和维甲酸作用的时间间隔,第3 步将laminin、 bFGF 和尼克酰胺同时添加到培养基,使各种因子可以连续作用于分化中的细胞,减少了iPSCs诱导分化为IPCs过程中更换培养基的次数和时间, 最终将iPSCs分化为的IPCs时间缩短到11 d,比原方案节省近一半的时间。
通过3步诱导方案,结果表明每步诱导结束的细胞都表达特定的标记基因,并且在诱导分化最后阶段的IPCs与体内成熟的β细胞相似。首先,用本方案诱导的IPCs表达β细胞的关键转录因子和功能标志蛋白,包括Pdx1、Ngn3、Pax4和Ins2。第二,Pdx1、Nkx6.1和胰岛素的共表达被认为是成熟β细胞的特殊功能标志。第三,诱导最后阶段的IPCs可分泌胰岛素和C肽,并且二者的分泌受葡萄糖的刺激。胰岛素和C肽的含量分别为正常胰岛含量的1/8和1/6。这可能是因为诱导分化最后阶段的细胞中只包含28%的IPCs,所以分化的IPCs与正常胰岛β细胞是相似可比较的。
之后,我们将诱导分化的IPCs移植到同系同性别的糖尿病小鼠模型体内,以进一步评价其在体内的功能。IPCs移植后,糖尿病小鼠模型的血糖快速下降并稳定在160~200 mg/dL,ELISA检测血清中胰岛素水平明显比糖尿病小鼠模型高,说明IPCs在体内具有逆转高血糖症的作用。糖耐量实验也表明,IPCs移植到体内其分泌胰岛素的能力受葡萄糖调控,表明IPCs移植到体内后仍具有分化为成熟胰岛β细胞的特点[17]。
综上所述,我们建立了一个高效快速地将iPSCs诱导分化为成熟IPCs的方案。获得的IPCs展示了成熟β细胞的大多数特点,包括胰岛素和C-肽的分泌受血糖的调控,为利用患者自体细胞构建iPSCs治疗糖尿病奠定了基础。
[参考文献]
[1]Aathira R, Jain V. Advances in management of type 1 diabetes mellitus[J].World J Diabetes, 2014, 5(5):689-696.
[2]Bruni A, Gala-Lopez B, Pepper AR, et al. Islet cell transplantation for the treatment of type 1 diabetes: recent advances and future challenges[J]. Diabetes Metab Syndr Obes, 2014, 7:211-223.
[3]Abreu JR, Roep BO. Immune monitoring of islet and pancreas transplant recipients[J]. Curr Diabetes Rep, 2013, 13(5):704-712.
[4]Kanak MA, Takita M, Kunnathodi F, et al. Inflammatory response in islet transplantation[J]. Int J Endocrinol, 2014, 2014:451035.
[5]Takahashi K, Yamanaka S. Induction of pluripotent stem cells from mouse embryonic and adult fibroblast cultures by defined factors[J]. Cell, 2006, 126(4):663-676.
[6]Yamanaka S. Induced pluripotent stem cells: past, present, and future[J]. Cell Stem Cell, 2012, 10(6):678-684.
[7]Chen P, Chen JZ, Shao CY, et al. Treatment with retinoic acid and lens epithelial cell-conditioned medium directed the differentiation of pluripotent stem cells towards corneal endothelial cell-like cells[J]. Exp Ther Med, 2015, 9(2):351-360.
[8]Zhang D, Jiang W, Liu M, et al. Highly efficient differentiation of human ES cells and iPS cells into mature pancreatic insulin-producing cells[J]. Cell Res, 2009, 19(4):429-438.
[9]Alipioa Z,Liao W,Roemer EJ,et al. Reversal of hyperglycemia in diabetic mouse models using induced-pluripotent stem (iPS)-derived pancreatic beta-like cells[J]. Proc Natl Acad Sci U S A, 2010, 107(30):13426-13431.
[10]Kaneko S, Yamanaka S. To be immunogenic, or not to be: that’s the iPSC question[J]. Cell Stem Cell, 2013, 12(4):385-386.
[11]Guha P, Morgan JW, Mostoslavsky G, et al. Lack of immune response to differentiated cells derived from syngeneic induced pluripotent stem cells[J]. Cell Stem Cell, 2013, 12(4):407-412.
[12]Morizane A, Doi D, Kikuchi T, et al. Direct comparison of autologous and allogeneic transplantation of iPSC-derived neural cells in the brain of a non-human primate[J]. Stem Cell Reports, 2013, 1(4):283-292.
[13]Liu H, Yang H, Zhu D, et al. Systematically labeling developmental stage-specific genes for the study of pancreatic beta-cell differentiation from human embryonic stem cells[J]. Cell Res, 2014, 24(10):1181-1200.
[14]Khorsandi L, Nejad-Dehbashi F, Ahangarpour A, et al. Three-dimensional differentiation of bone marrow-derived mesenchymal stem cells into insulin-producing cells[J]. Tissue Cell, 2015, 47(1):66-72.
[15]Jiang W, Shi Y, Zhao D, et al.Invitroderivation of functional insulin-producing cells from human embryonic stem cells[J]. Cell Res, 2007, 17(4):333-344.
[16]Shi Y, Hou L, Tang F, et al. Inducing embryonic stem cells to differentiate into pancreatic beta cells by a novel three-step approach with activin A and all-transretinoic acid[J]. Stem Cells, 2005, 23(5):656-662.
[17]Pezzolla D, Lopez-Beas J, Lachaud CC, et al. Resveratrol ameliorates the maturation process of beta-cell-like cells obtained from an optimized differentiation protocol of human embryonic stem cells[J]. PLoS One, 2015, 10(3):e0119904.
(责任编辑: 陈妙玲, 罗森)
Differentiation of mouse iPSCs into insulin-producing cells and experimental study on treating diabetes
REN Li-wei1, 2, WEI Pei1, YANG Xiao-fei1, 2, YANG Lu1, 2, DENG Chun-yan1, QI Hui1, LI Fu-rong1
(1TheKeyLaboratoryofStemCellandCellularTherapy,TheSecondClinicalMedicalCollege,ShenzhenPeople’sHospital,JinanUniversity,Shenzhen518020,China;2SchoolofMedicine,JinanUniversity,Guangzhou510632,China.E-mail:frli62@163.com)
[ABSTRACT]AIM: To induce mouse induced pluripotent stem cells (iPSCs) to differentiate into insulin-producing cells (IPCs) by a new 3-step method, and to detect the efficiency and maturity for the treatment of diabetic mice. METHODS: We constructed iPSCs from mouse embryonic fibroblasts of male C57/C mouse by piggyBac transposon, then induced the iPSCs into IPCs by a 3-step method. The cell morphological change was traced by microscopy during the process of differentiation. The expression of mRNA and protein associated with islet β cell development was determined by real-time PCR and immunofluorescence staining. Flow cytometry was used to analysis the efficiency of differentiation. Insulin and C-peptide secretions of IPCs in response to glucose at high (25 mmol/L) or low (5.5 mmol/L) level were measured by ELISA. The IPCs were transplanted into the capsul of left kidney in the male C57/C diabetic mouse model. Blood glucose was continuously monitored for 28 day, serum insulin was tested by ELISA in different stages. The glucose tolerance test was performed on the 28th day, and the left kidney was excised. RESULTS: IPCs were obtained from mouse iPSCs by the 3-step method. The cells expressed the marker genes (Pdx1, Ngn3, Pax6 and Ins2) and proteins (Pdx1, Nkx6.1 and insulin) of β cells. The glucose stimulation induced the secretion of insulin and C-peptide. The efficiency of differentiation was 28% detected by flow cytometry. After transplantation of IPCs to the diabetic mice, the blood glucose was decreased to normal level on the 3rd day,and serum insulin level and the ability of regulating glucose were improved. IPCs were still alive after 28 d of transplantation by pathological observation. CONCLUSION: iPSCs is efficiently induced into IPCs by a 3-step method , and the induction time is shortened significantly. The hyperglycemia of diabetes mice is reversed after transplanting IPCs to same sex inbred strain mice.
[KEY WORDS]Induced pluripotent stem cells; Insulin-producing cells; Diabetes mellitus
[文章编号]1000- 4718(2016)01- 0118- 06
[收稿日期]2015- 03- 23[修回日期] 2015- 11- 11
*[基金项目]国家自然科学基金资助项目(No. 81270857);广东省自然科学基金资助项目(No. S2013010014832);深圳市科技计划(No. GJHZ20120618153934353)
通讯作者△Tel: 0755-25533000-2450; E-mail: frli62@163.com
[中图分类号]R363; R587.1
[文献标志码]A
doi:10.3969/j.issn.1000- 4718.2016.01.020

