低氧预适应对急性脑梗死小鼠血清TNF-α、IL-1β和IL-6炎性反应因子的影响
张巧云 李思颉 牛敬忠 邵 国 吉训明 张颜波*
(1.天津市东丽区万新街社区卫生服务中心,天津 300000;2. 首都医科大学宣武医院低氧医学研究所,北京 100053;3. 泰山医学院附属医院神经内科,山东泰安 271000;4. 包头医学院生物医学研究中心,内蒙古包头 014060)
低氧预适应对急性脑梗死小鼠血清TNF-α、IL-1β和IL-6炎性反应因子的影响
张巧云1李思颉2牛敬忠3邵国4吉训明2张颜波3*
(1.天津市东丽区万新街社区卫生服务中心,天津 300000;2. 首都医科大学宣武医院低氧医学研究所,北京 100053;3. 泰山医学院附属医院神经内科,山东泰安 271000;4. 包头医学院生物医学研究中心,内蒙古包头 014060)
【摘要】目的 探讨低氧预适应对急性脑梗死小鼠保护作用和血清肿瘤坏死因子-α(tumor necrosis factor alpha,TNF-α)、白介素-1β(interleukin-1 beta,IL-1β)和白介素-6(interleukin-6, IL-6)炎性反应因子的影响。方法采用数字表法随机分为正常对照组(normal,N)、假手术组(control,C)、急性脑梗死组(cerebral infarction,CI)和低氧预适应(hypoxic preconditioning,HP)+急性脑梗死组(HP+CI) 4组,每组小鼠6只,共24只。复制低氧预适应和光化学急性脑梗死模型,行为学方法和ELISA法分别检测神经功能缺损评分和TNF-α、IL-1β和IL-6浓度。结果N、C组无神经功能缺损症状;CI、HP+CI组均出现明显神经功能缺损症状,CI、HP+CI组与N、C组相比,神经功能评分明显降低,差异有统计学意义(P<0.05);HP+CI组与CI组相比,神经功能明显改善,差异有统计学意义(P<0.05)。CI、HP+CI组小鼠血清TNF-α、IL-1β和IL-6明显升高,与N、C组相比,差异有统计学意义(P<0.05);HP+CI组与CI组相比,TNF-α、IL-1β和IL-6明显下降,差异有统计学意义(P<0.05)。结论低氧预适应对急性脑梗死具有保护作用,可能与减少TNF-α、IL-1β和IL-6炎性反应因子释放,抑制急性脑梗死后炎性反应有关。
【关键词】低氧预适应;急性脑梗死;神经功能评分;炎性反应因子
急性脑梗死是临床上常见病、多发病,具有较高病死率和致残率,对个人、家庭和社会带来严重负担,因此有效的治疗和康复手段非常重要[1]。急性脑梗死后缺血性脑损伤机制复杂,多因素参与这一复杂病理生理过程,多种炎性反应因子在脑损伤中起重要作用[2-3],其中肿瘤坏死因子-α(tumor necrosis factor alpha,TNF-α)、白介素-1β(interleukin-1 beta,IL-1β)和白介素-6(interleukin-6, IL-6)是常见的炎性反应因子[4-5]。低氧预适应(hypoxic preconditioning, HPC)是一种内源性机体保护机制,可以作为缺血/缺氧性脑损伤一种无创的、有效的治疗手段或方法,具有抑制炎性反应的作用。研究[6]证实HPC对缺血/缺氧性脑损伤具有保护和治疗作用。目前HPC在缺血/缺氧性脑损伤后炎性反应过程中的研究较少,HPC的脑保护作用是否通过抑制TNF-α、IL-1β和IL-6炎性因子起作用,尚不明确。故本研究通过复制小鼠HPC和急性脑梗死模型,观察HPC脑保护作用和对TNF-α、IL-1β和IL-6炎性因子的影响。
1材料与方法
1.1实验试剂及仪器
冷光源(150 W、24 V金属卤化灯),LG-150型,购自徐州恒达光学电子仪器有限公司;5%(质量分数)玫瑰红购自美国Sigma公司;TNF-α、IL-1β和IL-6试剂盒购自北京中杉金桥公司。
1.2实验方法
1.2.1实验动物与分组
清洁级Balb/c近交系小鼠,6~8周龄,体质量18~22 g,雌雄不拘,由首都医科大学动物部提供,实验动物许可证号:SCXK(京)2005-0006。采用数字表法随机分为正常对照组(normal,N)、假手术组(control,C)、急性脑梗死组(cerebral infarction,CI)和低氧预适应(hypoxic preconditioning,HP)+急性脑梗死组(HP+CI) 4组,每组小鼠6只,共24只。
1.2.2HPC模型的建立
将小鼠放入1个125 mL的广口瓶内,按照首都医科大学神经生物研究室既往方法[7]复制HPC模型,N组无任何处理。
1.2.3急性脑梗死模型的制备
低氧预适应模型复制30 min后,按照首都医科大学神经生物研究室既往成熟方法[8],复制光化学法诱导小鼠脑皮质急性脑梗死模型,C组仅行冷光源照射,不注射玫瑰红。
1.2.4小鼠神经功能评定
在急性脑梗死模型复制成功后24 h,按Garcia的6项方法[8]进行小鼠神经功能评分:①自发性活动;②四肢活动对称性;③前肢伸展爬行动作对称性;④笼壁抓力;⑤推躯干反应;⑥触须反应。每项根据神经功能缺损程度不同,评分依次为0~3分,6项评分相加为总分。
1.2.5炎性反应因子检测
神经功能评定后,各组动物断头,经颈动脉取血,离心取血清后,采用ELISA法检测,根据TNF-α、IL-1β和IL-6试剂盒说明书完成:分别将血清或不同浓度标准品(100 μL/孔)加入相应孔中,室温孵育 120 min。洗板5次,加入生物素化抗体工作液 (100 μL/孔),室温孵育60 min。洗板5次,加入酶结合物工作液(100 μL/孔),避光室温孵育20 min。洗板5次,加入显色剂100 μL/孔,避光室温孵育 20 min。加入终止液50 μL/孔,混匀后即刻测量A450值。
1.3统计学方法
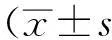
2结果
2.1低氧预适应对急性脑梗死小鼠神经功能的影响
N、C组无神经功能缺损症状。CI、HP+CI组均出现明显神经功能缺损症状,即自发性活动减少,四肢活动不对称,前肢伸展爬行动作不对称,笼壁抓力弱,推躯干反应迟缓,触须反应缓慢。CI、HP+CI组与N、C组相比,神经功能评分明显降低,差异有统计学意义(P<0.01);HP+CI组与CI组相比,神经功能明显改善,差异有统计学意义(P<0.05),详见表1。
2.2低氧预适应对急性脑梗死小鼠血清TNF-α、IL-1β和IL-6的影响
CI、HP+CI组小鼠血清TNF-α、IL-1β和IL-6的水平明显升高,与N、C组相比,差异有统计学意义(P<0.01);HP+CI组与CI组相比,TNF-α、IL-1β和IL-6的水平明显下降,差异有统计学意义(P<0.01),详见表2。
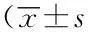
表1 4组小鼠神经功能评分比较
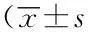
表2 4组小鼠血清细胞因子水平比较
3讨论
众所周知,急性缺血性脑卒中是临床常见的急重症之一,病死率高,致残危险性大,抢救急性脑梗死致脑缺血性损伤是其治疗的关键,积极寻找脑缺血性损伤保护方法或药物是研究的热点。HPC是一种机体内源性保护机制,其通过一系列复杂环节调动机体潜能减轻缺氧损伤,对机体起保护作用[8-9]。在心脏缺血再灌注损伤、脑缺血再灌注、离体神经元及海马脑片培养等模型研究发现,HPC对继发损伤有保护作用。本研究结果表明,HPC能明显增加急性脑梗死神经功能评分,改善脑梗死的预后。目前HPC的神经保护作用机制尚不明确。有研究[10]显示,应用小鼠整体HPC和大脑中动脉阻塞模型(middle cerebral artery occlusion, MCAO)研究HPC对脑缺血性损伤的影响,从新奇型蛋白激酶C(novel PKC,nPKC)膜转位的变化、脑衰蛋白反应调节蛋白-2(collapsin response mediator protein,CRMP-2)磷酸化水平、丝裂原和应激激活蛋白激酶1(mitogen-and stress-activated protein kinase 1,MSK-1)及cAMP反应元件结合蛋白(cAMP responsive element binding protein,CREB)磷酸化水平等方面探讨相应保护机制[11-12],HPC可在一定程度上改善MCAO小鼠的行为学表现,减少梗死面积和水肿程度;进一步研究机制发现,HPC能拮抗梗死区nPKC膜转位水平的降低和皮质缺血核心区内CRMP-2磷酸化水平的降低;减少皮质缺血半暗带内CRMP-2水解片段;提高缺血半暗带内MSK-1及其底物CREB的磷酸化水平,参与MCAO脑损伤的脑保护机制[13-15]。但HPC是否通过抑制急性脑梗死后炎性反应起到脑保护作用,具体机制尚不明确。
中枢神经系统中静止的小胶质细胞在缺血性损伤刺激下激活,在缺血性脑损伤等病理生理过程中释放TNF-α等炎性反应介质,在继发炎性反应中起重要作用[15]。TNF-α可促进星形细胞、内皮细胞产生趋化因子和黏附分子,同时促进IL-1β、IL-6等其他细胞炎性反应因子的释放,进一步加重炎性反应[16]。其中IL-1β反过来可以促进小胶质细胞的激活,进一步分泌炎性反应因子外,还具有自分泌作用,通过这种炎性反应因子的放大循环作用,能加重炎性反应导致的脑损伤,促进神经元凋亡等;IL-6也具有协同TNF-α、IL-1β,增强炎性反应的作用,加重缺血性脑损伤[17]。所以抑制炎性因子进而抑制炎性反应,是改善急性脑梗死预后的重要方法。本研究结果表明,HPC能明显减低急性脑梗死小鼠血清TNF-α、IL-1β和IL-6浓度,具有抑制炎性反应因子释放的作用,可能进一步减轻急性脑梗死损伤炎性反应,起到缺血/缺氧性脑损伤保护作用。
综上,HPC对急性脑梗死具有保护作用,可能与减少TNF-α、IL-1β和IL-6炎性反应因子释放,抑制急性脑梗死后炎性反应有关。但上述细胞因子的下游信号通路,还需要进一步研究。
4参考文献
[1]Kotur-Stevuljevic J, Bogavac-Stanojevic N, Jelic-Ivanovic Z, et al. Oxidative stress and paraoxonase 1 status in acute ischemic stroke patients[J]. Atherosclerosis,2015, 241(1):192-198.
[2]Jiang Y, Li L, Liu B, et al. PPARγ upregulation induced by vagus nerve stimulation exerts anti-inflammatory effect in cerebral ischemia/reperfusion rats[J].Med Sci Monit,2015,21:268-275.
[3]Doll D N, Rellick S L, Barr T L, et al. Rapid mitochondrial dysfunction mediates TNF-alpha-induced neurotoxicity[J]. J Neurochem,2015,132(4):443-451.
[4]Liu H, Wei X, Kong L, et al. NOD2 is involved in the inflammatory response after cerebral ischemia-reperfusion injury and triggers NADPH oxidase 2-derived reactive oxygen species[J]. Int J Biol Sci,2015,11(5):525-535.
[5]Dziedzic T. Systemic inflammation as a therapeutic target in acute ischemic stroke[J]. Expert Rev Neurother,2015,15(5):523-531.
[6]苏芳, 朱雨岚,郭安臣,等. 脑缺血预适应标志物的评估[J].中国卒中杂志,2015,10(2):147-152.
[7]Zhang Y B, Wang X, Meister E A,et al. The effects of CoCl2on HIF-1α protein under experimental conditions of autoprogressive hypoxia using mouse models[J].Int J Mol Sci,2014,15(6):10999-11012.
[8]Li S, Zhang Y, Shao G, et al. Hypoxic preconditioning stimulates angiogenesis in ischemic penumbra after acute cerebral infarction[J]. Neural Regen Res,2013,8(31):2895-2903.
[9]Shao G, Lu G W. Hypoxic preconditioning in an autohypoxic animal model[J]. Neurosci Bull,2012,28(3):316-320.
[10]侯伟健, 佟浩,柏树令,等. 动物低氧实验箱自动控制系统的组建及其在缺氧缺血脑损伤动物模型制作中的应用[J]. 中国医科大学学报,2013,42(2):138-142.
[11]韩松, 张楠,尹艳玲,等. 蛋白激酶Cγ在低氧预适应脑保护中的作用及其缺血性卒中鼠脑半影区内相互作用蛋白鉴定[J]. 首都医科大学学报,2013,34(5):698-703.
[12]胡瑞, 张晓云,晏雪,等. 脑出血后炎性反应机制的研究进展[J]. 中国脑血管病杂志,2015,12(7):370-374.
[13]王鹏成, 任长虹,季泰令,等. 缺血性卒中后血管新生的研究进展[J]. 中国脑血管病杂志,2014,11(6):325-328.
[14]刘云, 高晓莹,戚思华. 缺血后处理脑保护作用的研究进展[J]. 中国脑血管病杂志,2015,12(3):160-164.
[15]Tremblay M, Stevens B, Sierra A, et al. The role of microglia in the healthy brain[J]. J Neurosci,2011,31(45):16064-16069.
[16]Wake H, Moorhouse A J, Nabekura J. Functions of microglia in the central nervous system-beyond the immune response[J]. Neuron Glia Biol,2011,7(1):47-53.
[17]Street M E, Miraki-Moud F, Sanderson I R, et al. Interleukin-1beta (IL-1beta) and IL-6 modulate insulin-like growth factor-binding protein (IGFBP) secretion in colon cancer epithelial (Caco-2) cells[J]. J Endocrinol,2003,179(3):405-415.
编辑慕萌
Effect of hypoxic preconditioning on the serum levels of TNF-α,IL-1β and IL-6 in mice with acute cerebral infarction
Zhang Qiaoyun1, Li Sijie2, Niu Jingzhong3, Shao Guo4, Ji Xunming2, Zhang Yanbo3*
(1.WanxinjieCommunityHealthCentre,DongliDistrictofTianjin,Tianjin300000,China; 2.InstituteforHypoxiaMedicine,XuanwuHospital,CapitalMedicalUniversity,Beijing100069,China;3.DepartmentofNeurology,AffiliatedHospitaltoTaishanMedicalUniversity,Taian271000,ShandongProvince,China; 4.BiomedicalResearchCenter,BaotouMedicalCollege,Baotou014060,InnerMonguliaAutonomousRegion,China)
【Abstract】ObjectiveTo investigate the effect of hypoxic preconditioning on the serum levels of tumor necrosis factor alpha(TNF-α), interleukin-1 beta(IL-1β) and interleukin-6 (IL-6)in rats with acute cerebral infarction.MethodsTwenty-four rats were randomly divided into the four groups: normal control group(normal,N), sham operation group(control,C), acute cerebral infarction group(cerebral infarction,CI), hypoxic preconditioning(hypoxic preconditioning,HP) and acute cerebral infarction group(HP+CI), with 6 rats in each group. Models of hypoxic preconditioning and photochemical acute cerebral infarction were duplicated.Behavioral method and ELISA were used to respectively measure neurological deficit scores and the levels of TNF-α, IL-1β and IL-6.ResultsNo symptom of neurological deficit is shown in group N and C,while it showed up in group CI and HP+CI. The neurological scores in group CI and HP+CI decreased more clearly than those in group N and C (P<0.05). The neurological scores in group HP+CI improved significantly than those in group CI (P<0.05). The serum levels of TNF-α, IL-1β and IL-6 in group CI and HP+CI increased significantly than those in group N and C (P<0.05). The serum levels of TNF-α, IL-1β and IL-6 in group HP+CI decreased more clearly than those in group CI (P<0.05).ConclusionHypoxic preconditioning, can protect animals from acute cerebral infarction and the protection may related to inhibition of inflammatory reaction (subsequent to acute cerebral infarction) induced by the decrease in release of TNF-α, IL-1β and IL-6.
【Key words】hypoxic preconditioning; acute cerebral infarction; neurological function scoring; inflammatory cytokine
(收稿日期:2015-06-11)
【中图分类号】R 743
[doi:10.3969/j.issn.1006-7795.2016.01.017]
*Corresponding author, E-mail:bbnnbn@163.com
基金项目:低氧预适应转化医学北京市重点实验室开放研究课题(2015DYSY02)。This study was supported by Open Research Project of Beijing Key Laboratory for Hypoxic Preconditioning and Translational Medicine(2015DYSY02).
网络出版时间:2016-01-2718∶00网络出版地址:http://www.cnki.net/kcms/detail/11.3662.R.20160127.1800.018.html
· 基础研究 ·

