激活大麻素受体1诱导的单核巨噬细胞J774A.1的迁移依赖RNA结合蛋白HuR
赵中新 常 娜 盖菁菁 田 蕾 李丽英
(首都医科大学基础医学院细胞生物学系‘肝脏保护与再生调节’北京市重点实验室,北京 100069)
激活大麻素受体1诱导的单核巨噬细胞J774A.1的迁移依赖RNA结合蛋白HuR
赵中新常娜盖菁菁田蕾李丽英*
(首都医科大学基础医学院细胞生物学系‘肝脏保护与再生调节’北京市重点实验室,北京 100069)
【摘要】目的研究大麻素受体1(cannabinoid receptor 1, CB1)在单核巨噬细胞迁移中的重要作用以及RNA结合蛋白人抗原R (human antigen R, HuR)参与其中的可能机制。方法选用单核巨噬细胞系J774A.1,应用琼脂糖凝胶电泳和免疫荧光染色技术鉴定J774A.1中CB1以及HuR的表达;ACEA和AM281分别为CB1的药理学激动剂和拮抗剂,应用Boyden chamber法检测ACEA和AM281对J774A.1迁移活性的影响。HuR的基因干扰用于确定激活CB1诱导的J774A.1迁移功能是否依赖HuR;胞质蛋白的分离用于探究激活CB1是否能引起J774A.1胞质中HuR的富集;RT-qPCR和Western blotting法检测CB1和HuR mRNA和蛋白质的变化情况。结果该研究证明J774A.1在基因和蛋白质水平上均表达CB1和HuR;激活CB1能够促进J774A.1的迁移(P<0.01)并且能够被其药理学拮抗剂AM281所抑制;激活CB1诱导的J774A.1的迁移依赖HuR;激活CB1促进了J774A.1胞质中HuR的富集进一步影响了CB1的表达,由此HuR参与了激活CB1诱导的J774A.1的迁移。结论激活CB1能够诱导单核巨噬细胞系J774A.1的迁移,且此过程依赖RNA结合蛋白HuR。
【关键词】人抗原R;大麻素受体1;细胞迁移
内源性大麻素是一种酰胺、酯类和长链不饱和脂肪酸组成的脂质分子,在神经退行性病变、疼痛和抑郁、心血管系统疾病、肥胖和能量代谢性等疾病中发挥重要的作用[1-3]。大麻素受体是七次跨膜的G蛋白偶联受体,能够介导大麻素的多种生物学效应。大麻素受体1(cannabinoid receptor 1, CB1)是内源性大麻素物质花生四烯酸乙醇胺(anandamide, AEA)的受体。目前已有文献[4-5]报道CB1 能够介导多种细胞的迁移,CB1在体外可以通过PI3K-Akt通路介导子宫内膜基质细胞的迁移,CB1还可以介导人胚肾293细胞的迁移。然而CB1是否介导单核巨噬细胞的迁移还不清楚。
人抗原R (human antigen R, HuR)是胚胎致死异常视觉(embryonic lethal abnormal vision, ELAVL)蛋白家族中的一员,广泛表达在各种组织和细胞中,是最为典型的RNA结合蛋白。正常情况下,HuR主要定位于细胞核中,而发挥功能主要在细胞质中[6]。HuR通过与特定的靶mRNA结合,影响细胞的生长与分化、细胞代谢、细胞迁移以及细胞凋亡等生理进程。但HuR是否影响单核巨噬细胞的迁移却还不清楚。因此本研究拟采用小鼠单核巨噬细胞系J774A.1为研究对象,以CB1和HuR为靶分子,以此探讨激活CB1对J774A.1迁移的影响以及HuR参与其中的可能机制。
1材料与方法
1.1 实验材料
小鼠单核巨噬细胞J774A.1细胞株购自中国医学科学院基础医学研究所细胞资源中心细胞库。
1.2 试剂及仪器
DMEM 培养基、Opti-MEM培养基(Gibco 公司,美国);胎牛血清(Excell公司,中国);ACEA和 AM281(TOCRIS/R&D公司,美国);兔抗CB1多克隆抗体(Cayman Chemical公司, 美国),抗HuR单克隆抗体(Santa Cruz公司,美国),抗β-Tubulin 单克隆抗体(全式金公司,中国);山羊抗鼠二抗(CST公司,美国)。FITC标记的二抗(Jackson Immunoresearch公司,美国);Lipofectamine RNAiMAX(Invitrogen公司,美国);Boyden chamber(BD公司,美国);RNeasy Mimi Kit(Quagen公司,德国);M-MLV反转录试剂盒(Invitrogen公司,美国);SYBR Green PCR Master Mix, Taqman Universal PCR Master Mix(ABI公司,美国)。
德国 Heraeus 公司CO2培养箱 (BB16);德国Leica公司荧光倒置显微镜;美国 LI-COR 公司Odyssey 红外荧光扫描成像系统;美国 Bio-Rad 公司Gel-Doc 凝胶成像系统;美国ABI公司Real-time PCR仪(AB Prism 7300)。
1.3 细胞培养
J774A.1采用含有10%(体积分数)胎牛血清和1%(质量分数)双抗的DMEM培养基,放置于37 ℃、5%(体积分数)CO2培养箱中培养。
1.4琼脂糖凝胶电泳鉴定J774A.1中CB1、HuR 的表达
J774A.1的CB1和HuR的RT-PCR产物DNA进行琼脂糖凝胶电泳,凝胶质量分数为2%, 100 V恒压电泳30~40 min,暗室内紫外灯照射观察拍照。RT-PCR所用引物见表1。
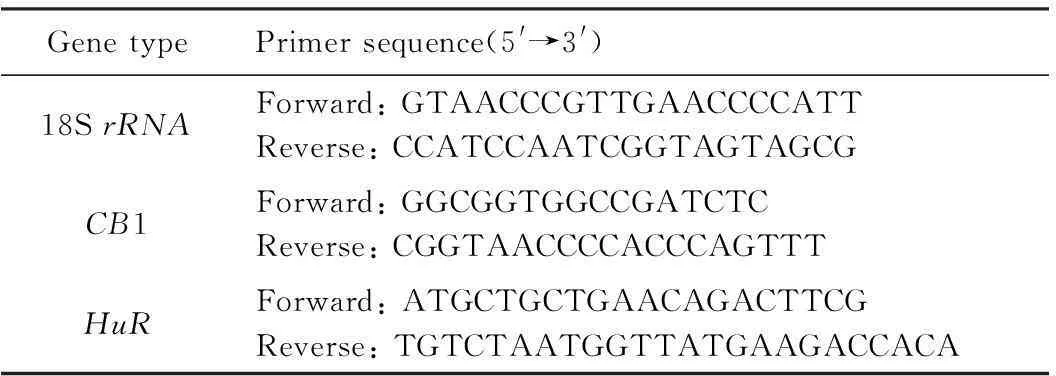
表1 引物序列
HuR:human antigen R; CB1: cannabinoid receptor 1.
1.5细胞免疫荧光鉴定J774A.1中CB1、HuR的表达
接种J774A.1 5 000个/孔于96孔板中,细胞过夜贴壁,用4%(体积分数)多聚甲醛4 ℃固定细胞30 min。PBS洗3次,每次5 min。0.5%(体积分数)的PBST室温打孔15 min,2%(质量分数)牛血清白蛋白37 ℃封闭30 min,分别用一抗CB1(1∶50)、HuR(1∶200),4 ℃孵育过夜。PBS洗3次,每次5 min。FITC标记的二抗(1∶100)37 ℃孵育1 h。PBS洗3次,每次5 min。DAPI染色5 min,荧光显微镜获取图像。
1.6Boyden chamber法检测J774A.1的迁移能力
J774A.1提前饥饿24 h,收集细胞,并用无血清培养基DMEM重悬并进行准确计数。以4×104个/孔的细胞密度接种到Boyden chamber小室中,小室下层加入700 μL无血清培养基(ACEA作为刺激因子加入下室),37 ℃、5%(体积分数)CO2迁移6 h,迁移结束后,冷甲醇固定30 min,PBS洗3次。苏木精染色1 h,PBS冲洗3次,并用医用棉签擦去上层未迁移至底面的细胞。在倒置荧光显微镜下观察并拍照,每孔拍5个视野,取平均值,每组实验设3个复孔,实验重复3次,对迁移细胞进行计数。
1.7RNA的干扰实验
RNA干扰的靶向基因为HuR,同时采用一个与其他已知的哺乳动物基因序列不具有同源性的siRNA序列作为阴性对照(表2)。其序列均由奥科公司设计与合成。转染前一天将3×105个细胞接种于60 mm培养皿,使细胞在24 h内汇合达到50%~60%。

表2 siRNA序列
HuR: human antigen R.
1.8Western blotting检测HuR和CB1的表达
提取总蛋白:收取细胞, 利用RIPA裂解液提取总蛋白,参照BCA蛋白浓度测定试剂盒说明书对蛋白进行定量, 每孔上样70 μg蛋白样品进行SDS-PAGE电泳并转移到PVDF膜上, 室温摇床封闭1 h, anti-HuR按1∶1 000稀释, anti-Tublin按1∶1 000稀释, anti-CB1按1∶200稀释。 4 ℃孵育过夜, TBS洗涤3次, 每次5 min。山羊抗鼠或者山羊抗兔二抗按 1∶10 000稀释, 室温1 h, TBS洗涤3次, 每次5 min, Odyssey 红外荧光扫描成像。
提取胞质蛋白具体步骤参照之前的文献[7]。
1.9RT-qPCR
处理后的细胞用预冷PBS清洗,加入350 μL裂解液,收集裂解底物提取全细胞RNA,定量后取0.5 μg
反转录(不加反转录酶作为阴性对照,即NO-RT),cDNA稀释后进行PCR反应(引物序列见表1)。检测的临界点设定在PCR扩增过程中,荧光信号由本底进入指数增长阶段的拐点所对应的循环数(Ct)作为模板初始浓度的间接指标,溶解曲线分析采用默认条件。结果以18S rRNA 进行校正,用ΔΔCt 法计算相对基因表达量。
1.10 统计学方法
2结果
2.1J774A.1在mRNA和蛋白质水平上均表达HuR和CB1
为了检测J774A.1在mRNA水平上表达HuR和CB1,取细胞中的HuR和CB1的RT-PCR产物进行琼脂糖凝胶电泳实验。NO-RT为阴性对照,电泳结果显示在115 bp处有CB1条带。在127bp处有HuR条带(图1A)。
为了进一步确认J774A.1在蛋白质水平上表达HuR和CB1。采用免疫荧光实验方法。J774A.1细胞在蛋白质水平上明显表达CB1(绿色荧光)和HuR(绿色荧光),且可以看出CB1在细胞质中表达,而HuR主要在细胞核中表达(图1B)。

图1 J774A.1在基因和蛋白质水平上均表达HuR和CB1
A:RT-PCR production of CB1 or HuR was size fractionated in a 2% agarose gel; B:Representative images of J774A.1 for CB1 or HuR (green) were showed by immunofluorescence. Nuclei were stained with DAPI. Scale bars: 25 μm; CB1: cannabinoid receptor 1;HuR:human antigen R.
2.2 激活CB1促进了J774A.1的迁移
为了探究CB1在单核巨噬细胞迁移过程中的重要作用,应用Boyden chamber法检测,下室分别加入不同浓度的CB1激动剂ACEA诱导迁移,迁移6 h之后显微镜下观察拍照计数。迁移实验统计结果如图所示,与对照组相比,加入100 nmol/L、300 nmol/L的ACEA均能够促进J774A.1的迁移。其中300 nmol/L的浓度促迁移能力最大,上调为对照组的1.7倍 (P<0.01)(图2)。
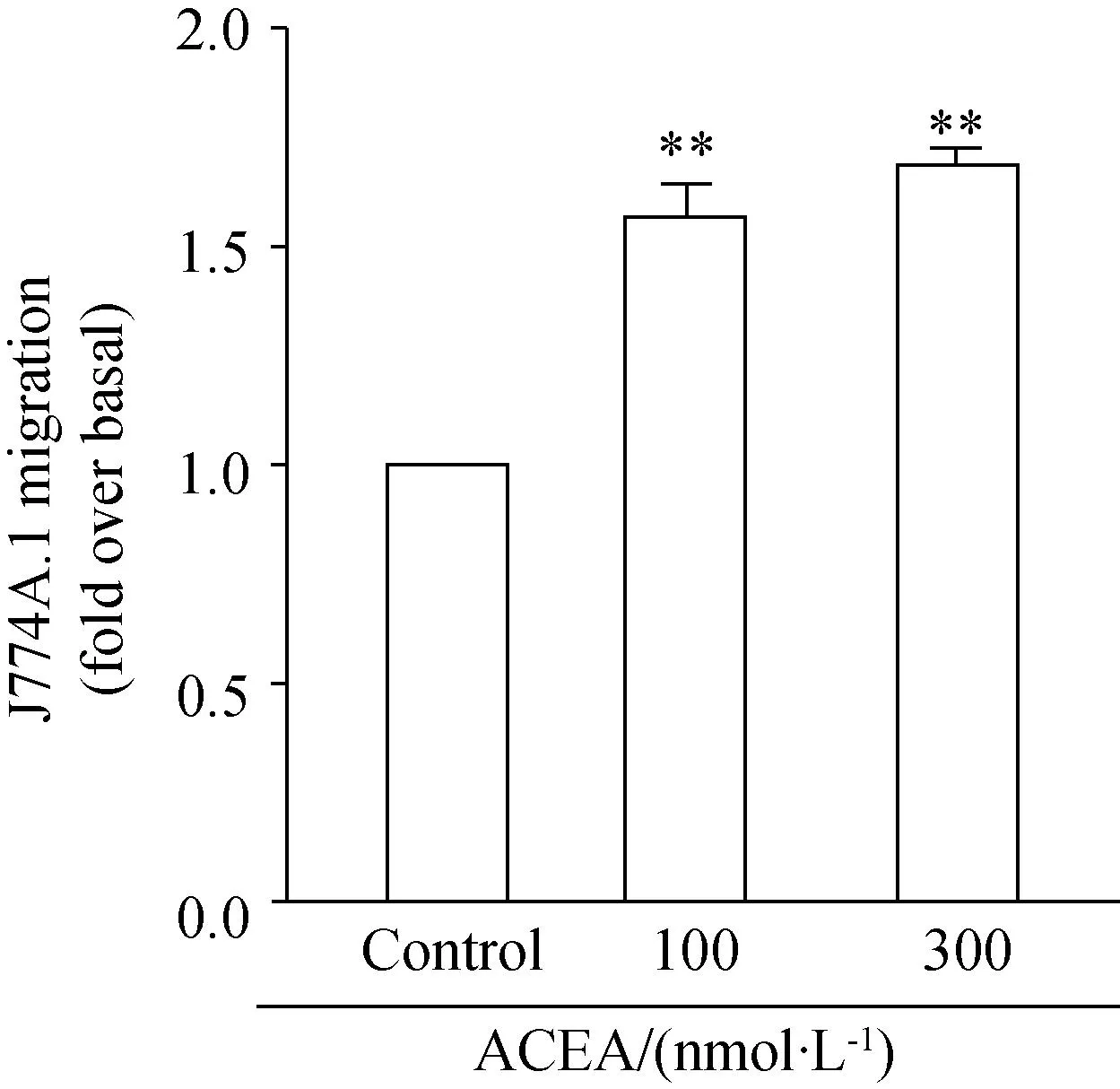
图2 激活CB1促进了J774A.1的迁移
Boyden chamber assay was performed in J774A.1 unstimulated and stimulated with ACEA (CB1 agonist). The migratory effects with ACEA of indicated concentrations on J774A.1 were estimated. Migration values were determined by counting five fields per chamber after fixing the membrane in cold methanol and staining with hematoxyllin. **P<0.01vscontrol,n=3; CB1: cannabinoid receptor 1.
2.3AM281抑制了激活CB1诱导的J774A.1的迁移
进一步的,在药理上失活J774A.1的CB1受体,然后用300 nmol/L浓度的ACEA诱导迁移。CB1受体的拮抗剂AM281在10 μmol/L的浓度上几乎完全抑制了ACEA对J774A.1的促迁移作用。这些都提示了CB1受体的激活介导了J774A.1的迁移(图3)。
2.4RNA结合蛋白HuR参与了激活CB1诱导的J774A.1的迁移
HuR是一种在各种组织和细胞中广泛表达的RNA结合蛋白,它通过与靶mRNA结合来调控其表达进而参与到了细胞迁移、细胞生长与分化等各种细胞生理进程中。为了探讨HuR是否参与到了激活CB1诱导的J774A.1迁移过程中。采用RNA干扰方法,干扰的靶向基因为HuR。J774A.1分别转染HuR
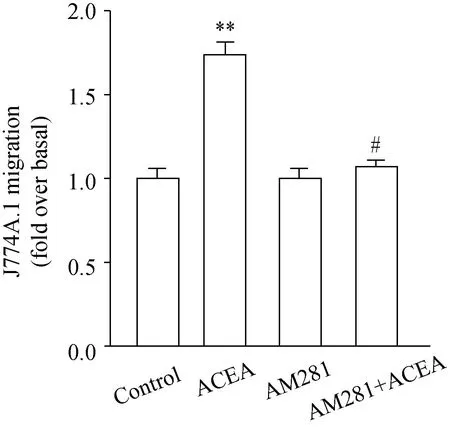
图3 AM281抑制了激活CB1促进的J774A.1的迁移
Cells were pretreated with or without 10 μmol/L AM281(CB1 antagonist) for 1 h and Boyden chamber assay was performed in J774A.1 unstimulated and stimulated with 300 nmol/L ACEA. Migration values were determined by counting five fields per chamber after fixing the membrane in cold methanol and staining with hematoxyllin.**P<0.01vscontrol;#P<0.05vsthe group treated with ACEA;n=3; CB1: cannabinoid receptor 1.
siRNA和对照 siRNA(阴性对照),转染48 h后,分别把细胞吹打下来重新接种到Boyden小室中,并在下室加入300 nmol/L ACEA进行诱导迁移。迁移6 h进行观察拍照计数。Boyden chamber法实验结果显示,当在下室加入300 nmol/L的ACEA后,和对照组相比J774A.1迁移数目明显增多。而将 HuR 敲减之后,同样在下室加入300 nmol/L ACEA进行诱导,ACEA促迁移作用明显被抑制。以上实验结果说明, RNA结合蛋白HuR参与了激活CB1诱导的 J774A.1的迁移(图4)。
2.5激活CB1促进了HuR在细胞质中的富集
为了进一步探讨HuR参与ACEA诱导的J774A.1迁移的可能的机制,检测了ACEA对HuR表达的影响。Western blotting结果显示:ACEA刺激 J774A.1 6 h后,细胞中HuR总量表达无明显变化。这说明激活CB1不会影响J774A.1中 HuR的表达。由于HuR主要定位在细胞核中,而发挥功能要转运到细胞质中,所以胞质中HuR的富集是HuR发挥功能的先决条件。接着检测了ACEA刺激下胞质中HuR的变化。结果显示:ACEA刺激能够明显增加胞质中的HuR。上述结果提示激活CB1能够促进HuR在胞质中的富集并发挥一定的功能(图5)。
2.6HuR参与了ACEA诱导的CB1表达的上调
已经证明了ACEA能够促进胞质中HuR的富集,为了进一步探讨胞质中HuR的富集是否影响了
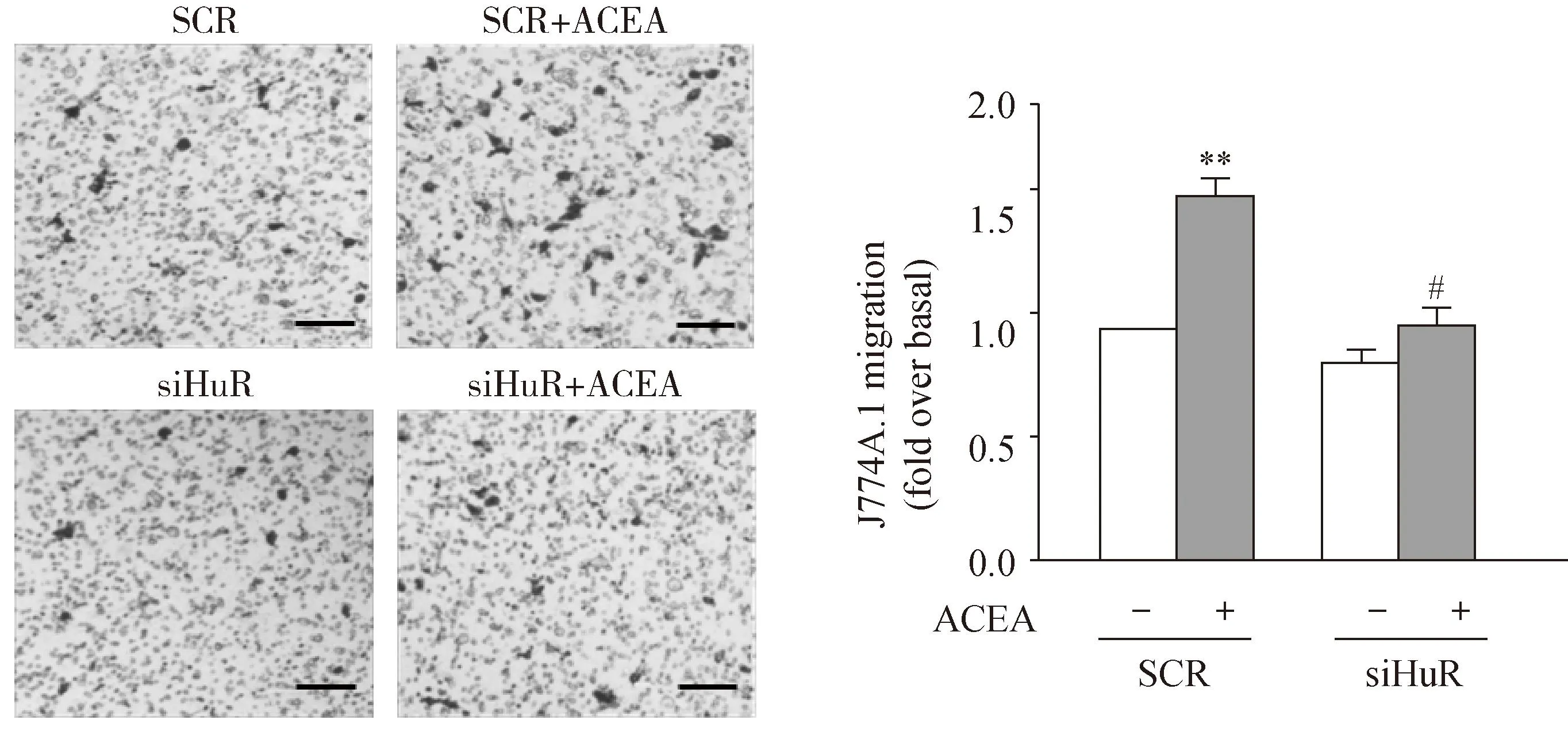
图4 HuR 参与了激活CB1诱导的J774A.1的迁移
J774A.1 migration stimulated with ACEA (300 nmol/L) with HuR siRNA or control siRNA was measured by Boyden chamber assay. The representative images of J774A.1 migration were revealed. Migration values were determined by counting five fields per chamber after fixing the membrane in cold methanol and staining with hematoxylin. Scale bars: 50 μm;**P<0.01vscontrol;#P<0.05vsthe group treated with ACEA alone;n=3; CB1: cannabinoid receptor 1;HuR:human antigen R; SCR:scramble.

图5 激活CB1促进了J774A.1中HuR的富集
J774A.1 cells were treated with ACEA (300 nmol/L). Six hours later, HuR protein was evaluated by Western blotting (left). Cytoplasmic lysates were prepared and subjected to Western blotting analysis of HuR. β-tubulin served as loading controls; CB1: cannabinoid receptor 1;HuR:human antigen R.
CB1的表达,将J774A.1转染HuR siRNA和对照siRNA,48 h后,ACEA刺激细胞24 h。转染HuR siRNA组和对照siRNA组相比,HuR mRNA(图6A)和蛋白质表达(图6B)明显降低。这说明HuR siRNA是非常有效的。如图6C和图6D,ACEA刺激后,CB1表达有所增加。但当HuR敲减之后,ACEA引起的CB1表达的上调明显被抑制。这提示HuR参与了ACEA诱导的CB1表达的上调。
3讨论
巨噬细胞在固有免疫和获得性免疫系统中都发挥着重要的作用。单核巨噬细胞被招募到炎性损伤或者感染部位对于炎性反应和抗菌免疫反应是非常关键的一步[8-9]。本课题组前期研究[10]也已经证明,骨髓来源的单核巨噬细胞可以被招募至肝脏受损部
位,并且发现减少骨髓来源的单核巨噬细胞在肝脏中的募集将改善肝脏的炎性反应和纤维化。于是本研究选用小鼠单核巨噬细胞系J774A.1,利用Boyden chamber法模拟体内巨噬细胞的迁移,并探讨其迁移机制。
内源性大麻素系统主要包括:花生四烯酸乙醇胺(anandamide,AEA)和2-花生四烯酸甘油(2-arachidonoylglycerol,2-AG)及其合成酶和降解酶;两种受体:CB1 和CB2[11]。CB2 在免疫细胞中高表达,CB1 在免疫系统中表达较低,因此探讨CB1和炎性反应细胞的关系也较少[12]。然而近期有文献[13]报道,CB1 也可调控单核巨噬细胞功能,使用CB1受体阻断剂明显地阻断巨噬细胞在粥样斑块中的聚集并能显著改善动脉粥样硬化。本课题组研究首先明确了小鼠单核巨噬细胞系J774A.1明显表达CB1。并且发现CB1激动剂ACEA促进J774A.1的迁移。用CB1拮抗剂AM281预处理J774A.1后,ACEA诱导的J774A.1的迁移活性明显被抑制。这一结果提示激活CB1能够促进J774A.1的迁移。
RNA结合蛋白HuR是一种非常重要的转录后调节蛋白,广泛表达在各种组织和细胞中。它主要通过与靶mRNA 3’UTR结合来稳定靶mRNA,从而调控所编码蛋白质的功能。HuR参与调节了慢性炎性反应、心血管疾病和肿瘤等多种病理过程[14-15]。有文献[16]报道,在大鼠血管平滑肌细胞中,HuR能够调控cox-2的表达进一步影响细胞的迁移从而参与了血管重塑这一过程。而对于HuR参与单核巨噬细胞的迁移,
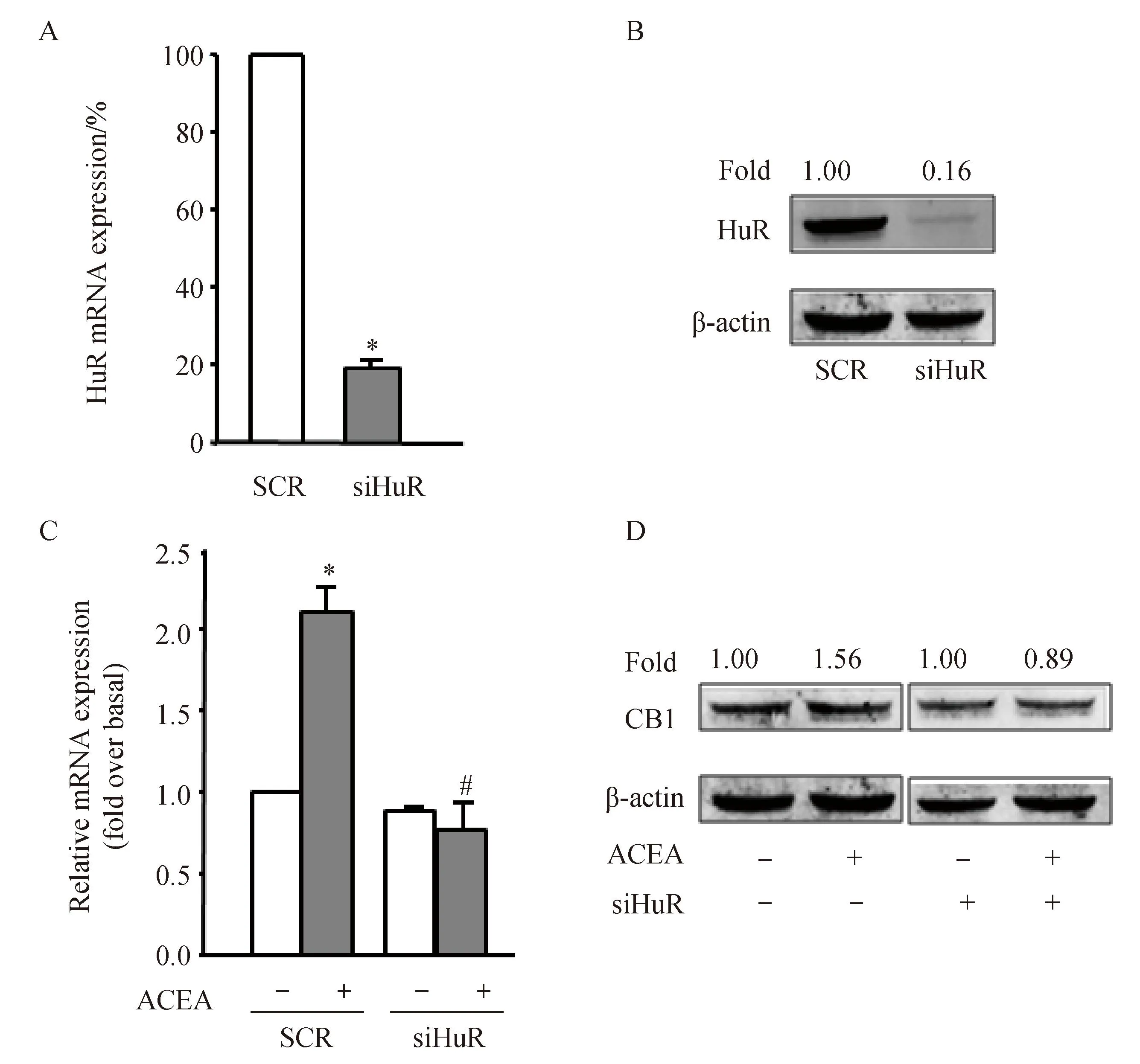
图6 HuR参与了ACEA诱导的CB1表达的上调
Effects of HuR siRNA on CB1 mRNA and protein levels in J774A.1 cells stimulated with ACEA (300 nmol/L) for 24 h. mRNA (A) and Protein (B) levels of HuR were detected to confirm the efficiency of HuR knockdown. CB1 mRNA (C) and protein(D) levels were also evaluated by Real-time RT-PCR and Western blotting analysis. β-actin served as loading controls.**P<0.05vscontrol;#P<0.05vsthe group treated with ACEA alone;n=3; CB1: cannabinoid receptor 1;HuR:human antigen R; SCR:scramble.
还未有报道。为了探讨HuR是否参与了ACEA诱导的J774A.1的迁移,将J774A.1细胞中HuR敲减。结果显示,HuR敲减之后,ACEA诱导的J774A.1的迁移活性明显下降。这一结果表明ACEA诱导的J774A.1的迁移依赖HuR。正常情况下,HuR主要定位于细胞核中,而发挥功能是在细胞质中,因此, HuR的核质转运被认为是HuR稳定靶mRNA的先决条件和关键步骤。有文献[17]报道,影响HuR胞质转运的信号通路主要有p38-MAPK、PKC、ERK等。本课题组研究结果显示,CB1激动剂ACEA能够促进HuR在胞质中的富集,并且进一步影响了CB1的表达。CB1受体是G蛋白偶联受体。激活CB1之后是否可以激活下游信号通路从而影响HuR的出核从而调控CB1的表达从而形成一个正反馈信号通路,目前还不清楚,还需要进一步证实。这可能是HuR参与ACEA诱导的J774A.1的迁移的一个非常重要的机制。但是对于HuR对于CB1表达的调控是直接关系还是间接关系,还需要进一步的研究与探讨。
本研究在体外实验中证实了,HuR通过调控CB1的表达介导了ACEA诱导的单核巨噬细胞系J774A.1的迁移,为CB1参与炎性反应提供了新机制。
4参考文献
[1]Clapper J R, Moreno-Sanz G, Russo R, et al. Anandamide suppresses pain initiation through a peripheral endocannabinoid mechanism[J]. Nat Neurosci, 2010, 13(10): 1265-1270.
[2]Cota D. CB1 receptors: emerging evidence for central and peripheral mechanisms that regulate energy balance, metabolism, and cardiovascular health[J]. Diabetes Metab Res Rev, 2007, 23(7): 507-517.
[3]Di Marzo V. Targeting the endocannabinoid system: to enhance or reduce?[J]. Nat Rev Drug Discov, 2008, 7(5): 438-455.
[4]Gentilini D, Besana A, Vigano P, et al. Endocannabinoid system regulates migration of endometrial stromal cells via cannabinoid receptor 1 through the activation of PI3K and ERK1/2 pathways[J]. Fertil Steril,2010, 93(8): 2588-2593.
[5]Song Z H, Zhong M. CB1 cannabinoid receptor-mediated cell migration[J]. J Pharmacol Exp Ther, 2000, 294(1): 204-209.
[6]Fan X C, Steitz J A. HNS, a nuclear-cytoplasmic shuttling sequence in HuR[J]. Proc Natl Acad Sci U S A, 1998, 95(26): 15293-15298.
[7]Wang W, Furneaux H, Cheng H, et al. HuR regulates p21 mRNA stabilization by UV light[J]. Mol Cell Biol, 2000, 20(3): 760-769.
[8]段朝霞, 陈魁君,张洁元,等. 小鼠血管内皮细胞的培养、鉴定及巨噬细胞移动抑制因子对其促增殖作用的研究[J]. 解放军医药杂志,2013,25(1):10-13.
[9]杨琳, 田蕾,谢杰施,等. 一种简单的分离、培养及鉴定小鼠外周血单核巨噬细胞方法的建立[J]. 首都医科大学学报,2015,36(4):610-613.
[10]Han Z, Zhu T,Liu X, et al. 15-deoxy-Delta12,14-prostaglandin J2 reduces recruitment of bone marrow-derived monocyte/macrophages in chronic liver injury in mice[J]. Hepatology, 2012, 56(1): 350-360.
[11]王喜钟, 王艳香,毕廷民,等. 大麻素Ⅱ型受体激动剂对A375细胞增殖的影响[J]. 中国煤炭工业医学杂志,2015,18(8) :1359-1362.
[12]Fonseca B M, Costa M A, Almada M, et al. Endogenous cannabinoids revisited: a biochemistry perspective[J]. Prostaglandins Other Lipid Mediat,2013, 102-103: 13-30.
[13]Sugamura K, Sugiyama S, Nozaki T, et al. Activated endocannabinoid system in coronary artery disease and antiinflammatory effects of cannabinoid 1 receptor blockade on macrophages[J]. Circulation, 2009, 119(1): 28-36.
[14]Srikantan S, Gorospe M. HuR function in disease[J]. Front Biosci (Landmark Ed), 2012, 17: 189-205.
[15]Eberhardt W, Doller A, Akoolel el-S, et al. Modulation of mRNA stability as a novel therapeutic approach[J]. Pharmacol Ther,2007, 114(1): 56-73.
[16]Aguado A, Rodriguez C, Martinez-Revelles S, et al. HuR mediates the synergistic effects of angiotensin II and IL-1beta on vascular COX-2 expression and cell migration[J]. Br J Pharmacol,2015, 172(12): 3028-3042.
[17]Doller A, Pfeilschifter J, Eberhardt W. Signalling pathways regulating nucleo-cytoplasmic shuttling of the mRNA-binding protein HuR[J]. Cell Signal,2008, 20(12): 2165-2173.
编辑孙超渊
Mouse monocyte/macrophage cell line J774A.1 migration induced by the activation of CB1 depends on HuR
Zhao Zhongxin, Chang Na, Ge Jingjing, Tian Lei, Li Liying*
(DepartmentofCellBiology,SchoolofBasicMedicalSciences,MunicipalLaboratoryforLiverProtectionandRegulationofRegeneration,CapitalMedicalUniversity,Beijing100069,China)
【Abstract】ObjectiveTo investigate the effect of activation of CB1 on J774A.1 migration and to know whether HuR is involved in the process. MethodsImmunofluorescence and agarose gel electrophoresis were used to detect the expression of cannabinoid receptor 1 (CB1) and human antigen R (HuR). Boyden chamber was used for cell migration assay. HuR siRNA transfection was used to determine whether ACEA(CB1 agonist) induced-migration depended on HuR. In order to observe its underlying mechanisms, HuR subcellular localization was assayed by Western blotting of cellular fractions from J774A.1 stimulated with ACEA.The effects of HuR siRNA on CB1 mRNA and protein levels in J774A.1 stimulated with ACEA was assayed by Western blotting. ResultsIn this study, we present evidence that J774A.1 significantly expressed HuR and CB1; the treatment of ACEA caused a increase in J774A.1 migration(P<0.01), and pharmacological inhibition of CB1 markedly attenuated ACEA-induced migration; ACEA-induced J774A.1 migration depended on HuR. Furthermore, we demonstrated ACEA increased HuR cytoplasmic translocation, and HuR regulated the expression of CB1. ConclusionThe activation of CB1 induces J774A.1 migration and HuR is involved in the process.
【Key words】human antigen R; cannabinoid receptor 1; cell migration
(收稿日期:2015-07-09)
【中图分类号】Q 7
[doi:10.3969/j.issn.1006-7795.2016.01.015]
*Corresponding author, E-mail:liliying@ccmu.edu.cn
基金项目:国家自然科学基金(81170407,31301154), 北京市属高等学校创新团队建设与教师职业发展计划项目(IDHT20150502)。 This study was supported by National Natural Science Foundation of China (81170407, 31301154), The Project of Construction of Innovative Teams and Teacher Career Development for Universities and Colleges Under Beijing Municipality (IDHT20150502).
网络出版时间:2016-01-2718∶10网络出版地址:http://www.cnki.net/kcms/detail/11.3662.R.20160127.1810.040.html
· 基础研究 ·

