过表达DBHS家族基因可促进食管鳞癌细胞的迁移侵袭
程 芮 朱圣韬 郭水龙 李 鹏 郭庆东 张澍田
(首都医科大学附属北京友谊医院消化内科 国家消化系统疾病临床医学研究中心 首都医科大学消化病学系 消化疾病癌前病变北京市重点实验室,北京 100050)
过表达DBHS家族基因可促进食管鳞癌细胞的迁移侵袭
程芮朱圣韬郭水龙李鹏郭庆东张澍田*
(首都医科大学附属北京友谊医院消化内科国家消化系统疾病临床医学研究中心首都医科大学消化病学系消化疾病癌前病变北京市重点实验室,北京 100050)
【摘要】目的研究人类剪切蛋白(drosophila behavior human splicing,DBHS)家族基因,包括p5nrb、PSF、PSPC1基因,对食管鳞状细胞癌(以下简称食管磷癌)细胞系TE-8细胞系迁移、侵袭能力的影响。方法构建p54nrb、PSF、PSPC1基因过表达载体,通过脂质体法转染TE-8细胞,转染48 h后qRT-PCR和Western blotting检测各组细胞p54nrb、PSF、PSPC1在mRNA和蛋白质水平的表达。细胞划痕实验及覆盖有Matrigel的Transwell小室检测食管鳞癌细胞的迁移、侵袭能力。结果过表达p54nrb、PSF、PSPC1后,qRT-PCR和Western blotting检测证实食管鳞癌TE-8细胞中上述基因表达在mRNA水平和蛋白质水平均明显上调,细胞划痕实验及Transwell小室实验证实食管鳞癌TE-8细胞过表达p54nrb、PSF、PSPC1后,其迁移、侵袭能力增强。结论过表达DBHS家族基因可促进食管鳞癌细胞的迁移侵袭。
【关键词】食管鳞癌;人类剪切蛋白;p54nrb;PSF;PSPC1;侵袭;迁移
食管癌是人类常见的恶性肿瘤之一,主要分为两种病理类型,分别为:食管鳞状细胞癌(以下简称食管磷癌)和食管腺癌,其中90%以上为食管鳞癌,在亚洲人群中,特别是中国地区,有较高的发病率和病死率,侵袭转移较快是其预后不良主要原因[1]。尽管手术方式、放射治疗和化学药物治疗技术近年来发展迅速,但食管鳞癌术后5年生存率仍较低[2-3]。因此,研究食管鳞癌发生和转移的分子机制,寻找抗癌药物的作用靶点有助于建立新的治疗方法。最初Hanke等[4]在小鼠B细胞白血病细胞系中发现一种可结合到DNA、RNA的核蛋白,可参与多种生物学过程。此后Dong等[5]在Hela细胞系中发现由471个氨基酸残基组成的,相对分子质量约为54 000的核RNA结合蛋白(nuclear RNA-binding protein of 54 000,p54nrb),与Hanke等[4]在小鼠中发现蛋白存在很高的同源性,随着进一步的研究发现p54nrb与人类多聚嘧啶束结合蛋白相关剪切因子 (polypyramidine tract binding protein-associated splicing factor, PSF)、 细胞核内亚细胞器核旁斑点蛋白1(paraspeckle protein 1, PSPC1),有着高度保守的氨基端同源区,这些蛋白被归属于人类剪切(drosophila behavior human splicing,DBHS)蛋白家族[6-9],该家族的成员之间可形成同源或异源二聚体,参与各种生物学反应,发挥多种功能[10-12]。既往研究[13-18]发现主要参与基因转录调控、DNA损伤修复等过程的调节。此外,DBHS家族蛋白在肿瘤的发生、发展中作用受到越来越多关注,与前列腺癌、黑色素瘤、白血病、结肠癌、乳腺癌等发生发展密切相关,研究[19]发现,DBHS蛋白在多种 肿瘤细胞中高表达,在肿瘤的生长、侵袭、转移中发挥着重要作用。然而其对食管鳞癌的相关研究仍没有报道过。本研究运用基因转染方法在食管鳞癌细胞系中过表达DBHS家族基因,通过细胞划痕实验、Transwell小室等方法,探讨食管鳞癌细胞体外迁移、侵袭能力的变化,为食管鳞癌患者的早期诊断和治疗提供新的分子指标。
1材料与方法
1.1 材料
1)细胞系:人食管鳞癌细胞系TE-8,购自中国医学科学院基础医学研究所,由本实验室保存。
2)主要试剂:小鼠抗人Flag单克隆抗体购自Sigma公司(美国);辣根过氧化物酶(HRP)标记的山羊抗小鼠IgG抗体购自北京中杉金桥有限公司(中国);RPMI-1640培养基购自Corning公司(美国);反转录试剂盒、Lipofectamine 2000购自Invitrogen公司(美国);实时荧光定量聚合酶链反应(qRT-PCR)试剂SYBR Green购于Applied Biosystems公司(美国);pCMV-P54nrb-Flag、pCMV-PSF-Flag、pCMV-PSPC1-Flag过表达载体购自Addgene公司(美国)。
1.2细胞培养及转染
1)细胞培养:食管鳞癌细胞系TE-8用含10%(体积分数)胎牛血清、RPMI-1640培养基培养于 37 ℃、5% (体积分数)CO2的细胞培养箱中。细胞密度达80%~90%时,用胰蛋白酶消化传代。
2)细胞转染:取对数生长期的TE-8细胞接种于6孔板,4×105细胞/孔,参照Lipofectamine 2000说明书转染pCMV空载体、pCMV-P54nrb-Flag、pCMV-PSF-Flag、pCMV-PSPC1-Flag过表达载体。转染6 h后,换为全培养液培养,48 h后,收集细胞。实验分4组: 转染空载体组(阴性对照组negative control,NC)和p54nrb、PSF、PSPC1过表达载体转染组。每组设3个复孔,实验重复3次。
1.3 qRT-PCR检测细胞系p54nrb、PSF、PSPC1 mRNA的过表达水平
将上述转染48 h的细胞,弃去培养液,用预冷的PBS洗3遍(1 min/次), Trizol法提取各组细胞总RNA,用Invitrogen转录试剂盒进行反转录,获得总cDNA。分别扩增目的基因p54nrb、PSF、PSPC1和对照内参GAPDH。随后应用SYBR-fast方法,进行实时荧光定量 PCR循环扩增。PCR引物由上海生工生物工程有限公司合成,引物序列如表1。反应条件为: 95 ℃,5 min预变性;95 ℃,20 s;60 ℃,1 min,扩增 40个循环。2-ΔΔCT法计算mRNA的相对表达量,以GAPDH为内参。

表1 实时荧光定量PCR引物列表
qRT-PCR: real time quantitative PCR;p54nrb: nuclear RNA-binding protein of 54 000; PSF: polypyramidine tract binding protein-associated splicing factor; PSPC1: paraspeckle protein 1;GAPDH: glyceraldehyde-3-phosphate dehydrogenase.
1.4Western blotting检测细胞系p54nrb、PSF、PSPC1蛋白的过表达水平
将上述转染48 h的细胞,弃去培养液,用预冷的PBS洗3遍(1 min/次),加入RIPA中性裂解液,超声裂解3次(10 s/次)后,冰上裂解细胞,4 ℃、15 000 r/min离心10 min后收集上清,获得转染细胞的总蛋白。用BCA法行蛋白质定量,以调整蛋白质样品浓度,使每孔蛋白质上样量一致。8%(质量分数)SDS-PAGE电泳分离蛋白质,Bio-Rad半干转膜仪、PVDF膜恒压转膜60 min, 5%(质量分数)脱脂奶粉室温摇床封闭1 h,5%(质量分数)脱脂牛奶稀释的小鼠抗人Flag单克隆抗体(1∶1 000)室温孵育2 h,TBST洗膜后加入 HRP标记的山羊抗小鼠IgG抗体(1∶8 000)室温孵育1 h, 经过ECL试剂中反应1 min,在Bio-Rad凝胶成像系统中进行显色反应,观察蛋白表达,β-actin作为内对照。
速度力量是短跑项目运动员最典型和最重要的力量,也是力量训练中争议最多的方法之一。短跑项目发展速度力量主要以发展爆发力为主。爆发力的公式是:爆发力=F×V即爆发力是由肌肉力量和肌肉收缩速度两个因素界定的。在训练中,为了提高爆发力,应着重于肌肉力量和肌肉收缩速度两个方面的训练。跳深练习被普遍认为是发展爆发力的最好办法,从一定高度的凳子、跳箱上跳下,落地后即刻向前上方跳起,跳深高度应根据跳马技术起跳动作的膝关节最大被动缓冲角度制定,踏跳时间控制在0.1~0.4秒左右,练习时可负重,负重一般为体重的20%较好。
1.5划痕实验检测细胞迁移能力
按照上述转染方法,得到转染24 h的TE-8细胞,PBS洗涤细胞后,胰蛋白酶消化,用含有10%(体积分数)胎牛血清RPMI-1640培养基制成单细胞悬液,按8×105个/孔的密度接种到6孔板,培养24 h后,吸去培养基,用20 μL枪头沿着板底部划竖的“1”字形划痕,PBS洗细胞3遍,显微镜下拍照记录,为0 h,并做好标记,每组细胞取6个点,划痕后24 h,细胞换液,在做标记的6个点再次进行显微镜下照相。
1.6Transwell小室侵袭实验
提前10 min将覆盖有Matrigel的小室置于室温解冻,在24孔板中放入常温无血清RPMI-1640培养基500 μL,用灭菌的镊子将小室置入其中,在上层加入常温无血清RPMI-1640培养基500 μL,37 ℃、5%(体积分数)CO2孵育2 h进行水化,之后将培养基吸除。将上述转染24 h的各组细胞用PBS洗涤细胞后,胰蛋白酶消化,用不含血清RPMI-1640培养基制成单细胞悬液,并接种于铺有Matrigel胶的小室中。上室加500 μL (2×105个/室)应用不含血清RPMI-1640培养基制成的细胞悬液,下室加750 μL含10%(体积分数)血清的培养基作为趋化因子,37 ℃、5%(体积分数)CO2孵育。36 h后取出小室,甲醇固定5 min,使用棉签去除滤膜表面未穿膜细胞,用DAPI进行染色,荧光显微镜下随机选取10个视野,计数每个视野中的穿膜细胞数。
1.7统计学方法
2结果
2.1qRT-PCR检测过表达p54nrb、PSF、PSPC1 mRNA水平
采用qRT-PCR检测p54nrb、PSF、PSPC1 mRNA水平过表达效率, 食管鳞癌细胞系TE-8中转染外源性过表达p54nrb、PSF、PSPC1载体48 h后,实验组p54nrb、PSF、PSPC1 mRNA水平均高于空载体组,以空载体组mRNA水平为对照,其外源性过表达p54nrb、PSF、PSPC1后升高的倍数分别为:17.35±2.24,35.17±3.23,24.35±1.78(图1),表明p54nrb、PSF、PSPC1过表达质粒成功导入TE-8细胞系中,并在RNA水平表达。

图1 TE-8转染空载体质粒NC,过表达质粒
**P<0.01vsNC.WB:Western blotting;NC: negative control; p54nrb: nuclear RNA-binding protein of 54 000; PSF: polypyramidine tract binding protein-associated splicing factor; PSPC1: paraspeckle protein 1; N: numbers.
2.2Western blotting 方法检测过表达p54nrb、PSF、PSPC1蛋白水平
DBHS家族基因过表达载体含有Flag标签蛋白,为融合表达蛋白,与目的基因同时表达,通过检测到Flag的蛋白水平,可反映出p54nrb、PSF、PSPC1过表达蛋白水平。在6孔板中接种TE-8细胞使细胞密度达90%,按照以上转染步骤进行细胞转染,48 h后收集细胞裂解液,Western blotting检测各组细胞Flag蛋白表达水平,结果显示分别在约54 000、100 000、 59 000得到特异性条带,与预期蛋白大小一致,表明p54nrb、PSF、PSPC1过表达质粒成功导入TE-8细胞系中,并在蛋白水平表达(图2)。
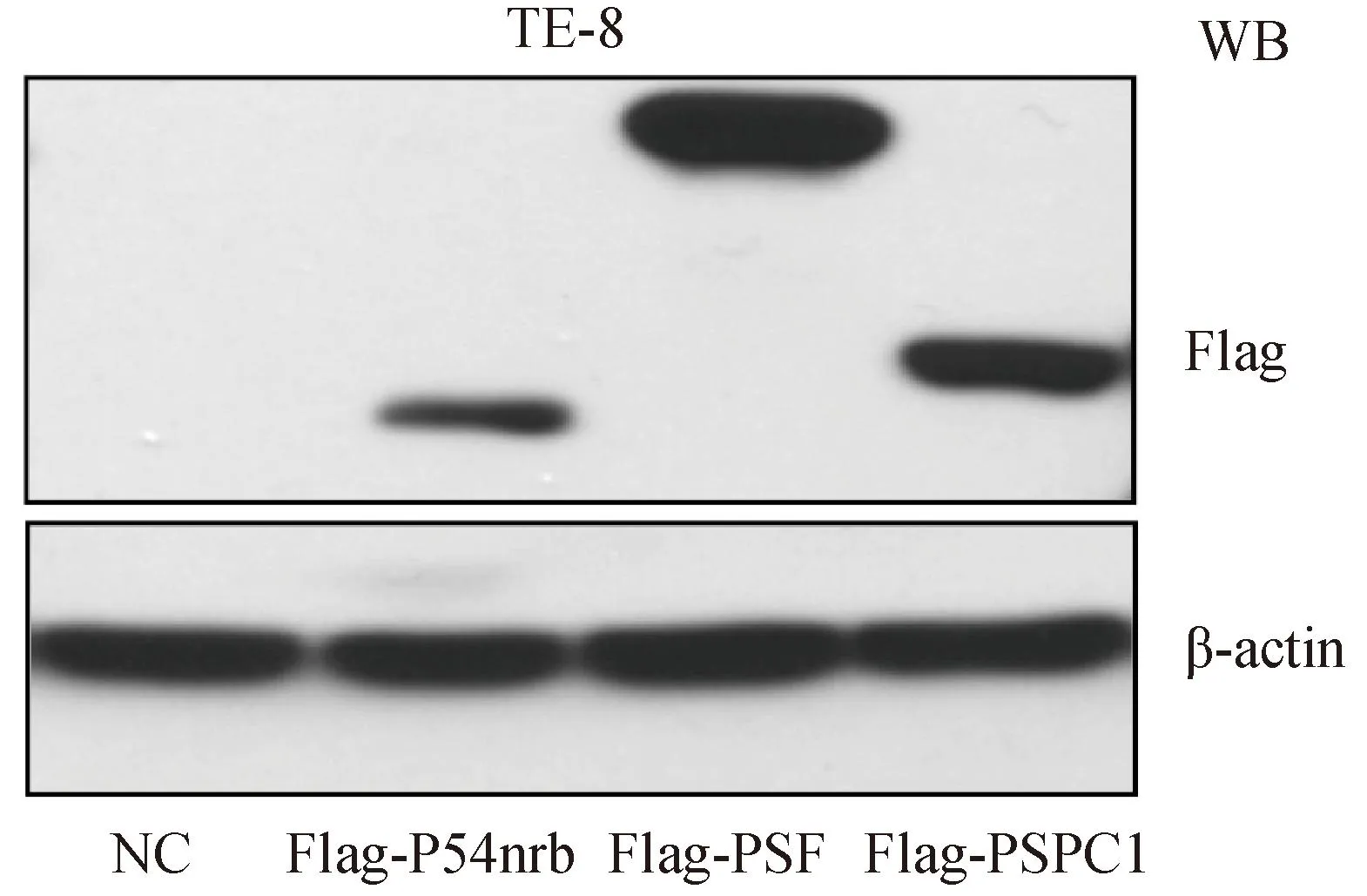
图2 TE-8转染空载体质粒NC,过表达质粒Flag-p54nrb、
WB:Western blotting; NC: negative control; p54nrb: nuclear RNA-binding protein of 54 000; PSF: polypyramidine tract binding protein-associated splicing factor; PSPC1: paraspeckle protein 1.
2.3过表达p54nrb、PSF、PSPC1后对TE-8细胞迁移能力的影响
应用Photoshop软件的直方图功能分析各组细胞
迁移面积的比较:空载体组和p54nrb、PSF、PSPC1转染组细胞24 h后迁移的面积的分别为 6 135.5±140.7 、 11 891.5±268.0、10 777±188.1、7 402.5±314.7,以空载体组作为对照组,设定为1,得到p54nrb、PSF、PSPC1过表达各组细胞迁移倍数,与空载质粒组的比较,细胞在划痕两侧逐渐向中间迁移, p54nrb、PSF、PSPC1转染组的TE-8细胞向划痕中间迁移的速度明显增快,划痕间距离较近,与对照组比较,差异有统计学意义(P<0.05,图3)。
2.3过表达p54nrb、PSF、PSPC1后对TE-8细胞侵袭能力的影响
通过应用覆盖有Matrigel的Transwell小室检测选取p54nrb、PSF、PSPC1过表达后对TE-8细胞的侵袭能力的影响。结果显示,与空载体组比较,TE-8细胞过表达p54nrb、PSF、PSPC1后,食管鳞癌细胞的穿膜细胞数明显增多,侵袭能力均明显增强,差异具有统计学意义(P<0.05,图4)。

图3 p54nrb、PSF、PSPC1过表达食管鳞癌细胞的迁移实验结果
A: results of wound healing assay; B:statistical graph;*P<0.05,**P<0.01; NC: negative control; p54nrb: nuclear RNA-binding protein of 54 000; PSF: polypyramidine tract binding protein-associated splicing factor; PSPC1: paraspeckle protein 1; N: numbers.
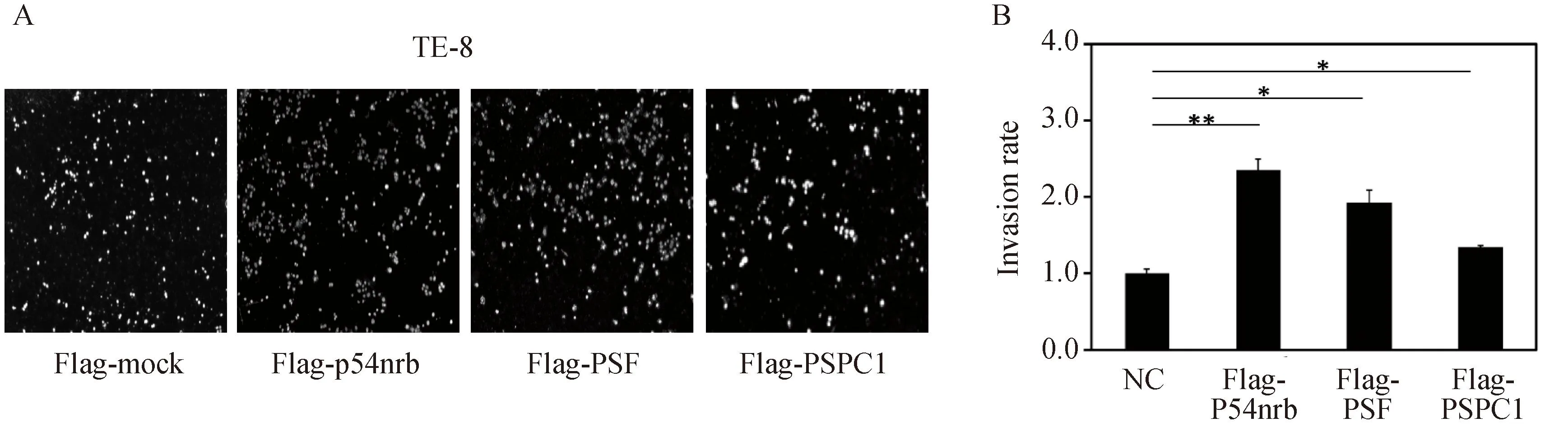
图4 p54nrb、PSF、PSPC1过表达后可增强食管鳞癌细胞TE-8的侵袭能力
A:esults of wound healing assay; B:statistical graph;*P<0.05,**P<0.01; NC: negative control; p54nrb: nuclear RNA-binding protein of 54 000; PSF: polypyramidine tract binding protein-associated splicing factor; PSPC1: paraspeckle protein 1; N: numbers.
3讨论
食管癌是一种常见的消化道恶性肿瘤,其病理类型主要包括鳞癌与腺癌两种。食管腺癌在欧美国家常见,我国90%以上都是食管鳞癌。转移是恶性肿瘤的重要 特点之一,也是导致大部分肿瘤预后差的原因之一。恶性肿瘤的侵袭过程是动态连续的过程。原发肿瘤形成后,首先侵袭细胞外基质,侵袭临近的血管进入血液循环中,再经血管壁到其他部位,形成肿瘤的转移灶。食管鳞癌转移快,预后差,研究其侵袭、转移的分子机制至关重要。
P54nrb、PSF、PSPC1基因属于DBHS家族,其中,p54nrb与PSF、PSPC1常以同源或异源二聚体的形式参与多种核内过程[6-7],DBHS家族基因在肿瘤方面的研究近年来受到很多关注,p54nrb在恶性黑色素瘤细胞系和组织中呈高表达,体外实验[19]显示p54nrb可作为黑色素瘤抑制活性(melanoma inhibitory activity, MIA)蛋白的靶蛋白对恶性黑色素瘤细胞具有促进肿瘤细胞增生和迁移的作用,此外在膀胱癌的研究中发现p54nrb可促进肿瘤细胞对血管的侵袭作用。PSF可以于人类肿瘤细胞系中的多种基因结合并通过抑制其转录活性影响肿瘤细胞的增生等功能,如人宫颈癌细胞系Hela细胞中存在编码PSF的DNA结合域基因缺失,可能与Hela细胞癌变相关[20]。PSF与癌基因Hakai在肿瘤细胞核中存在共定位,通过DNA结合域结合,过表达Hakai可增强PSF与某些mRNA结合能力,这些mRNA可编码肿瘤生成、细胞黏附等功能,如肿瘤及血管生成因子PAI-RBP1的mRNA,骨架蛋白α-catenin的mRNA,在这过程中促进了某些肿瘤的形成及侵袭、迁移能力[21-23]。关于另一个分子PSPC1蛋白的功能报道较少,仅有少量研究报道表示PSPC1可参与基因表达调控或RNA生成过程。然而DBHS家族基因与食管鳞癌的侵袭迁移功能仍没有报道过。
本研究首次揭示了p54nrb、PSF、PSPC1对食管鳞癌细胞侵袭、迁移能力的增强作用。本研究通过qRT-PCR和Western blotting方法证实过表达p54nrb、PSF、PSPC1后,食管鳞癌细胞系TE-8中p54nrb、PSF、PSPC1表达在mRNA水平和蛋白质水平均明显升高,通过细胞划痕及Transwell小室的侵袭和迁移实验表明,p54nrb、PSF、PSPC1过表达后,食管鳞癌细胞系TE-8细胞迁移、侵袭能力增强。实验结果证实,p54nrb、PSF、PSPC1在食管鳞癌细胞系TE-8中发挥着促癌作用,推测DBHS家族基因很有可能作为食管鳞癌的新的肿瘤标志物,将为肿瘤的治疗提供新思路。然而,对于促进食管鳞癌细胞的侵袭和迁移的具体机制,尚待进一步研究。
4参考文献
[1]Tang S, Gao L, Bi Q, et al. SDR9C7 promotes lymph node metastases in patients with esophageal squamous cell carcinoma[J]. PLoS One, 2013, 8(1): e52184.
[2]van Hagen P, Hulshof MCCM, van Lanschot J J B, et al. Preoperative chemoradiotherapy for esophageal or junctional cancer[J]. N Engl J Med, 2012, 366(22): 2074-2084.
[3]Siegel R, Naishadham D, Jemal A. Cancer statistics, 2013[J]. Cancer J Clin, 2013, 63(1): 11-30.
[4]Hanke J H, Landolfi N F, Tucker P W, et al. Identification of murine nuclear proteins that bind to the conserved octamer sequence of the immunoglobulin promoter region[J]. Proc Natl Acad Sci USA, 1988, 85(10): 3560-3564.
[5]Dong B, Horowitz D S, Kobayashi R, et al. Purification and cDNA cloning of hela cell p54nrb, a nuclear protein with two RNA recognition motifs and extensive homology to human splicing factor PSF and drosophilaNonA/Bj6[J]. Nucleic Acids Res, 1993, 21(17): 4085-4092.
[6]Kuwahara S, Ikei A, Taguchi Y, et al. PSPC1, NONO, and SFPQ are expressed in mouse Sertoli cells and may function as coregulators of androgen receptor-mediated transcription[J]. Biol Reprod, 2006,75(3): 352-359.
[7]Fox A H, Bond C S, Lamond A I. P54nrb forms a heterodimer with PSP1 that localizes to paraspeckles in an RNA-dependent manner[J]. Mol Biol Cell, 2005,16(11): 5304-5315.
[8]Kameoka S, Duque P, Konarska M M. p54(nrb) associates with the 5’ splice site within large transcription/splicing complexes[J]. EMBO J,2004,23(8): 1782-1791.
[9]Kaneko S, Rozenblatt-Rosen O, Meyerson M, et al. The multifunctional protein p54nrb/PSF recruits the exonuclease XRN2 to facilitate pre-mRNA 3’ processing and transcription termination[J]. Genes Dev, 2007,21(14): 1779-1789.
[10]Salton M, Lerentha Y, Wang S, et al. Involvement of Matrin 3 and sfpq/nono in the DNA damage response[J]. Cell Cycle, 2010, 9(8): 1568-1576.
[11]Shav-Tal Y, Zipori D. PSF and p54nrb/NonO—multi-functional nuclear proteins[J]. FEBS Lett, 2002, 531(2): 109-114.
[12]Ha K, Takeda Y, Dynan W S, et al. Sequences in PSF/ SFPQ mediate radioresistance and recruitment of PSF/ SFPQ-containing complexes to DNA damage sites in human cells[J]. DNA Repair: Amst, 2011, 10(3): 252-259.
[13]Schiffner S, Zimara N, Schmid R, et al. P54nrb is a new regulator of progression of malignant melanoma[J]. Carcinogenesis, 2011, 32(8): 1176-1182.
[14]Clark J, Lu Y J, Sidhar S K, et al. Fusion of splicing factor genes PSF and NonO/p54nrb to the TFE3 gene in papillary renal cell carcinoma[J]. Oncogene, 1997, 15(18): 2233-2239.
[15]Tsofack S P, Garand C, Sereduk C, et al. NonO and RALY proteins are required for YB-1 oxaliplatin induced resistance in colon adenocarcinoma cell lines[J]. Mol Cancer, 2011, 10: 145.
[16]Ishiguro H, Uemura H, Fujinami K, et al. 55 kDa nuclearmatrix protein (nmt55) mRNA is expressed in human prostate cancer tissue and is associated with the androgen receptor[J]. Int J Cancer, 2003, 105(1): 26-32.
[17]Zhang C, Zhanga M X, Shena Y H, et al. Role of NonO-histone interaction in TNFα-suppressed prolyl-4-hydroxylase α1[J]. Biochim Biophys Acta, 2008, 1783(8): 1517-1528.
[18]Yamauchi T, Nakamura N, Hiramoto M, et al. Sepantronium bromide (YM155) induces disruption of the ILF3/p54nrb complex, which is required for survivin expression[J]. Biochem Biophys Res Commun, 2012, 425(4): 711-716.
[19]曹彦坤, 李润霄,田志辉,等. 食管鳞癌单纯放化疗预后及相关因素分析[J]. 中华肿瘤防治杂志,2015,(16) :1297-1302.
[20]胡倩, 姚和瑞. 长链非编码RNA与肿瘤研究现状[J]. 中华肿瘤防治杂志, 2014,21(21):1746-1750.
[21]Barboro P, Rubagotti A, Orecchia P, et al. Differential proteomic analysis of nuclear matrix in muscle-invasive bladder cancer: potential to improve diagnosis and prognosis[J]. Analytical Cellular Pathology,2008,30(1):13-26.
[22]Hodgson M C, Astapova I, Cheng S, et al. The androgen receptor recruits nuclear receptor CoRepressor (N-CoR) in the presence of mifepristone via its N and C termini revealing a novel molecular mechanism for androgen receptor antagonists[J]. J Biol Chem,2005,280(8):6511-6519.
[23]Figueroa A, Kotani H, Toda Y, Mazan-Mamczarz K, et al. Novel roles of hakai in cell proliferation and oncogenesis[J]. Mol Biol Cell, 2009,20(15):3533-3542.
编辑慕萌
Effect ofDBHSfamily members on migration and invasion of esophageal squamous cell carcinoma
Cheng Rui,Zhu Shengtao,Guo Shuilong,Li Peng,Guo Qingdong,Zhang Shutian*
(DepartmentofGastroenterology,BeijingFriendshipHospital,CapitalMedicalUniversity;NationalClinicalResearchCenterforDigestiveDiseases;FacultyofGastroenterologyinCapitalMedicalUniversity;BeijingKeyLaboratoryforPrecancerousLesionofDigestiveDiseases,Beijing100050,China)
【Abstract】ObjectiveTo investigate the effects of drosophila behavior human splicing(DBHS) family members, including p54nrb, PSF and PSPC1, on regulation of migration and invasion in human esophageal squamous cell carcinoma (ESCC) cell line TE-8.MethodsAfter transfection with p54nrb, PSF and PSPC1 plasmids, the expression of mRNA and protein in human ESCC cell line TE-8 were determined by qRT-PCR and Western blotting, respectively. Wound healing and Matrigel invasion test were used to detect the effects of p54nrb, PSF and PSPC1 overexpression on migration and invasion of the cells, respectively. ResultsAfter 48 h of transfection with p54nrb, PSF and PSPC1 plasmids, the expression of relatives p54nrb, PSF and PSPC1 mRNA and protein levels were increased (P<0.05), respectiveIy. The migration rate was measured by wound healing after overexpression of p54nrb, PSF and PSPC1, was promoted significantly (P<0.05). Matrigel invasion of the cells were significantly increased after p54nrb, PSF and PSPC1 plasmids transfection (P<0.05). ConclusionOverexpression of DBHS family members could promote both migration and invasion of ESCC cell line.
【Key words】esophageal squamous cell carcinoma;drosophila behavior human splicing(DBHS);p54nrb;PSF;PSPC1;invasion;migration
(收稿日期:2015-12-25)
【中图分类号】R 655.4
[doi:10.3969/j.issn.1006-7795.2016.01.002]
*Corresponding author, E-mail:zhangshutian@ccmu.edu.cn
基金项目:国家自然科学基金(81302160, 81272447),国家消化系统疾病临床医学研究中心基金(2015BAI13B09),北京市自然科学基金(7152043)。This study was supported by National Natural Science Foundation of China (81302160, 81272447), National Clinical Research Center for Digestive Diseases (2015BAI13B09), Natural Science Foundation of Beijing (7152043).
网络出版时间:2016-01-2718∶00网络出版地址:http://www.cnki.net/kcms/detail/11.3662.R.20160127.1800.024.html
· 消化系统重大疾病的全链条研究 ·

