全反式维甲酸对宫颈癌耐药细胞株HeLa/MMC侵袭、转移能力的影响及其分子机制研究
胡海燕++++++刘植华
[摘要] 目的 观察全反式维甲酸(ATRA)对宫颈癌耐药细胞株HeLa/MMC侵袭、转移能力的影响,并探讨其分子机制。 方法 分别用不同浓度ATRA(1×10-7、1×10-6、1×10-5 mol/L)处理对数生长期HeLa/MMC细胞,以Transwell小室检测细胞侵袭、转移能力的变化;采用CCK-8法检测经1×10-7、5×10-7、1×10-6、5×10-6、1×10-5 mol/L ATRA处理后的细胞增殖情况;通过流式细胞仪观察1×10-6 mol/L ATRA处理HeLa/MMC细胞3、7 d后细胞周期的变化;半定量RT-PCR检测1×10-6 mol/L ATRA处理HeLa/MMC细胞3、7 d后细胞c-myc mRNA水平变化。 结果 ①Transwell小室结果显示,1×10-7 mol/L ATRA组、1×10-6 mol/L ATRA组、1×10-5 mol/L ATRA组细胞侵袭数、转移数[(40±6)、(73±7)个,(26±4)、(61±4)个,(16±3)、(49±5)个)]均减少,与对照组[(63±9)、(89±9)个]比较,差异有统计学意义(P < 0.05)。②CCK-8法检测细胞增殖结果显示,随着全反式维甲酸药物浓度的递增,HeLa/MMC细胞增殖逐渐被抑制;实验各组与阴性对照组比较,差异有统计学意义(P < 0.05)。③流式细胞仪检测结果显示,全反式维甲酸使进入S期耐药细胞数减少。1×10-6 mol/L ATRA处理3、7 d S期细胞比例分别为(14.90±0.21)%、(6.48±0.18)%;两个实验组与对照组(16.28±0.12)%比较,差异有统计学意义(P < 0.05)。④RT-PCR结果显示,全反式维甲酸下调癌基因c-myc的转录。1×10-6 mol/L ATRA处理3、7 d c-myc mRNA相对表达量分别为(0.5406±0.0011)、(0.4312±0.0009);两个实验组与对照组(0.6804±0.0012)比较,差异有统计学意义(P < 0.05)。 结论 全反式维甲酸可抑制宫颈癌耐药细胞株的侵袭、转移,其机制可能通过下调癌基因c-myc转录实现。
[关键词] 宫颈肿瘤;维甲酸;转移;侵袭
[中图分类号] R737.7 [文献标识码] A [文章编号] 1673-7210(2015)02(c)-0018-04
全反式维甲酸(all-trans retinoic acid,ATRA)是由维生素A在人体内代谢生成的高活性衍生物,对胚胎发育过程中细胞分化以及机体的生长、发育均具有重要调节作用[1]。到目前为止,ATRA用于急性早幼粒白血病治疗的基础与临床研究较为深入[2-3],而有关人体实体瘤的分化研究,已见报道的有结肠癌、胃癌、肺鳞状上皮癌、乳腺癌等[4-5]。本课题组的前期研究显示,ATRA能有效抑制宫颈癌细胞HeLa增殖并诱导其分化,且能提高宫颈癌耐药细胞株HeLa/MMC对化疗的敏感性[6]。宫颈癌耐药细胞株HeLa/MMC较其亲本细胞HeLa增殖更快、恶性度更高。本研究以宫颈癌耐丝裂霉素细胞株HeLa/MMC为研究对象,体外观察ATRA对宫颈癌耐药细胞侵袭、转移能力的影响,探讨其作用的分子机制。
1 材料与方法
1.1 材料与试剂
ATRA、二甲基亚砜(DMSO)、PI、CCK-8试剂盒、RNase(Sigma公司、美国)。Transwell小室(Corning公司、美国)。SV总RNA分离试剂盒(Promega公司、美国)。One step RT-PCR试剂盒(TaKaRa公司、中国)。引物由中国上海Invitrogen公司合成。
1.2 耐药细胞株HeLa/MMC的建立
耐药细胞株由武汉大学中南医院肿瘤研究所惠赠。通过连续性给药,间歇性增加药量,逐步提高宫颈癌HeLa细胞培养液中丝裂霉素浓度,获得对丝裂霉素5.02倍耐药,对顺铂2倍耐药的HeLa/MMC细胞株。该细胞株对长春新碱、5-氟尿嘧啶、阿霉素保持敏感。
1.3 方法
1.3.1 耐药细胞的培养 HeLa/MMC细胞培养于含10%灭活小牛血清的RPMI1640培养液中,培养液中加入丝裂霉素维持其耐药性,置于37℃、5%CO2、饱和湿度的细胞培养箱中培养。视细胞生长情况隔天换液1次,取对数生长期细胞进行实验。
1.3.2 Transwell小室检测耐药细胞的侵袭、转移能力 取对数生长期细胞,细胞计数后调整细胞浓度为1×106个/mL。细胞转移试验中,在Transwell小室的上室中加入100 μL细胞悬液。细胞侵袭实验,用无血清预冷的DMEM稀释Matrigel胶(3∶1)。加30 μL稀释的Matrigel于Transwell小室的上室,37℃放置过夜。上室加入100 μL细胞悬液,设3个复孔。实验组加入三种浓度ATRA(1×10-7、1×10-6、1×10-5 mol/L)。下室中加入含有10%灭活小牛血清的RPMI1640培养液。阴性对照组加入相应体积培养液。置于5%CO2、37℃、饱和湿度的细胞培养箱中培养36 h。取出小室,用棉签拭去小室内细胞和Matrigel胶,PBS冲洗,10%甲醛固定15 min,PBS冲洗,0.1%结晶紫染色30 min,清水冲洗后倒置显微镜下观察计数。每个样本随机取5个高倍镜视野(200×)计细胞数,取其平均值。
1.3.3 CCK-8法检测耐药细胞的增殖情况 将对数生长期细胞接种于96孔培养板,每孔5×103个细胞,实验组分别加入不同浓度的ATRA(1×10-7、5×10-7、1×10-6、5×10-6、1×10-5 mol/L),阴性对照组不加药物,空白对照组无细胞,仅加入相应体积的培养液,各组均设3个复孔。共培养24 h后吸去培养液,每孔加含CCK-8 10 μL的完全培养基100 μL,继续于37℃ 5%CO2培养箱中培养3 h,用酶联仪测450 nm处的OD值。
1.3.4 流式细胞仪检测耐药细胞的细胞周期 用胰酶将1×10-6 mol/L ATRA分别作用3、7 d的实验组细胞及对照组细胞消化成单细胞悬液,预冷过的70%乙醇固定细胞,4℃冰箱保存。上流式细胞仪检测前弃乙醇,加入RNA酶作用30 min,100 μg/mL PI染色液4℃避光染色30 min,细胞经300目过滤网后上机检测。各组测1×104个细胞,经计算机软件处理得出细胞周期各时相百分比(%)。实验重复3次。
1.3.5 半定量RT-PCR分析耐药细胞的c-myc基因表达 收集1×10-6 mol/LATRA分别作用3、7 d的细胞及对照组细胞,按SV总RNA分离试剂盒说明提取细胞RNA。引物序列设计如下:c-myc上游5'-CTC TCA ACG ACA GCA GCC CG-3',下游5'-AGG TGA TCC AGA CTC TGA CC-3';β-actin上游5'-CGT CTG GAC CTG GCT GGC CGG GAC C-3',下游5'-CTA GAA GCA TTT GCG GTG GAC GAT G-3'。扩增DNA片段大小:c-myc 250 bp,β-actin 600 bp。依据TaKaRa公司的one step RT-PCR试剂盒的操作说明,将反应体系置于DNA循环仪中,42℃逆转录60 min,合成互补DNA。95℃预变性5 min,再进行PCR循环。PCR循环条件:95℃变性1 min、56℃退火1 min、72℃延伸1 min。共计30个循环后,72℃延伸7 min。PCR扩增产物用2%琼脂糖凝胶电泳,紫外灯下检测拍照记录结果。采用HPIAS-2000型图像分析系统扫描测定,以基因β-actin作为内参照,计算c-myc mRNA的相对表达量并比较表达差异。实验重复3次。
1.4 统计学方法
用SPSS 17.0软件进行统计分析。计量资料用均数±标准差(x±s)表示。采用one-way ANOVA做多组均数比较。以P < 0.05为差异有统计学意义。
2 结果
2.1 各组细胞侵袭、转移能力的变化
Transwell小室检测细胞侵袭、转移能力结果显示:经ATRA处理过的HeLa/MMC细胞侵袭数及转移数均明显减少,且随着药物浓度增加,细胞侵袭数及转移数减少。与对照组比较,ATRA各浓度实验组的侵袭细胞数、转移细胞数差异有统计学意义(P < 0.05)。说明ATRA能抑制宫颈癌耐药细胞HeLa/MMC的侵袭和转移能力。见表1。
表1 全反式维甲酸对HeLa/MMC细胞侵袭、转移能力的影响(个,x±s)
注:与阴性对照组比较,*P < 0.05
2.2 CCK-8法测定耐药细胞的增殖情况
实验组经1×10-7、5×10-7、1×10-6、5×10-6、1×10-5 mol/L ATRA处理后的HeLa/MMC细胞,细胞增殖被抑制。ATRA在1×10-7 mol/L的低浓度下就有抑制耐药细胞株增殖作用,与阴性对照组比较差异有统计学意义(P < 0.05),且随着浓度递增,抑制作用逐渐增强。ATRA抑制耐药细胞增殖的作用存在一定的剂量依赖关系。见表2。
表2 全反式维甲酸对HeLa/MMC细胞的生长抑制作用(x±s)
注:与阴性对照组比较,*P < 0.05
2.3 流式细胞仪检测耐药细胞细胞周期的变化
HeLa/MMC细胞经1×10-6 mol/L ATRA处理3 d后细胞周期分布的变化,表现在细胞堆积在G1/G0期,而进入S期细胞相应减少。与对照组比较,差异有统计学意义(P < 0.05)。随着ATRA药物作用时间的延长,堆积在G1/G0期的细胞比例逐步升高,进入S期的细胞比例相应降低。提示ATRA能阻止HeLa/MMC细胞由G1/G0期进入S期。见表3。
表3 HeLa/MMC细胞周期分布(%,x±s)
注:与对照组比较,*P < 0.05;ATRA1实验组:1×10-6 mol/L全反式维甲酸处理3 d;ATRA2实验组:1×10-6 mol/L全反式维甲酸处理7 d
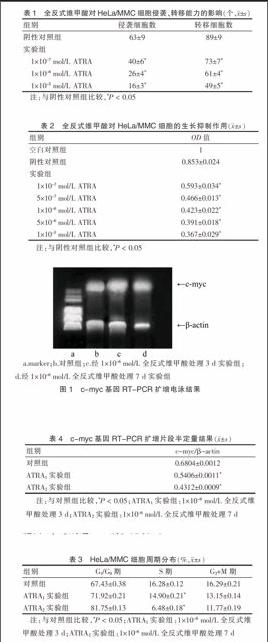
2.4 c-myc基因RT-PCR扩增片段的电泳结果
实验组和对照组(图1)均可见两条基因片段:250 bp的c-myc(目的基因)和600 bp的β-actin(内参基因)。经1×10-6 mol/LATRA分别处理3、7 d后的HeLa/MMC细胞c-myc mRNA相对表达量较对照组减少(见图1c、d)。
a.marker;b.对照组;c.经1×10-6 mol/L全反式维甲酸处理3 d实验组;d.经1×10-6 mol/L全反式维甲酸处理7 d实验组
图1 c-myc基因RT-PCR扩增电泳结果
2.5 c-myc基因RT-PCR扩增片段的半定量结果
对照组细胞c-myc mRNA相对表达量为(0.6804±0.0012)。细胞经1×10-6 mol/LATRA处理3 d后的c-myc mRNA相对表达量为(0.5406±0.0011),低于对照组。细胞经1×10-6 mol/LATRA作用至7 d时,c-myc mRNA相对表达量降至(0.4312±0.0009)。实验组与对照组比较,差异有统计学意义(P < 0.05),这提示ATRA抑制了c-myc癌基因的转录。见表4。
表4 c-myc基因RT-PCR扩增片段半定量结果(x±s)
注:与对照组比较,*P < 0.05;ATRA1实验组:1×10-6 mol/L全反式维甲酸处理3 d;ATRA2实验组:1×10-6 mol/L全反式维甲酸处理7 d
3 讨论
子宫颈癌是发生于宫颈上皮的恶性肿瘤,是女性最常见的生殖道恶性肿瘤。发病率近年来呈上升趋势,发病年龄趋于年轻化[7],危害年轻女性的生殖健康。化疗可以缩小肿瘤病灶,控制转移灶,在晚期宫颈癌的治疗中占有重要地位[8-9]。而且术前的新辅助化疗已可替代术前放疗,提高手术成功率,同时避免放疗引起女性卵巢功能的衰退。化疗联合手术、放疗的综合治疗,对于晚期宫颈癌患者改善预后、延长患者生存时间非常重要。然而化疗失败的主要原因是患者化疗过程中出现肿瘤耐药,化疗药无法杀灭肿瘤细胞。而且治疗过程中,容易出现肿瘤的播散、远处转移,影响患者预后。ATRA作为诱导分化剂,对于调节组织器官的功能和细胞的增殖、代谢、形态分化具有重要作用,以及调控机体生长发育以及维持内环境稳定等方面发挥重要作用[10]。国内有学者发现,ATRA可抑制兔颈动脉粥样硬化斑块中血管平滑肌细胞的迁徙转移,从而抑制兔颈动脉管腔的狭窄。其作用的分子机制是下调c-myc的表达[11]。本研究旨在观察ATRA对宫颈癌耐药细胞的侵袭、转移能力的影响及癌基因c-myc转录水平的变化,探讨ATRA应对宫颈癌化疗耐药的可行性及其作用的分子靶点。
恶性肿瘤细胞的侵袭和转移能力是其区别于正常细胞的生物学特征,也是导致恶性肿瘤患者肿瘤复发、转移的重要原因。本研究应用Transwell小室检测细胞侵袭、转移能力结果显示,ATRA可抑制宫颈癌耐药细胞HeLa/MMC的侵袭、转移能力,随着药物浓度的递增,肿瘤细胞的侵袭、转移数减少。本研究发现,适当浓度ATRA能抑制HeLa/MMC细胞增殖,降低其恶性度。CCK-8细胞增殖实验结果显示,1×10-7~1×10-5 mol/L的ATRA对耐药肿瘤细胞HeLa/MMC细胞的增殖有抑制作用,且这种抑制作用呈剂量依赖性。流式细胞仪检测结果显示,ATRA将肿瘤耐药细胞阻滞于G1期,使进入S期的细胞数明显减少。这从另一个角度说明ATRA使肿瘤耐药细胞阻滞于G1期,抑制肿瘤细胞的恶性增殖。
已有研究发现,肿瘤细胞中存在癌基因的异常过表达[8]。不同学者研究证实人宫颈癌及癌旁组织均有c-myc基因扩增,癌组织的扩增倍数高于癌旁组织。c-myc基因的激活和异常表达与宫颈鳞状上皮癌变过程密切相关[12]。笔者前期研究显示,耐药细胞株HeLa/MMC的恶性程度显著高于宫颈癌细胞HeLa。肿瘤细胞的侵袭、转移是个多阶段、多步骤过程,受多个基因、多个信号分子在时间、空间效应上的共同调节。经典癌基因c-myc位于人8号染色体,其编码的c-myc核蛋白,参与酪氨酸激酶信号通路,在调控肿瘤细胞增殖、侵袭、转移肿瘤耐药中起重要作用[13-14]。本研究发现ATRA下调耐药细胞癌基因c-myc的转录。随着ATRA作用时间的延长,HeLa/MMC细胞内癌基因c-mycmRNA的水平逐渐降低。故推测,ATRA可能通过转录水平下调HeLa/MMC细胞c-myc的表达,发挥其抑制宫颈癌耐药细胞侵袭、转移能力,同时诱导细胞G1期阻滞、抑制细胞增殖。由此,本研究认为c-myc基因是ATRA发挥抗肿瘤效应的关键“靶点”基因。
肿瘤化疗耐药是临床治疗恶性肿瘤的难点,也是恶性肿瘤患者预后差的重要原因。鉴于ATRA能抑制宫颈癌耐药细胞株HeLa/MMC的侵袭、转移,可以认为ATRA是一种很有前景的治疗耐药宫颈恶性肿瘤的药物,值得在其调控肿瘤耐药细胞增殖、侵袭、转移及作用机制方面的进一步深入研究。
[参考文献]
[1] Stavrids MP,Collins BJ,Storey KG. Retinoic acid orchestrates fibroblast growth factor signalling to drive embrynonic stem cell differentiation [J]. Development,2010, 137(6):881-890.
[2] 主鸿鹄,秦亚溱,赖悦云,等.维甲酸和砷剂联合诱导急性早幼粒细胞白血病中PML-RARα表达上调不影响预后[J].中国实验血液学杂志,2013,21(4):872-878.
[3] 郑培烝,周文娟,朱东辉,等.全反式维甲酸诱导NB4细胞分化过程中泛素-蛋白酶体系统的表达变化[J].福建医科大学学报,2012,46(5):297-300.
[4] Palomares T,García-Alonso I,San Isidro R,et al. All-trans-retinoic acid counteract the tumor-stimulating effect of hepatectomy and increases survival of rats bearing liver metastases [J]. J Surg Res,2014,188(1):143-151.
[5] 胡海燕,杨尚武,徐瑾.全反式维甲酸对宫颈癌细胞的生物学作用[J].海南医学院学报,2008,11(1):12-15.
[6] Shiota G,Kanki K. Retinoids and their target geges in liver functions and diseases [J]. J Gastroenterol Hepatol,2013, 28(suppl 1):33-37.
[7] Rydzewska L,Tierney J,Vale CL. Neoadjuvant chenmotherapy plus surgery versus surgery for cervical cancer [J]. Cochrane Database Syst Rev,2010,20(1):CD007406.
[8] Petry KU. HPV and cervical cancer [J]. Scand J Clin Lab Invest Suppl,2014,74(244):59-62.
[9] Robova H,Halaska M,Pluta M. The role of neoadjuvant chemotherapy and surgery in cervical cancer [J]. Int J Gynecol Cancer,2010,20(11):s42-s46.
[10] Gudas LJ. Retinoids induce stem cell differentiation via epigenetic changes [J]. Semin Cell Dev Biol,2014,8(2):803-808.
[11] 郭琳琳,董国雄,张社华,等.全反式维甲酸对兔颈动脉粥样硬化病变中c-myc表达及血管平滑肌细胞增生的影响[J].复旦学报:医学版,2006,33(4):526-529.
[12] Li T,Tang L,Bian T,et al. Detection of hTERC and c-MYC genes in cervical epithelial exfoliated cells for cervical cancer screening [J]. Int J Mol Med,2014,33(5):1289-1297.
[13] Lun YZ,Cheng J,Chi Q,et al. Transactivation of proto-oncogene c-Myc by hepatitis B virus transactivator MHBst167 [J]. Oncol Lett,2013,24(10-12):701-705.
[14] Riquelme E,Suraokar MB,Rodriguez J,et al. Frequent coamplification and cooperation between C-MYC and PVT1 oncogenes promote malignant pleural mesothelioma [J]. J Thorac Oncol,2014,9(7):998-1007.
(收稿日期:2014-10-16 本文编辑:张瑜杰)