吲哚美辛栓预防高危人群发生内镜逆行胰胆管造影术后胰腺炎给药时机的前瞻性研究
刘云燕,丁百静,陈明锴,曹中保,李生,杨勇,刘充,程珍
(1.皖南医学院附属芜湖市第二人民医院消化内科,安徽芜湖241000;2.武汉大学人民医院消化内科,湖北武汉430060)
吲哚美辛栓预防高危人群发生内镜逆行胰胆管造影术后胰腺炎给药时机的前瞻性研究
刘云燕1,丁百静1,陈明锴2,曹中保1,李生1,杨勇1,刘充1,程珍1
(1.皖南医学院附属芜湖市第二人民医院消化内科,安徽芜湖241000;2.武汉大学人民医院消化内科,湖北武汉430060)
摘要:目的探讨吲哚美辛栓预防高危人群发生内镜逆行胰胆管造影(ERCP)术后胰腺炎(PEP)的最佳给药时间。方法81例患者随机分为A组(术后立即给予吲哚美辛栓100 mg纳肛)、B组(术后30 min给予吲哚美辛栓100 mg纳肛)和C组(单纯常规处理组)。分别测术前、术后3、24及48 h血清C反应蛋白(CRP)、白细胞介素6(IL-6)、肿瘤坏死因子α(TNF-α)、血淀粉酶及尿淀粉酶等指标。结果A组ERCP术后PEP (4.00%)、B组(5.41%)均明显低于C组(26.31%)(P<0.05);A组(4.00%)、B组(13.51%)术后高淀粉酶血症发生例数均明显低于C组(31.6%)(P<0.05)。A组和B组之间的PEP及高淀粉酶血症发生率差异均无统计学意义(P>0.05)。结论ERCP术后立即或术后30 min经直肠给予吲哚美辛栓100 mg均能够有效降低PEP和术后高淀粉酶血症的发生率。
关键词:内镜逆行胰胆管造影;术后胰腺炎;C反应蛋白;白细胞介素6;肿瘤坏死因子α
Keywords: endoscopic retrograde cholangiopancreatography; post-ERCP pancreatitis; C reactive protein; interleukin 6; tumor necrosis factor-α
内镜逆行胰胆管造影(endoscopic retrograde cholangiopancreatography,ERCP)是目前诊断和治疗胆道、胰腺疾病的重要手段,而ERCP术后胰腺炎(post-ERCP pancreatitis,PEP)是ERCP手术后最常见的并发症。近年来的文献报道PEP的发生率为1.00%~10.00%,高危人群PEP发生率可高达30.00%[1]。目前认为引起PEP的发生是ERCP术后局限性和系统性炎症反应所致,而磷脂酶A2(phospholipase A2,PLA2)在这种炎症反应中发挥了重要的作用[2-4]。非甾体抗炎药(nonsteroidal antiinflammatory drugs,NSAIDs)药物作为一种PLA2抑制剂呈现了良好的作用[5]。欧洲消化内镜协会指南推荐术前或术后给予吲哚美辛或者双氯芬酸100 mg纳肛以预防PEP的发生[6]。但目前最佳给药时间尚未有明确的统一标准,故本研究通过前瞻性随机对照试验的方法,旨在探讨不同时间给予吲哚美辛栓纳肛进行干预,通过对比PEP的发生率、严重程度以及相关炎症指标,对比其预防PEP的效果。
1 资料与方法
1.1一般资料
经医院伦理委员会批准,将2013年5月-2014 年12月在本院消化内科住院部收治的因胆胰疾病拟接受ERCP的150例患者,均经患者及家属同意,术前均签署知情同意书。按照入选标准及排除标准,最终共81例患者资料入选本研究组。
1.1.1入选标准接受ERCP检查和治疗并具有发生PEP高危因素的患者,术前血淀粉酶正常者。若是患者满足以下主要标准中的一项或几项入组:①临床上可疑Oddis括约肌功能障碍;②有PEP既往史;③括约肌预切开;④插管困难;⑤胆道括约肌的球囊扩张术;⑥胰管括约肌切开;对以下次要标准符合两项及以上者也纳入入选标准:①年轻(<60岁);②女性患者;③有复发胰腺炎病史;④胰管注入造影剂3次或以上;⑤胰管内注射的造影剂导致胰腺腺泡浑浊化;⑥通过细胞刷收集到胰腺炎的细胞学标本[7-8]。
1.1.2排除标准有严重的心脑血管疾病者;不能接受内镜检查或治疗者;急性胰腺炎或慢性胰腺炎急性发作;术前血清淀粉酶值异常患者;妊娠期或哺乳期妇女;对NSAIDs有禁忌证者;有严重精神障碍者或疾病而不能配合的患者;试验期间使用其他类型NSAIDs药物。
从患者性别和平均发病年龄等一般情况来看,这3组之间差异无统计学意义,具有可比性,见表1。81例患者术前均无血清淀粉酶升高及胰腺炎病史,均成功完成ERCP术。
1.2研究方法
1.2.1 PEP诊断的Cotton标准ERCP术后3和24 h血淀粉酶超过正常测定值3倍以上,持续至少24 h,伴有持续腹痛者即诊断为PEP。若ERCP术后24 h血清淀粉酶升高大于正常值上限的3倍,但无明显腹痛、恶心、呕吐等临床症状及体征,即认为是高淀粉酶血症[9]。
1.2.2试验方法依据随机数字表将81例患者随机分成A组(术后立即给予吲哚美辛栓100 mg纳肛)、B组(ERCP术后30 min给予吲哚美辛栓100 mg纳肛)和C组(ERCP术后常规处理)。由于PEP的高危因素,尤其是与ERCP操作相关的高危因素,很多是在ERCP术中或术后才能判定,所以本研究未纳入ERCP术前给药组。所有ERCP操作由两位固定的操作熟练的内镜医师操作,患者按照随机数字表分组,给患者随机入组的操作者与ERCP操作人员由不同人员完成,以实现双盲。吲哚美辛栓为上海现代制药股份有限公司生产。术中常规吸氧,行心电及氧饱监护。最后根据随机数字,决定吲哚美辛栓纳肛的时机。术后一般禁食12~24 h,均常规给予抑酸药、抗生素和补液等对症处理。
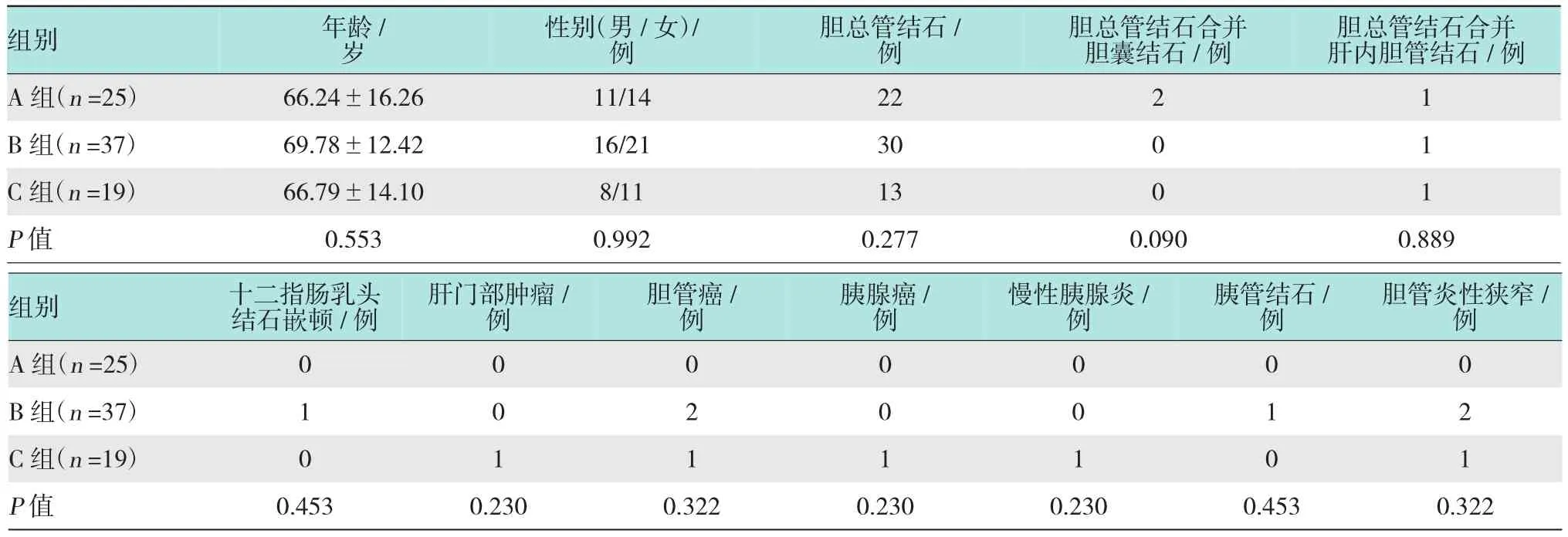
表1 3组患者的一般资料
1.2.3相关指标测定方法分别测ERCP术前、术后3、24和48 h的血淀粉酶、血清C反应蛋白(C reactive protein,CRP)、白细胞介素6(interleukin 6,IL-6)、肿瘤坏死因子α(tumor necrosis facror-α,TNF-α)及尿淀粉酶等指标,同时观察3组患者的腹痛、腹胀和发热等症状以及相应的体征变化。对于并发PEP的患者,采用Ranson标准对其胰腺炎的严重程度进行分级。
1.3统计学方法
应用SPSS 17.0统计软件进行统计学处理,计量资料,若符合正态分布,则用均值±标准差(±s)表示。计量资料采用重复测量的方差分析检验,对于满足球形检验,采用单变量方差分析,不满足球形检验时采用Gerrnhouse-Geisser校正方法,两两比较采用LSD检验。单变量计数资料采用χ2检验,如资料不符合χ2检验的条件,则采用Fisher's精确概率法进行检验。所有假设检验均为双侧检验,以P<0.05为差异具有统计学意义。
2 结果
2.1 ERCP术后各指标情况
2.1.1 ERCP术后血淀粉酶水平变化本研究中的3组患者术前以及术后各时段的血清淀粉酶变化见表2。术前及术后48 h测得的血淀粉酶3组之间差异无统计学意义(P>0.05)。
2.1.2 ERCP术后尿淀粉酶水平的变化本研究中的3组患者术前以及术后各时段的尿淀粉酶变化见表3。术前及术后48 h 3组尿淀粉酶之间差异无统计学意义(P>0.05)。
2.1.3 ERCP术后血清CRP的变化本研究中3组患者的不同时间点测的血清CRP水平如表4所示,术前及术后48 h各组患者的血清CRP值差异无统计学意义(P>0.05)。
表2 ERCP术后各组血清淀粉酶水平变化(u/L,±s)
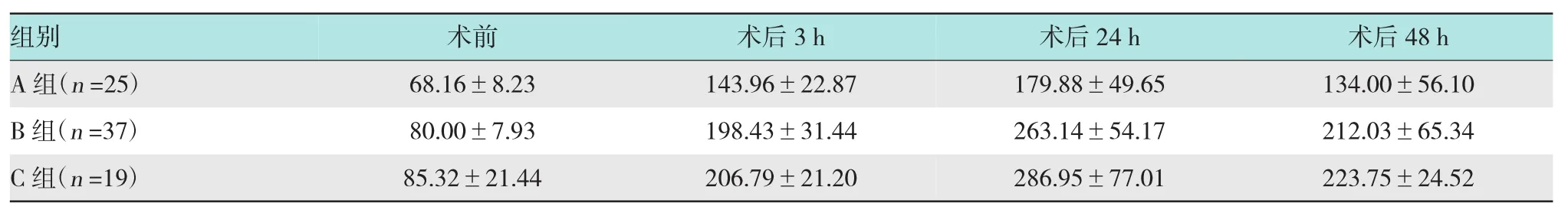
表2 ERCP术后各组血清淀粉酶水平变化(u/L,±s)
注:术后3 h A组血清淀粉酶明显低于B组和C组(P<0.05);术后24 h A组、B组的血清淀粉酶值较C组低(P<0.05)
组别术后48 h A组(n=25) 134.00±56.10 B组(n=37) 212.03±65.34 C组(n=19) 223.75±24.52术前 术后3 h 68.16±8.23 143.96±22.87 80.00±7.93 198.43±31.44 85.32±21.44 206.79±21.20术后24 h 179.88±49.65 263.14±54.17 286.95±77.01
表3 ERCP术后各组尿淀粉酶水平的变化(u/L,±s)
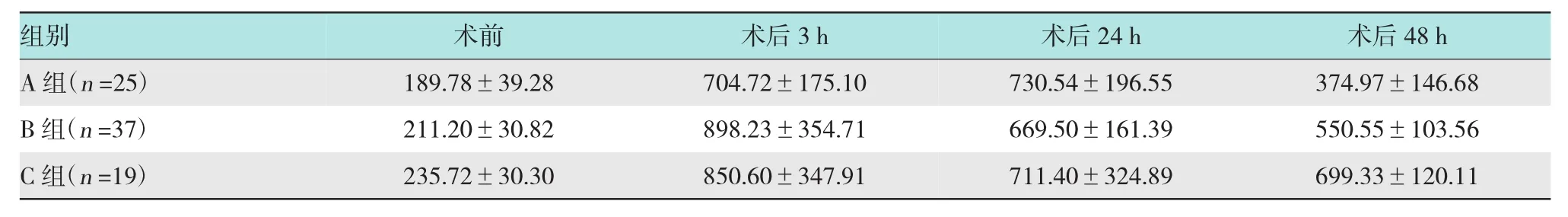
表3 ERCP术后各组尿淀粉酶水平的变化(u/L,±s)
注:术后3 h A组尿淀粉酶值明显低于B组和C组(P<0.05);术后24 h B组尿淀粉酶值明显低于A组和C组(P<0.05)
组别术后48 h A组(n=25) 374.97±146.68 B组(n=37) 550.55±103.56 C组(n=19) 699.33±120.11术前 术后3 h 189.78±39.28 704.72±175.10 211.20±30.82 898.23±354.71 235.72±30.30 850.60±347.91术后24 h 730.54±196.55 669.50±161.39 711.40±324.89
表4 ERCP术后各组血清CRP水平的变化(mg/L±s)
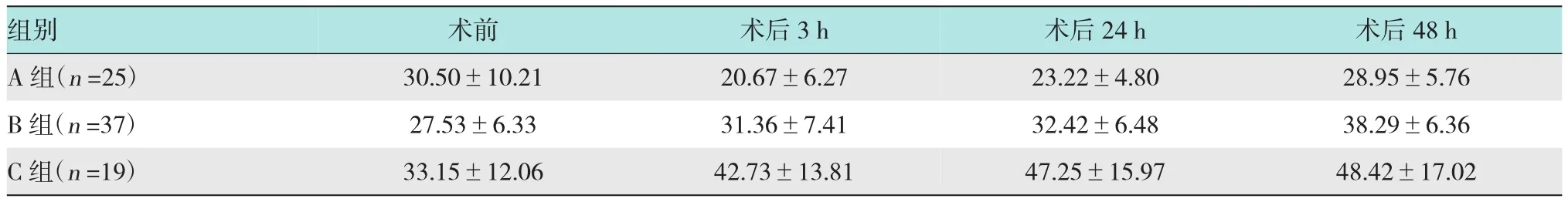
表4 ERCP术后各组血清CRP水平的变化(mg/L±s)
注:术后3和24 h C组血清CRP值明显高于A组和B组(P<0.05)
组别术后48 h A组(n=25) 28.95±5.76 B组(n=37) 38.29±6.36 C组(n=19) 48.42±17.02术前 术后3 h 30.50±10.21 20.67±6.27 27.53±6.33 31.36±7.41 33.15±12.06 42.73±13.81术后24 h 23.22±4.80 32.42±6.48 47.25±15.97
2.1.4 ERCP术后各组血清IL-6水平的变化本研究中各组患者术后血清IL-6值如表5所示。ERCP术前、术后3 h各组血清IL-6水平差异无统计学意义(P>0.05)。
2.1.5 ERCP术后血清TNF-α水平的变化本研究中各组患者ERCP术后血清TNF-α值如表6所示,术前、术后48 h 3组血清TNF-α之间差异无统计学意义(P>0.05)。
2.2 PEP和高淀粉酶血症发生情况
3组PEP总体发生率为9.88%(8/81),其中A 组PEP发生率为4.00%(1/25),B组PEP发生率为5.41%(2/37),C组PEP发生率为26.31%(5/19)。吲哚美辛纳肛的A组和B组PEP发生率明显低于C组(P<0.05),A组和B组之间PEP的发生率差异无统计学意义(P>0.05)。3组患者均无1例发生中至重度胰腺炎。此外,A、B和C 3组患者中共有12例发生术后高淀粉酶血症,分别为1、5和6例,吲哚美辛纳肛的A组和B组与C组之间高淀粉酶血症发生率差异均有统计学意义(P<0.05),A组和B组之间术后高淀粉酶血症的发生率差异无统计学意义(P=0.421)。
2.3不良反应
本次研究中共有1例发生不良反应,A组患者中术后有1例出现消化道出血,经禁食、加强抑酸等对症处理,症状得到控制。
表5 ERCP术后各组血清IL-6水平的变化(ng/ml,±s)
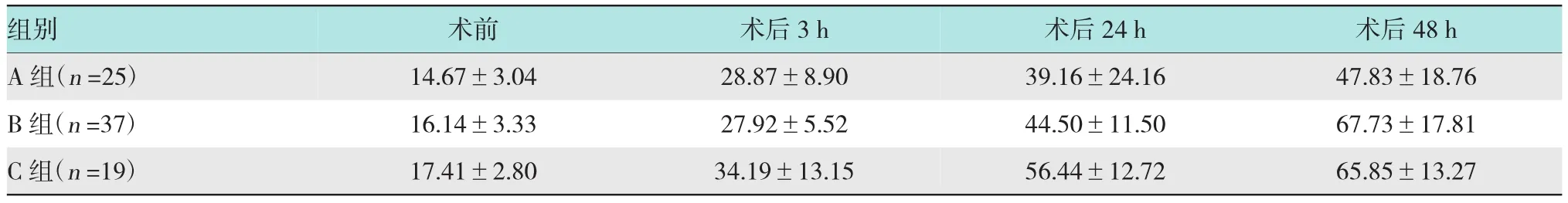
表5 ERCP术后各组血清IL-6水平的变化(ng/ml,±s)
注:术后24 h A组和B组血清IL-6值明显低于C组(P<0.05);术后48 h A组患者IL-6值明显低于B组和C组(P<0.05)
组别术后48 h A组(n=25) 47.83±18.76 B组(n=37) 67.73±17.81 C组(n=19) 65.85±13.27术前 术后3 h 14.67±3.04 28.87±8.90 16.14±3.33 27.92±5.52 17.41±2.80 34.19±13.15术后24 h 39.16±24.16 44.50±11.50 56.44±12.72
表6 ERCP术后各组血清TNF-α水平的变化(pg/ml±s)
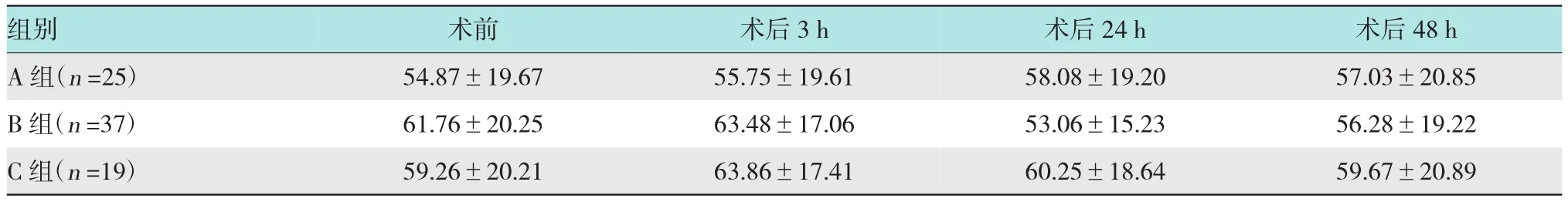
表6 ERCP术后各组血清TNF-α水平的变化(pg/ml±s)
注:术后3 h A组血清TNF-α水平明显低于B组和C组(P<0.05);术后24 h B组血清TNF-α水平明显低于A组和C组(P<0.05)
组别术后48 h A组(n=25) 57.03±20.85 B组(n=37) 56.28±19.22 C组(n=19) 59.67±20.89术前 术后3 h 54.87±19.67 55.75±19.61 61.76±20.25 63.48±17.06 59.26±20.21 63.86±17.41术后24 h 58.08±19.20 53.06±15.23 60.25±18.64
3 讨论
ERCP目前已经广泛应用于胆胰疾病的诊疗,但ERCP是一项高难度、高风险的技术,其术中、术后可能出现各种并发症,甚至会危及患者的生命。一项荟萃分析显示,在PEP中,轻症胰腺炎、中度重症胰腺炎及重症胰腺炎的发生率分别为45.00%、44.00%和11.00%,而在这些PEP中,约有3.00%的死亡率[10]。
吲哚美辛栓剂作为一种NSAIDs,对PEP的疗效已经得到众多研究的肯定。Elmunzer等[7]曾做了一项吲哚美辛栓预防高危病例发生PEP的临床随机对照试验,该试验纳入602例患者,干预组在ERCP术后立即直肠给予吲哚美辛栓剂,结果显示治疗组与安慰剂组比较PEP的发生率明显降低(9.20% vs 16.90%,P=0.005)。而国内钱建清等[11]采用前瞻性对照研究的方法,在ERCP术后30 min使用吲哚美辛栓经直肠肛塞,结果显示吲哚美辛栓组PEP发生率明显低于对照组(3.30% vs 8.40%,P<0.05),但高淀粉酶血症发生率差异无统计学意义。
NSAIDs预防PEP机制目前尚未完全明确,PLA2被认为是在PEP的炎症瀑布级联反应中发挥重要作用,NSAIDs则是一种强有力的PLA2抑制剂[12]。PLA2抑制剂可以抑制一些炎症因子的生成,如前列腺素、白三烯和血小板活化因子等[13]。一项研究提示NSAIDs可以通过促进NSAID激活基因(NSAID activated gene,NAG-1)的表达发挥抗炎作用[7],亦有研究表明,NAG-1可以降低脂多糖引起的炎症反应[14]。国内亦有研究表明,NSAIDs可增加内源性抗炎介质脂氧素A4及消褪素E1和D1水平[15]。
由于NSAIDs价格便宜,使用方便,短期使用无明显的副作用,因而运用NSAIDs预防PEP,尤其是在高危人群中呈现出了良好的前景。目前临床报道有多种给药途径,但荟萃分析[16]推荐经直肠给药,认为NSAIDs经直肠给药可有效、安全地预防PEP的发生。推测其可能原因为:经直肠途径给药的达到药物峰浓度需要30~90min,其生物利用度是100.00%,而经口途径,达药物峰浓度时间约为2 h,生物利用度是50.00%~60.00%[17],而且经直肠给药也可以避免NSAIDs可能引发上消化道出血的不良反应的发生。
血清CRP作为一种极为敏感的炎症及组织损伤的指标,被发现在胰腺炎患者中大量升高,并且可用来评估胰腺炎的严重程度及其预后情况。一般认为血清CRP≥150 mg/L,常提示胰腺炎预后不佳[18]。此外,各种原因而引起的胆管梗阻后由于肠道胆盐的缺乏导致大肠吸收大量内毒素而导致内毒素血症,因而引起血清炎性因子IL-6和TNF-α水平升高[19]。
既往的有关PEP病例中反应早期炎症的细胞因子的研究为数不多。Messmann等[20]曾报道了PEP患者在术后24 h血清IL-6水平会达到一个高峰,这与本研究相吻合。一直以来,炎症的级联反应被认为是在急性胰腺炎的发生发展过程中起到重要的作用,而TNF-α则被认为是在这种炎症级联反应中起到中央调节器的作用[21]。Vaccaro等[22]认为在急性胰腺炎时,胰腺腺泡细胞可以释放TNF-α,同时可以促进机体TNF-α受体的表达。
本研究提示不同的吲哚美辛栓给药时间,可能对于术后患者血液炎症因子的抑制的起效时间不同,术后立即给药有益于早期降低患者体内的炎症反应,而术后30 min给药可能在抑制患者体内的炎症反应的时间略晚。
本研究中A组和B组患者PEP和高淀粉酶血症发生率均明显低于对照组,但本研究中共有8例患者发生PEP,且均为轻症胰腺炎,经有效的术后常规处理措施,均很快恢复正常,无1例发展为中至重症胰腺炎。这提示吲哚美辛栓在预防PEP和高淀粉酶血症的发生中具有确切的疗效,这可能与吲哚美辛栓PLA2的活性有关,能够阻断炎症瀑布级联反应。
既往几乎无前瞻性对照研究不同时间给予吲哚美辛栓预防PEP疗效的报道,本研究发现吲哚美辛栓在预防高危人群PEP的发生是安全及有效的,但术后不同的给药时机之间差异无统计学意义,这可能也与本研究无重症胰腺炎的发生有关,使得这些炎症瀑布级联反应不是特别显著,所以不是在每个时段都表现出差异有统计学意义。但总体而言,术后立即给药能够在早期起到抑制炎症的级联反应,术后30 min给药能够在炎症发展的后期起到抑制炎症进展的作用。
同时,本研究也存在一些局限性。本实验中发生的PEP几乎无重症胰腺炎,所以一些重症PEP的炎症指标变化可能被忽略了;此外,如同其他疾病,PEP的病理学结果应该是胰腺炎诊断的金标准,其胰腺炎的组织学变化可能与血液和尿液标本中的变化有所差异。本实验中主要使用的标本是患者的血液和尿液标本,而无组织学标本,这主要是与获取人类胰腺炎的胰腺组织标本相当困难有关。由于本实验是一个单中心的随机对照试验,样本量还有待进一步加大,下一步进行一个大样本且多中心的前瞻性对照研究更多不同的给药时机,并且更加密切监测这些炎症因子指标可能是以后的研究方向,期许发现PEP发生发展过程中炎症因子更为细致的变化。
参考文献:
[1] Freeman ML. Pancreatic stents for prevention of post-endoscopic retrograde cholangiopancreatography pancreatitis[J]. Clin Gastroenterol Hepatol, 2007, 5(11): 1354-1365.
[2] Gross V, Leser HG, Heinisch A, et al. Inflammatory mediators and cytokines--new aspects of the pathophysiology and assessment of severity of acute pancreatitis[J]. Hepatogastroenterology, 1993, 40(6): 522-530.
[3] Bhatia M, Neoptolemos JP, Slavin J. Inflammatory mediators as therapeutic targets in acute pancreatitis [J]. Curr Opin Investig Drugs, 2001, 2(4): 496-501.
[4] Karne S, Gorelick FS. Etiopathogenesis of acute pancreatitis[J]. Surg Clin North Am, 1999, 79(4): 699-710.
[5] Makela A, Kuusi T, Schroder T. Inhibition of serum phospholipase-A2 in acute pancreatitis by pharmacological agents in vitro[J]. Scand J Clin Lab Invest, 1997, 57(5): 401-407.
[6] Dumonceau JM, Andriulli A, Deviere J, et al. European Society of Gastrointestinal Endoscopy (ESGE) Guideline: prophylaxis of post-ERCP pancreatitis[J]. Endoscopy, 2010, 42(6): 503-515.
[7] Elmunzer BJ, Scheiman JM, Lehman GA, et al. A randomized trial of rectal indomethacin to prevent post-ERCP pancreatitis[J]. N Engl J Med, 2012, 366(15): 1414-1422.
[8] Wang P, Li ZS, Liu F, et al. Risk factors for ERCP-related complications: a prospective multicenter study[J]. Am J Gastroenterol, 2009, 104(1): 31-40.
[9] Cotton PB, Lehman G, Vennes J, et al. Endoscopic sphincteroto-my complications and their management: an attempt at consensus[J]. Gastrointest Endosc, 1991, 37(3): 383-393.
[10] Andriulli A, Loperfido S, Napolitano G, et al. Incidence rates of post-ERCP complications: a systematic survey of prospective studies[J]. Am J Gastroenterol, 2007, 102(8): 1781-1788.
[11]钱建清,戴建军,王卫军,等.吲哚美辛对内镜下逆行性胰胆管造影术后胰腺炎的预防[J].中华胰腺病杂志, 2011, 11(5): 326-328.
[12] Dobronte Z, Szepes Z, Izbeki F, et al. Is rectal indomethacin effective in preventing of post-endoscopic retrograde cholangiopancreatography pancreatitis[J]. World J Gastroenterol, 2014, 20(29): 10151-10157.
[13] Marks JM, Dunkin BJ, Shillingstad BL, et al. Pretreatment with allopurinol diminishes pancreatography-induced pancreatitis in a canine model[J]. Gastrointest Endosc, 1998, 48(2): 180-183.
[14] Kim JM, Kosak JP, Kim JK, et al. NAG-1/GDF15 transgenic mouse has less white adipose tissue and a reduced inflammatory response[J]. Mediators Inflamm, 2013, 2013(6): 641851.
[15]赵孝文,鲍峻峻,胡翠,等.双氯芬酸钠预防内镜逆行胰胆管造影术后胰腺炎机制的临床研究[J].中华消化内镜杂志, 2014, 31(10): 575-578.
[16] Zheng MH, Xia HH, Chen YP. Rectal administration of NSAIDs in the prevention of post-ERCP pancreatitis: a complementary meta-analysis[J]. Gut, 2008, 57(11): 1632-1633.
[17] Dai HF, Wang XW, Zhao K. Role of nonsteroidal anti-inflammatory drugs in the prevention of post-ERCP pancreatitis: a meta-analysis[J]. Hepatobiliary Pancreat Dis Int, 2009, 8(1): 11-16.
[18] Schutte K, Malfertheiner P. Markers for predicting severity and progression of acute pancreatitis[J]. Best Pract Res Clin Gastroenterol, 2008, 22(1): 75-90.
[19]戴勇,董晋.梗阻性黄疸大鼠肝内TNF-α及血液中IL-6表达与肝损伤机制[J].青海医学院学报, 2012, 33(4): 273-277.
[20] Messmann H, Vogt W, Holstege A, et al. Post-ERP pancreatitis as a model for cytokine induced acute phase response in acute pancreatitis[J]. Gut, 1997, 40(1): 80-85.
[21] Kusske AM, Rongione AJ, Reber HA. Cytokines and acute pancreatitis[J]. Gastroenterology, 1996, 110(2): 639-642.
[22] Vaccaro MI, Ropolo A, Grasso D, et al. Pancreatic acinar cells submitted to stress activate TNF-alpha gene expression[J]. Biochem Biophys Res Commun, 2000, 268(2): 485-490.
(曾文军编辑)
论著
Timing of Indomethacin suppositories for the prevention of post-ERCP pancreatitis in high risk groups
Yun-yan Liu1, Bai-jing Ding1, Ming-kai Chen2, Zhong-bao Cao1, Sheng Li1, Yong Yang1, Chong Liu1, Zhen Cheng1
(1.Department of Gastroenterology, the Second People's Hospital of Wuhu affiliated to Wanan Medical College, Wuhu, Anhui 241000, China; 2.Department of Gastroenterology, Wuhan People's Hospital of Wuhan University, Wuhan, Hubei 430060, China)
Abstract:Objective A prospective randomized controlled trial was carried out to explore the best time of Indomethacin suppositories administration for the prevention of post-ERCP pancreatitis in high-risk groups. Methods 81 patients were enrolled in the study finally. Patients were randomized into group A (100 mg rectal Indomethacin suppositories was administrated immediately after ERCP), group B (100 mg rectal Indomethacin suppositories was administrated half an hour after ERCP) and group C (ERCP alone group, which did not give Indomethacin suppositories). The level of serum amylase, urine amylase, serum CRP, serum IL-6, serum TNF-α were measured before, 3 h, 24 h and 48 h after ERCP, and the incidence of PEP and hyperamylasemia were analyzed. Results There was 1 case (4.00 %) of PEP in group A, 2 cases (5.41 %) of PEP in group B and 5 cases (26.31 %) of PEP in group C; the incidences of PEP of group A and group B were significant lower than that in group C (P<0.05). There was 1 case (4.00 %) of hyperamylasemia in group A, 5 cases (13.51 %) of hyperamylasemia in group B and 6 cases (31.6 %) of hyperamylasemia in group C, and the incidences of hyperamylasemia of group A and group B were significant lower than that in group C (P<0.05). Conclusion Administration of 100 mg Indomethacin suppositories immediately or half an hour after ERCP can effectively reduce the incidence of PEP and hyperamylasemia.
[通信作者]丁百静,E-mail:baijingd@sina.com
收稿日期:2015-10-12
文章编号:1007-1989(2016)03-0023-06
DOI:10.3969/j.issn.1007-1989.2016.03.005
中图分类号:R576
文献标识码:A

