经静脉注射血管内皮抑制因子-2 对自发性高血压大鼠血流动力学影响的研究
陈长源,白明,康宏,赵存瑞,牛欢,乙成成,张钲
经静脉注射血管内皮抑制因子-2 对自发性高血压大鼠血流动力学影响的研究
陈长源,白明,康宏,赵存瑞,牛欢,乙成成,张钲
摘要
Effect of Intravenous Infusion of Vasostatin-2 on Hemodynamics in Experimental Rats With Spontaneous Hypertension
CHEN Chang-yuan, BAI Ming, KANG Hong, ZHAO Cun-rui, NIU Huan, YI Cheng-cheng, ZHANG Zheng.
Department of Cardiology, The First Hospital of Lanzhou University, Lanzhou (730000), Gansu, China
Corresponding Author: ZHANG Zheng, Email: zhangccu@163.com
Abstract
Objective: To observe the effect of the intravenous infusion of vasostatin-2 (VS-2) on hemodynamics in experimental rats with spontaneous hypertension (SH).
Methods: A total of 36 (14-16) weeks male SH rats with the mean body weight at (160-250) g were randomly divided into 6 groups: ①Control group, the rats received normal saline (100 μl/kg), ②Catestatin (20 μg/kg) group, ③VS-2 (5 μg/kg) group, ④VS-2 (10 μg/kg) group, ⑤VS-2 (20 μg/kg) group and ⑥VS-2 (40 μg/kg) group.n=6 in each group.The average blood pressure (BP), heart rate (HR) and baroreflex sensitivity (BRS) were monitored and compared upon VS-2 treatment and betweenVS-2 and catestatin treatments in conscious and freelance rats.
Results: Compared with prior treatment, VS-2 (20 μg/kg) and VS-2 (40 μg/kg) could obviously decrease the HR, BP and BRS in SH rats.In VS-2 (20 μg/kg) group, HR by bpm was (341.3 ± 19.3) vs (365.5 ± 25.5), BP by mmHg was (133.0 ± 8.9) vs (147.5 ± 11.2) and BRS by ms/mmHg was (0.52 ± 0.18) vs (0.37 ± 0.12); in VS-2 (40 μg/kg) group, HR was (348.8 ± 30.8) vs (374.5 ± 34.8), BP was (131.5 ± 9.3) vs (151.7 ± 10.8) and BRS was (0.53 ± 0.05) vs (0.38 ± 0.03), all P<0.01.Catestatin treatment could also decrease the HR as (318.7 ± 13.4) vs (365.5 ± 25.5), BP as (119.7 ± 7.3) vs (147.5 ± 11.2) and BRS as (0.58 ± 0.15) vs (0.35 ± 0.11), all P<0.01.Compared with catestatin (20 μg/kg), the rats received VS-2 (20 μg/kg) had the weaker reduction of HR as (318.7 ± 13.4) vs (341.3 ± 19.3), BP as (119.7 ± 7.3) vs (133.0 ± 8.9), all P<0.01, while BRS was similar as (0.58 ± 0.15) vs (0.52 ± 0.18), P>0.05.
Conclusion: Intravenous infusion of VS-2 may obviously affect HR, BP and BRS in experimental SH rats; compared with the same dosage of catestatin, VS-2 had the weaker reduction of HR, BP and BRS.
Key words Endostatins; Rats; Inbred SHR; Hemodynamics
(Chinese Circulation Journal, 2016,31:180.)
血管内皮抑制因子(vasostatin, VS)是嗜铬粒蛋白A(chromogranin A,CgA)经特异性组织蛋白酶在其N末端水解后产生的衍生多肽,包括vasostatin-1 (VS-1)和vasostatin-2 (VS-2)。既往研究发现,外源性CgA可导致离体大鼠心脏的负性肌力作用以及冠状动脉的舒张效应[1];也有研究显示,VS-1能够抑制内皮素-1(ET-1)诱导的动脉血管收缩作用进而产生血管舒张效应[2]。既往研究发现,VS-2可能通过抗炎作用减轻冠状动脉血管炎性病变,延缓心肌缺血的进展[3];但VS-2对活体动物模型的血压影响尚少见报道。既往文献认为,VS-2与VS-1分子结构极为相似,VS-2可能具有与VS-1相似的抑制EF-1诱导动脉血管收缩作用进而产生血管舒张效应[4]。我们通过前期研究发现,自发性高血压大鼠外周血中存在VS-2水平的表达异常;但是经静脉注射VS-2对自发性高血压大鼠动脉血压的影响尚不清楚。儿茶酚抑素(catestatin)由CgA C末端水解产生,具有抑制儿茶酚胺释放的效应,从而发挥降低血压作用;catestatin也是高血压患者危险分层和高血压发生的预测因子[5]。本研究拟通过对自发性高血压大鼠经静脉注射不同剂量的VS-2以及经静脉注射catestatin作为阳性对照以研究VS-2对自发性高血压大鼠动脉血压、心率及自主神经活性的影响,旨在阐明VS-2在高血压病程中的作用。
1 材料与方法
实验材料和动物分组:实验均按照中华人民共和国原卫生部动物实验标准和第二军医大学动物管理和实验标准执行。实验动物由第二军医大学动物实验中心提供。36只14~16周龄、体质量为160~250 g 自发性高血压雄性大鼠分为6组:生理盐水组(n=6):经股静脉导管注入生理盐水(100 μl/kg);catestatin组(n=6):经股静脉导管注入catestatin(20 μg/kg);极低剂量VS-2组(n=6):经股静脉导管注入VS-2(5 μg/kg);低剂量VS-2组(n=6):经股静脉导管注入VS-2(10μg/kg);中等剂量VS-2组(n=6):经股静脉导管注入VS-2(20 μg/kg);高剂量VS-2组(n=6):经股静脉导管注入VS-2(40 μg/kg)。利用清醒自由活动大鼠血流动力学动态监测技术监测静脉注射VS-2及catestatin对自发性高血压大鼠心率、平均动脉压及压力反射敏感性的影响。聚乙烯动静脉导管(PE10型)购自英国Smith公司;大鼠清醒自由活动血压连续记录装置(MPA-HBBS型) 购自上海奥尔科特生物科技有限公司。大鼠VS-2多肽购自美国Aviscera Bioscience公司,纯度为90%。大鼠catestatin多肽购自美国Phoenix Pharmaceuticals公司,纯度为≥90%。
血压、心率测定:用盐酸氯胺酮(50 mg/kg)及地西泮(5 mg/kg)腹腔注射麻醉大鼠。麻醉后手术分离股动脉和股静脉,经股静脉插入PE50静脉导管,经股动脉插入充满肝素溶液的PE10动脉导管,直至抵达腹主动脉。将动静脉导管缝合固定在股部肌肉上,并以引针将导管经皮下至颈背部皮肤穿出,再将引出的动静脉导管用自制马鞍固定在大鼠背部以防大鼠清醒后抓咬。术后动物麻醉清醒前注意保温,清醒后室温20~25℃单笼喂养,自由进食及饮用自来水,12 h昼间及12 h夜间循环(上午8时至晚上8时为白昼,晚上8时至次晨8时为黑夜),每天肝素生理盐水冲洗动静脉导管2次。
对术后恢复48 h的清醒自由活动大鼠测定收缩压、舒张压及心率。恒温(20~25℃)、恒湿(60%)及隔音环境下,将动静脉导管经转动装置与压力换能器连接。同时灌注三通管与恒速推注泵连接,以0.3 ml/h速度推注20 IU/ml的肝素生理盐水溶液。每搏血压信号经压力换能器转换为生物电信号,经采样板,由计算机实时记录每搏收缩压(SBP)、舒张压(DBP)及心率。适应2 h后,连续记录30 min基础SBP、DBP及心率,然后经股静脉导管注入VS-2 及catestatin,连续记录2 h,由于SBP、DBP及心率在给药100 min后即恢复至基线水平,故取给药100 min内的记录数据分析结果。
压力感受性反射敏感性测定:用改良的Smyth方法测定大鼠的压力感受性反射敏感性(BRS),即静脉注射去氧肾上腺素(5~10 μg/kg),使SBP升高(30±10)mmHg(1 mmHg=0.133 kPa)以刺激动脉压力感受器,在血压升高和心率改变之间存在大约1 s的时间延迟,即动脉压力感受器反射。同步记录SBP、DBP及心率,以最高SBP与最大心动周期相对应,以SBP为横坐标、心率为纵坐标做直线回归分析,求出相关系数,然后依次后退5~6次心率,取相关系数最大的直线方程,此直线的斜率即为BRS,代表压力感受器反射功能[6, 7]。取两次计算的平均值作为最终的结果。
统计学方法:采用SPSS13.0统计软件进行分析。正态分布的计量资料以均数±标准差(±s)表示,组内两均数比较采用配对的Student's t检验;组间两均数比较采用独立样本的Student's t检验;BRS分析采用Pearson线性相关分析,以P<0.05为差异具有统计学意义。
2 结果
2.16组自发性高血压大鼠用药前后心率的变化(表1)
生理盐水组注射生理盐水前后心率差异无统计学意义(P>0.05); catestatin组自发性高血压大鼠在注射catestatin后心率较注射前降低(P<0.01)。极低剂量VS-2组和低剂量VS-2组自发性高血压大鼠在注射VS-2前后的心率差异无统计学意义(P>0.05),但是中等剂量VS-2组和高剂量VS-2组自发性高血压大鼠在注射后心率较注射前降低(P<0.01)。用药后,中等剂量VS-2组自发性高血压大鼠心率显著高于catestatin组,差异有统计学意义(P<0.01)。
表1 6组自发性高血压大鼠用药前后心率的变化(n=6,±s)
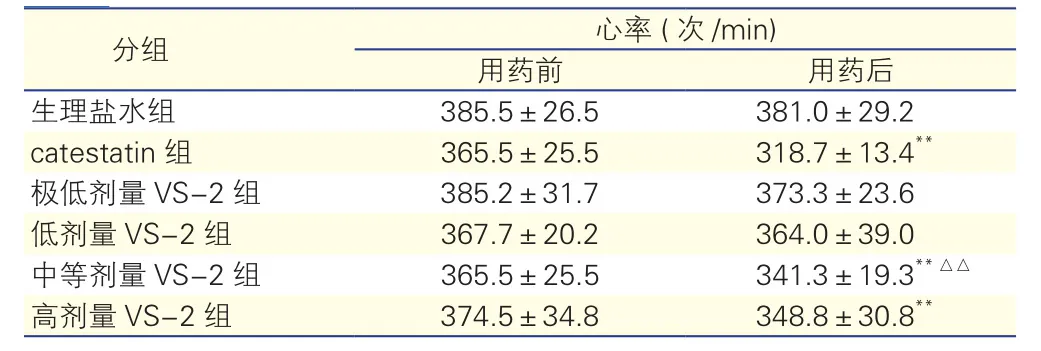
表1 6组自发性高血压大鼠用药前后心率的变化(n=6,±s)
注:VS-2:血管内皮抑制因子-2;catestatin:儿茶酚抑素。与组内用药前比**P<0.01;与catestatin组治疗后比△△P<0.01
分组 心率 (次/min)用药前 用药后生理盐水组 385.5±26.5 381.0±29.2 catestatin组 365.5±25.5 318.7±13.4**极低剂量VS-2组 385.2±31.7 373.3±23.6低剂量VS-2组 367.7±20.2 364.0±39.0中等剂量VS-2组 365.5±25.5 341.3±19.3**△△高剂量VS-2组 374.5±34.8 348.8±30.8**
2.26组自发性高血压大鼠用药前后平均动脉压的变化(表2)
生理盐水组自发性高血压大鼠在注射生理盐水前后平均动脉压(MBP)水平差异无统计学意义(P>0.05);catestatin组自发性高血压大鼠在注射catestatin后MBP较注射前降低(P<0.01)。极低剂量VS-2组及低剂量VS-2组自发性高血压大鼠在注射VS-2前后MBP差异无统计学意义(P>0.05),但是中等剂量VS-2组和高剂量VS-2组自发性高血压大鼠注射VS-2后MBP较注射前降低(P<0.01)。用药后,中等剂量VS-2组自发性高血压大鼠平均动脉压显著高于catestatin组,两组比较差异有统计学意义(P<0.01)。
表2 6组自发性高血压大鼠用药前后平均动脉压的变化(n=6,±s)
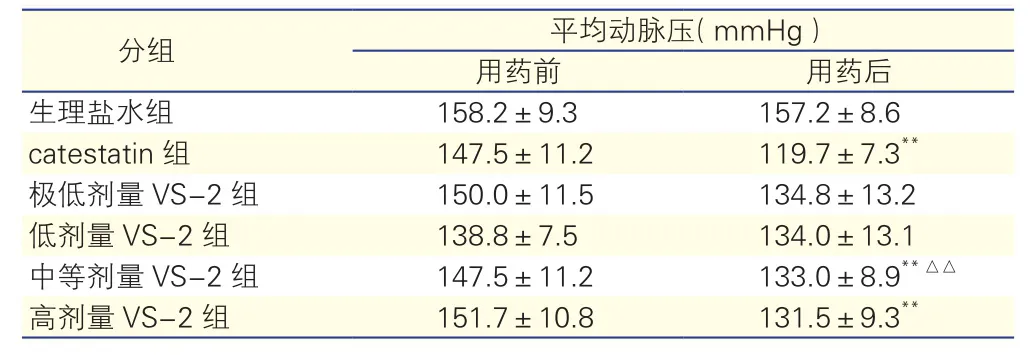
表2 6组自发性高血压大鼠用药前后平均动脉压的变化(n=6,±s)
注:VS-2:血管内皮抑制因子-2;catestatin:儿茶酚抑素。与组内用药前比**P<0.01;与catestatin组治疗后比△△P<0.01。1 mmHg=0.133 kPa
分组 平均动脉压(mmHg)用药前 用药后生理盐水组 158.2±9.3 157.2±8.6 catestatin组 147.5±11.2 119.7±7.3**极低剂量VS-2组 150.0±11.5 134.8±13.2低剂量VS-2组 138.8±7.5 134.0±13.1中等剂量VS-2组 147.5±11.2 133.0±8.9**△△高剂量VS-2组 151.7±10.8 131.5±9.3**
2.36组自发性高血压大鼠用药前后压力反射敏感性的变化(表3)
生理盐水组自发性高血压大鼠在注射生理盐水前后BRS水平差异无统计学意义(P>0.05);catestatin组自发性高血压大鼠在注射catestatin后BRS较注射前升高(P<0.01)。极低剂量VS-2组和低剂量VS-2组自发性高血压大鼠注射VS-2前后BRS差异无统计学意义(P>0.05),但是中等剂量VS-2组及高剂量VS-2组自发性高血压大鼠在注射VS-2后BRS较注射前升高,差异有统计学意义(P<0.01)。
表3 6组自发性高血压大鼠用药前后压力反射敏感性的变化(n=6,±s)
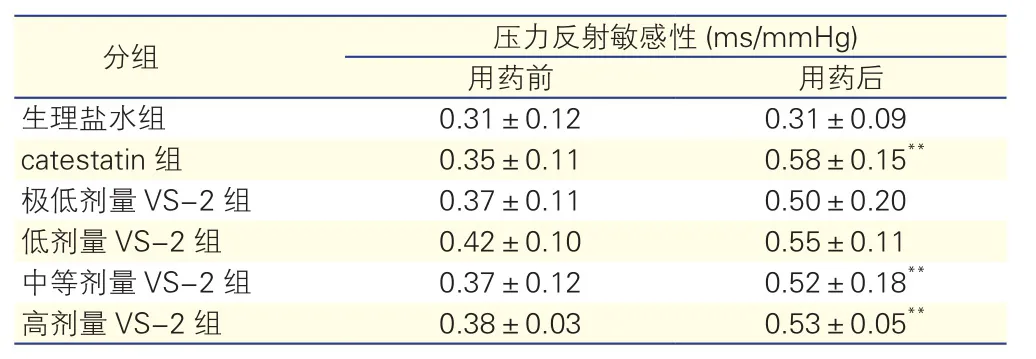
表3 6组自发性高血压大鼠用药前后压力反射敏感性的变化(n=6,±s)
注:VS-2:血管内皮抑制因子-2;catestatin:儿茶酚抑素。与组内用药前比**P<0.01。1 mmHg=0.133 kPa
分组 压力反射敏感性 (ms/mmHg)用药前 用药后生理盐水组 0.31±0.12 0.31±0.09 catestatin组 0.35±0.11 0.58±0.15**极低剂量VS-2组 0.37±0.11 0.50±0.20低剂量VS-2组 0.42±0.10 0.55±0.11中等剂量VS-2组 0.37±0.12 0.52±0.18**高剂量VS-2组 0.38±0.03 0.53±0.05**
3 讨论
VS-2是由CgA N末端水解产生的衍生多肽,Pasqua等[1]研究显示外源性全长CgA可导致离体大鼠心脏的负性肌力作用以及冠状动脉的舒张效应,此效应呈U型曲线,在外源性CgA为0.1~4 nmol/L浓度时发挥心脏负性肌力作用,而在1~4 nmol/L浓度时发挥冠状动脉舒张效应;这些心血管效应分别在外源性CgA为10 nmol/L和16 nmol/L浓度时消失。研究显示,VS-2具有与CgA同样的心脏抑制作用,在心血管系统发挥浓度依赖的抑制心肌收缩力和促使血管扩张的效应[8, 9]。Imbrogno等[10]研究显示重组人VS-2作用于美洲鳗鱼的心肌细胞,能够通过减少心肌每搏输出量及每搏做功发挥负性肌力作用,然而VS-2对动脉血压的直接作用尚无研究报道。因此我们推测VS-2可能在清醒自由活动的自发性高血压大鼠中发挥降压作用。我们研究结果表明,在自发性高血压大鼠中注射20 μg/kg 及40 μg/kg VS-2可以降低MBP、心率。我们研究同时发现,与同等剂量(20 μg/kg)的catestatin相比,VS-2对MBP、心率的影响水平较弱。
既往VS-2的研究集中于动物模型,仅Lu等[3]在冠心病患者中进行了血清VS-2与冠心病严重程度的相关性研究。在我们前期对VS-2在轻、中度高血压患者血浆中的表达水平研究中发现,与正常成人比较,轻中度高血压患者血浆VS-2水平明显增高(研究结果待发表)。根据既往研究结果,我们推测VS-2降低MBP及心率的作用机制可能通过拮抗肾上腺素诱导的正性肌力作用,抑制细胞水平儿茶酚胺效应,从而发挥心血管抑制作用,减轻心肌收缩力及促使动脉血管扩张,进一步的机制研究我们将在本研究之后进行。我们通过经静脉注射VS-2对自发性高血压大鼠血液动力学的影响研究,可能揭示了CgA衍生蛋白——VS-2在原发性高血压病程中的作用,这可能为未来原发性高血压的诊疗提供新的思路。
Catestatin是由CgA C末端水解产生的衍生多肽,在嗜铬粒细胞中通过拮抗尼古丁激活的儿茶酚胺分泌作用以及促进动脉血管局部组胺分泌,从而发挥动脉血管扩张和降低血压的作用[11, 12]。Fung等[13]在人体研究中发现,静脉注射catestatin能抑制肾上腺素的收缩血管作用从而产生降低血压的心血管效应,这种效应与catestatin剂量成正相关。Dev 等[14]研究发现,在CgA基因敲除小鼠模型中,给予catestatin可以改善严重高血压导致的BRS损害。Gaede等[15]研究发现,经大鼠延髓头端腹外侧区显微注射catestatin可以升高BRS。本研究中我们对catestatin的研究结果与上述研究结果一致。
动脉压力感受性反射(ABR)是调节心血管系统活动的重要机制[7],其主要功能是调节维持机体血压的稳定,通常用动脉BRS进行量化评价[16]。ABR功能损害与原发性高血压、动脉粥样硬化及心律失常等多种心血管疾病有关,研究表明,BRS功能缺陷普遍存在于高血压患者和高血压动物模型中,可以直接导致原发性高血压的靶器官损伤[17]。另据文献报道高血压时常伴有BRS敏感性降低[18-21]。我们研究结果表明,在自发性高血压大鼠中注射20 μg/kg及40 μg/kg VS-2可以升高BRS,提示VS-2可能通过调节过度激活的交感神经系统活性发挥心血管保护作用。我们研究同时发现,同等剂量的VS-2和catestatin对BRS的影响作用相似,提示VS-2在拮抗过度激活的交感神经系统活性方面的作用可能并不弱于catestatin。
本研究发现,在自发性高血压大鼠中注射20 μg/kg及40 μg/kg VS-2可以降低MBP、心率并升高BRS,表明VS-2可能在高血压病程中具有拮抗动脉血压升高、维持血管稳态的心血管保护效应。本研究同时发现,同等剂量VS-2的降压效应及对心率的影响作用可能弱于catestatin;限于条件,本研究仅对20 μg/kg VS-2与catestatin对血压、心率及BRS的影响进行了比较,这一研究结果可能需要未来更多实验进一步证实。本研究结果同时显示,VS-2对 BRS的调节作用与catestatin相似,提示VS-2可能具有与catestatin相近的心血管保护效应,能够拮抗心血管交感神经系统活性的过度激活,恢复交感-迷走神经平衡,改善压力反射调控。
综合以上研究结果,本研究表明,经静脉注射一定剂量的VS-2对自发性高血压大鼠的心率、MBP及BRS有显著影响;与同剂量catestatin比较,VS-2对血压的影响弱于catestatin。这一研究结果可能揭示了VS-2在原发性高血压病程中的作用,为未来原发性高血压的诊疗提供了新的思路。
参考文献
[1] Pasqua T, Corti A, Gentile S, et al.Full-length human chromogranin-a cardioactivity: myocardial, coronary, and stimulus-induced processing evidence in normotensive and hypertensive male rat hearts.Endocrinology, 2013, 154: 3353-3365.
[2] Aardal S, Helle KB, Elsayed S, et al.Vasostatins, comprising the N-terminal domain of chromogranin A, suppress tension in isolated human blood vessel segments.J Neuroendocrinol, 1993, 5: 405-412.
[3] Lu L, Wang YN, Li MC, et al.Reduced serum levels of vasostatin-2, an anti-inflammatory peptide derived from chromogranin A, are associated with the presence and severity of coronary artery disease.Eur Heart J, 2012, 33: 2297-2306.
[4] D'amico MA, Ghinassi B, Izzicupo P, et al.Biological function and clinical relevance of chromogranin A and derived peptides.Endocr Connect, 2014, 29: R45-54.
[5] Sahu BS, Sonawane PJ, Mahapatra NR.Chromogranin A: a novel susceptibility gene for essential hypertension.Cell Mol Life Sci, 2010, 67: 861-874.
[6] Fu YJ, Shu H, Miao CY, et al.Restoration of baroreflex function by ketanserin is not blood pressure dependent in conscious freely moving rats.J Hypertens, 2004, 22: 1165-1172.
[7] Liu AJ, Ma XJ, Shen FM, et al.Arterial baroreflex: a novel target for preventing stroke in rat hypertension.Stroke, 2007, 38: 1916-1923.
[8] Tota B, Angelone T, Cerra MC.The surging role of Chromogranin A in cardiovascular homeostasis.Front Chem, 2014, 2: 64.
[9] Helle KB, Corti A.Chromogranin A: a paradoxical player in angiogenesis and vascular biology.Cell Mol Life Sci, 2015, 72: 339-348.
[10] Imbrogno S, Angelone T, Corti A, et al.Influence of vasostatins, the chromogranin A-derived peptides, on the working heart of the eel(Anguilla Anguilla): negative inotropy and mechanism of action.Gen Comp Endocrinol, 2004, 139: 20-28.
[11] Mahata SK, Mahata M, Fung MM, et al.Catestatin: a multifunctional peptide from chromogranin A.Regul Pept, 2010, 162: 33-43.
[12] Kennedy BP, Mahata SK, O' Connor DT, et al.Mechanism of cardiovascular actions of the chromogranin A fragment catestatin in vivo.Peptides, 1998, 19: 1241-1248.
[13] Fung MM, Salem RM, Mehtani P, et al.Direct vasoactive effects of the chromogranin A (CHGA) peptide catestatin in humans in vivo.Clin Exp Hypertens, 2010, 32: 278-287.
[14] Dev NB, Gayen JR, O'Connor DT, et al.Chromogranin a and the autonomic system: decomposition of heart rate variability and rescue by its catestatin fragment.Endocrinology, 2010, 151: 2760-2768.
[15] Gaede AH, Pilowsky PM.Catestatin in rat RVLM is sympathoexcitatory, increases barosensitivity, and attenuates chemosensitivity and the somatosympathetic reflex.Am J Physiol Regul Integr Comp Physiol, 2010, 299: R1538-R1545.
[16] Goodfriend TL, Elliott ME, Catt KJ.Angiotensin receptors and their antagonists.N Engl J Med, 1996, 334: 1649-1654.
[17] Clozel JP, Fischli W.Comparative effects of three different potent rennin inhibitors in primates.Hypertension, 1993, 22: 9-17.
[18] Siché JP, Longère P, DeGaudemaris R, et al.Variability in arterial blood pressure at rest depends on the sensitivity of the baroreflex.J Hypertens Suppl, 1993, 11: S176-177.
[19] Parmer RJ, Hustine H, Cervenka RT, et al.Baroreflex sensitivity and heredity in essential hypertension.Circulation, 1992, 85: 497-503.
[20] Gerritsen J, Dekker JM, TenVoorde BJ, et al.Impaired autonomic function is associated with increased mortality, especially in subjects with diabetes, hypertension, or a history of cardiovascular disease: the Hoorn Study.Diabetes Care, 2001, 24: 1793-1798.
[21] Bristow JD, Honour AJ, Pickering GW, et al.Diminished baroreflex sens itivity in high blood pressure.Circulation, 1969, 39: 48-54.
(编辑:许菁)
病例报告
收稿日期:(2015-07-29)
中图分类号:R54
文献标识码:A
文章编号:1000-3614(2016)02-0180-05
doi:10.3969/j.issn.1000-3614.2016.02.018
作者简介:陈长源 主治医师 博士 主要从事冠心病基础与临床研究 Email: chenchangyuan.75@163.com 通讯作者:张钲 Email: zhangccu@163.com
基金项目:兰州大学中央高校基本科研业务费专项资金资助(lzujbky-2013-218)
目的:观察经静脉注射血管内皮抑制因子-2(vasostatin-2,VS-2)对自发性高血压大鼠血流动力学的影响。
方法:36只14~16周龄、体质量为160~250 g的自发性高血压雄性大鼠分为6组:生理盐水组(n=6):经股静脉导管注入生理盐水(100 μl/kg);儿茶酚抑素(catestatin)组(n=6):经股静脉导管注入catestatin(20 μg/kg);极低剂量VS-2组(n=6):经股静脉导管注入VS-2(5 μg/kg);低剂量VS-2组(n=6):经股静脉导管注入VS-2(10 μg/kg);中等剂量VS-2组(n=6):经股静脉导管注入VS-2(20 μg/kg);高剂量VS-2组(n=6):经股静脉导管注入VS-2(40 μg/kg)。利用清醒自由活动大鼠血流动力学动态监测技术监测静脉注射VS-2及catestatin对自发性高血压大鼠平均动脉压、心率及压力反射敏感性的影响。
结果:与用药前相比,中等剂量VS-2及高剂量VS-2显著降低自发性高血压大鼠的心率、平均动脉压并升高压力反射敏感性[中等剂量VS-2组:(341.3±19.3)次/min vs(365.5±25.5)次/min、(133.0±8.9)mmHg (1 mmHg=0.133 kPa) vs(147.5±11.2)mmHg、(0.52±0.18)ms/mmHg vs(0.37±0.12) ms/mmHg;高剂量VS-2 组:(348.8±30.8)次/min vs (374.5±34.8)次/min、(131.5±9.3) mmHg vs (151.7±10.8) mmHg、(0.53±0.05) ms/mmHg vs(0.38±0.03)ms/mmHg,P均<0.01];catestatin也显著降低自发性高血压大鼠的心率、平均动脉压并升高压力反射敏感性[(318.7±13.4)次/min vs(365.5±25.5)次/min、(119.7±7.3)mmHg vs(147.5±11.2)mmHg、(0.58±0.15)ms/mmHg vs(0.35±0.11)ms/mmHg,P均<0.01);同等剂量(20μg/kg)的VS-2与catestatin比较,VS-2对心率、平均动脉压的影响较弱 [(341.3±19.3)次/min vs(318.7±13.4)次/min、(133.0±8.9)mmHg vs(119.7±7.3)mmHg,均P<0.01),但是对压力反射敏感性的影响两者差异无统计学意义[(0.52±0.18)ms/mmHg vs(0.58±0.15)ms/ mmHg,P>0.05]。
结论:经静脉注射一定剂量的VS-2对自发性高血压大鼠的心率、平均动脉压及压力反射敏感性有显著影响。与同剂量(20μg/kg)的catestatin比较,VS-2对血压的影响较弱。关键词 内皮抑素类;大鼠;近交SHR;血流动力学
作者单位:730000 甘肃省兰州市,兰州大学第一医院 心脏中心

