肾动脉支架置入术联合规范药物治疗对粥样硬化性肾动脉狭窄患者的疗效
李彬,彭猛,蒋雄京,董徽,邹玉宝,宋雷,张慧敏,吴海英,杨跃进,高润霖
肾动脉支架置入术联合规范药物治疗对粥样硬化性肾动脉狭窄患者的疗效
李彬,彭猛*,蒋雄京,董徽,邹玉宝,宋雷,张慧敏,吴海英,杨跃进,高润霖
摘要
关键词肾动脉梗阻;支架;肾小球滤过率;药物治疗
作者单位:100037 北京市,北京协和医学院 中国医学科学院 国家心血管病中心 阜外医院 高血压中心
Efficacy of Renal Artery Stenting Combining Optimal Drug Therapy in Patients With Atherosclerotic Renal Artery Stenosis
LI Bin, PENG Meng, JIANG Xiong-jing, DONG Hui, ZOU Yu-bao, SONG Lei, ZHANG Hui-min, WU Hai-ying, YANG Yue-jin, GAO Ren-lin.
Department of Cardiology, Cardiovascular Institute and Fu Wai Hospital, CAMS and PUMC, Beijing (100037), China
Corresponding Author: JIANG Xiong-jing, Email:jxj103hotmail.com
Abstract
Objective: To evaluatethe efficacy of renal artery stenting combining optimal drug therapy in patients with atherosclerotic renal artery stenosis.
Methods: This is a prospective cohort study for patients who received percutaneous renal artery stenting in our hospital from 2011-09 to 2013-03.All patients had confirmed diagnosis of atherosclerotic renal artery stenosis combing hypertension and/or renal functional damage.Thepatients received optimal drug therapy for anti-platelet and blood pressure, lipids, glucose controlling, and they were followed-up for at least 12 months to observe the improvement of blood pressure and renal function.
Results: There were 149 patients at the mean age of (61.54 ± 9.63) years and 185 renal artery stenosis with stent implantation; the average stenosis rate was (83.11±7.30) % and the success rate of operation was 99.32% (148/149).During follow-up period, the patients had increased estimated glomerular filtration rate (GFR) compared to base line from (76.49 ± 22.50) ml/(min·1.73 m2) to (84.09 ± 28.79) ml/(min·1.73 m2), P<0.05 and decreased 24 h urinary protein from 0.1(IQR 0.02, 0.5) g to 0.04 (IQR0.01, 0.11)g, P<0.001; less type of drug therapy for hypertension from 2.22 to 1.56, P<0.05, decreasedclinical and 24h dynamic systemic/diastolic blood pressure from (153.4 ± 15.6)/(83.77 ± 12.60) mmHg to (134.6 ± 14.4)/ (73.57 ± 9.12) mmHg and from (143.32 ± 19.87)/(80.51 ± 11.33) mmHg to (124.44 ± 14.90)/(69.09 ± 9.49) mmHg, all P<0.05.
Conclusion:Renal artery stenting combining optimal drug therapy may improve blood pressure controlling and renal function in strictly selected patients with atherosclerotic renal artery stenosis.
Key words Renal artery obstruction; Stent; Glomerular filtration rate; Drug therapy
(Chinese Circulation Journal, 2016,31:122.)
动脉粥样硬化是肾动脉狭窄的常见病因[1],主要累及肾动脉开口及近段,呈进行性加重,常引起肾血管性高血压及肾功能损害。肾动脉血运重建是治疗肾动脉狭窄的主要措施,经皮肾动脉支架置入术(percutaneous renal artery stenting,PRAS)以其创伤小、安全性高的优势,正成为粥样硬化性肾动脉狭窄(atherosclerotic renal artery stenosis,ARAS)的首选治疗方法,但其临床疗效仍有很大争议[2]。近年发表的随机对照研究显示,与单纯药物治疗相比,PRAS并不能带来额外的获益[3-5]。但这些随机对照研究都存在一些缺陷[6]:如平均每个中心每年入选的病例数目较少;入选标准过于宽泛,未确定行支架置入术的肾动脉是否存在功能意义。在介入标准严格、流量大的医疗中心,临床实践结果表明PRAS安全有效[7, 8]。我院作为国际上最大的PRAS中心之一,对ARAS有严格的介入治疗标准和规范的药物治疗方案,自2003年起,每年PRAS手术量可达70例以上,2008年后每年150例以上。本研究旨在评估PRAS联合规范药物治疗对伴有功能意义的ARAS患者的临床疗效。
1 资料与方法
研究对象:本研究为前瞻性队列研究,研究对象为2011-09至2013-03于我院行PRAS的ARAS患者。所有患者均符合ARAS的诊断并伴有导致高血压和(或)肾功能损害的功能意义。ARAS诊断标准为:(1)至少具有1个动脉粥样硬化的危险因素(糖尿病、高脂血症、年龄>40岁、吸烟)[9];(2)至少具有2项提示动脉粥样硬化的影像学表现(肾动脉锥形狭窄或闭塞;偏心性狭窄;不规则斑块;钙化;主要累及肾动脉近段及开口;其他腹部血管动脉粥样硬化的表现)[10]。
入选标准:(1)年龄40~75岁;(2)肾动脉主干或主要分支直径狭窄≥60%,若直径狭窄为60%~75%,则必须具备病变远、近端压差≥20 mmHg(1 mmHg=0.133 kPa)或卡托普利肾图阳性;(3)未服降压药时收缩压≥180 mmHg和(或)舒张压≥110 mmHg;或者服用包括一种利尿剂在内的三种降压药治疗后血压仍不能控制在140/90 mmHg以下;(4)患侧肾脏长度>7.0 cm。
排除标准:(1)估算肾小球滤过率(eGFR)<30 ml/(min·1.73 m2) [eGFR= 186.3×血肌酐(mg/dl)-1.154 ×年龄-0.203(若为女性×0.742)[11]];(2)陈旧性心肌梗死,急性冠状动脉综合征;(3)肾动脉病变的解剖条件不适合进行介入治疗;(4)对二氢吡啶类过敏;(5)Ⅲ度房室传导阻滞;(6)造影剂过敏;(7)任何已知的恶性肿瘤;(8)不遵医嘱、酗酒或药物滥用史;(9)病情不稳定,无法耐受PRAS。
该研究获得阜外医院伦理委员会的批准,所有入组研究的患者都签署了知情同意书。
介入治疗:所有患者均行PRAS,若支架置入后残余狭窄<30%,且无手术相关严重并发症则视为手术成功,反之为手术失败。抗血小板药物治疗:术前口服阿司匹林(100 mg,1次/d)、氯吡格雷(75 mg,1次/d)至少2天;若手术当天开始服药,则予氯吡格雷150 mg 顿服;术后阿司匹林(100 mg,1次/d)长期维持服用、氯吡格雷(75 mg,1次/d)至少服用3个月。
药物治疗:术前1周内开始服用乐卡地平(10~20 mg,1次/d),可根据血压水平加用酒石酸美托洛尔(25~50 mg,2次/d)和氢氯噻嗪(12.5~25 mg,1次/d)。一般高血压患者的降压目标为<140/90 mmHg,65岁以上老年人降压目标为<150/90 mmHg,如能耐受可进一步降低<140/90 mmHg;糖尿病、肾脏病和冠心病患者的降压目标为<130/80 mmHg[12]。PRAS术后根据血压情况调整降压药物,如血压<100/60 mmHg则减量或减药,血压未达目标值可加量或增药。加药先后顺序为乐卡地平、酒石酸美托洛尔、氢氯噻嗪;减药先后顺序为氢氯噻嗪、酒石酸美托洛尔、乐卡地平。高脂血症患者给予瑞舒伐他汀钙调脂,血脂控制目标为总胆固醇<5.18 mmol/L,低密度脂蛋白胆固醇<3.37 mmol/L;高危患者血脂控制目标为总胆固醇<3.11 mmol/L,低密度脂蛋白胆固醇<2.07 mmol/L[13]。糖尿病患者按照指南控制血糖,目标是空腹或餐前血糖达到3.9~5.6 mmol/L,餐后2 h血糖达到4.4~6.7 mmol/L;糖化血红蛋白尽可能控制在6.0%以下[14]。
随访:所有患者在术后3、6、12个月均门诊复查,测量诊室血压、24 h动态血压,检查血肌酐水平,并记录降压药物服用情况及不良事件。如果患者术后血压水平大幅度下降后又恢复至术前水平或舒张压升高>15 mmHg,考虑肾动脉再狭窄,则进行血管造影复查。血肌酐水平判断:术前血肌酐水平<133 μmol/L为正常,133~177 μmol/L为轻度异常,血肌酐>177 μmol/L为严重异常。术后血肌酐变化情况:(1)改善,血肌酐下降16.7 μmol/L以上;(2)无变化,血肌酐波动±16.7 μmol/L;(3)恶化,血肌酐升高16.7 μmol/L以上。术后血压变化评估:(1)治愈,停用所有降压药且血压< 140/90 mmHg;(2)改善,降压药与术前相同而血压较基线水平下降10%以上或者降压药较术前减少而血压较基线水平下降10%以内;(3)无效,达不到(1)或(2)的标准。
统计学方法:使用SPSS 17.0统计软件处理数据。计量资料以均数±标准差(±s)表示,计数资料以百分比(%)表示。同一个体不同时间测量的变量使用配对的t检验来比较分析。当P<0.05时认为差异有统计学意义。
2 结果
研究对象基线人口学及临床特征(表1):共入组149例ARAS患者,男性106例(71.1%),平均年龄(61.54±9.63)岁,多伴有2型糖尿病、高脂血症及冠心病。造影发现狭窄肾动脉共208条,平均狭窄率为(81.04±11.58)%,双侧肾动脉狭窄62例(41.6%)。共185条肾动脉行PRAS,平均狭窄率为(83.11±7.30)%,其中近端或开口病变174处,中远段病变11处。手术成功率为99.32% (148/149)。
PRAS对肾功能的影响:(1)eGFR水平:与基线eGFR水平[(76.49±22.50)ml/(min·1.73 m2)]相比,患者PARS术后3个月[(85.77±29.36)ml/ (min·1.73 m2)]、6个月[(83.25±28.50)ml/(min·1.73 m2)]及12个月[(84.09±28.79)ml/(min·1.73 m2)]时的eGFR显著升高,P均<0.05(图1)。(2)血清肌酐水平:术后12个月时,血肌酐较基线下降者37例(24.8%),无变化者99例(66.4%),血肌酐升高者13例(8.7%);在基线时血肌酐异常(血肌酐≥133 μmol/L)的14例患者中,血肌酐下降者8例(57.1%),无变化者6例(42.9%)。(3)24 h尿蛋白:患者24 h尿蛋白术后6个月[0.05(四分位间距0.01,0.12)g]及12个月[0.04(四分位间距0.01,0.11)g]较基线[0.1(四分位间距0.02,0.5)g]均明显下降,P均<0.001(图2)。
表1 研究对象基线人口学及临床特征(±s)
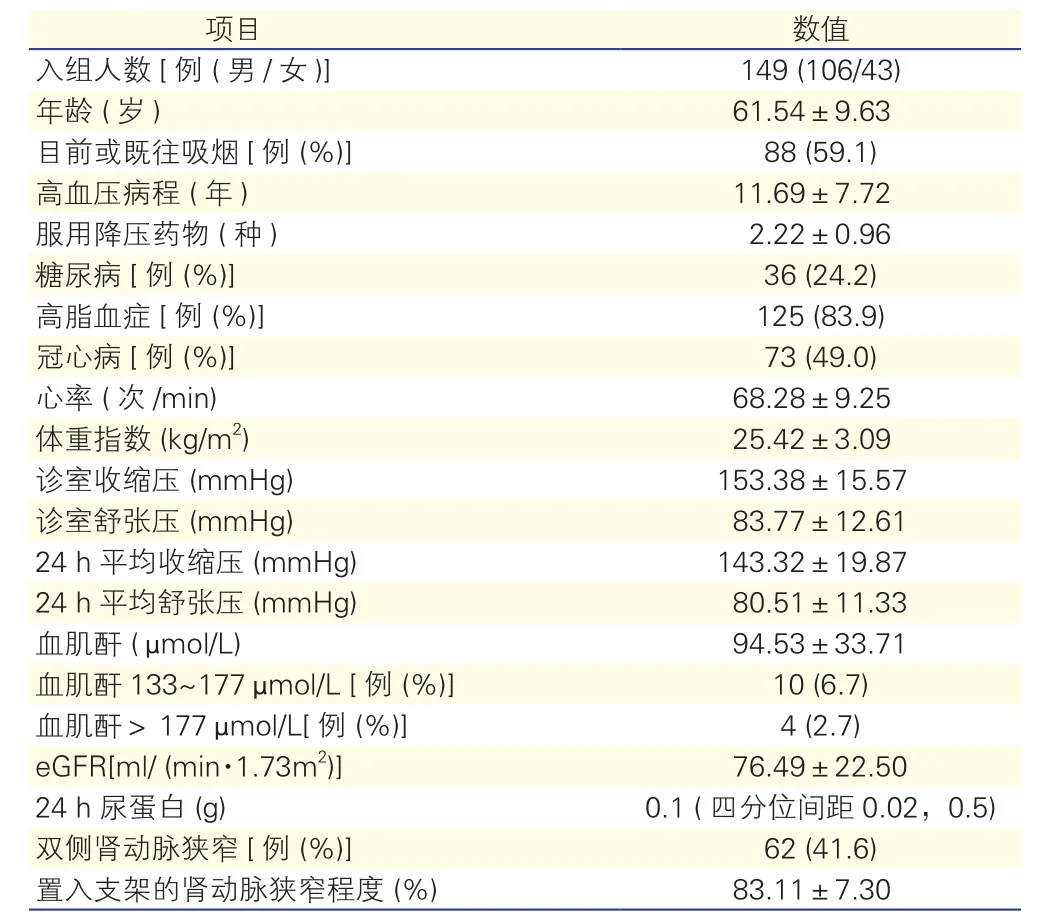
表1 研究对象基线人口学及临床特征(±s)
注:eGFR:估算肾小球滤过率。1 mmHg=0.133 kPa
项目 数值入组人数[例 (男/女)] 149 (106/43)年龄 (岁) 61.54±9.63目前或既往吸烟[例 (%)] 88 (59.1)高血压病程 (年) 11.69±7.72服用降压药物 (种) 2.22±0.96糖尿病[例 (%)] 36 (24.2)高脂血症[例 (%)] 125 (83.9)冠心病[例 (%)] 73 (49.0)心率 (次/min) 68.28±9.25体重指数 (kg/m2) 25.42±3.09诊室收缩压 (mmHg) 153.38±15.57诊室舒张压 (mmHg) 83.77±12.61 24 h平均收缩压 (mmHg) 143.32±19.87 24 h平均舒张压 (mmHg) 80.51±11.33血肌酐 (μmol/L) 94.53±33.71血肌酐133~177μmol/L [例 (%)] 10 (6.7)血肌酐>177μmol/L[例 (%)] 4 (2.7) eGFR[ml/ (min·1.73m2)] 76.49±22.50 24 h尿蛋白 (g) 0.1 (四分位间距0.02,0.5)双侧肾动脉狭窄[例 (%)] 62 (41.6)置入支架的肾动脉狭窄程度 (%) 83.11±7.30
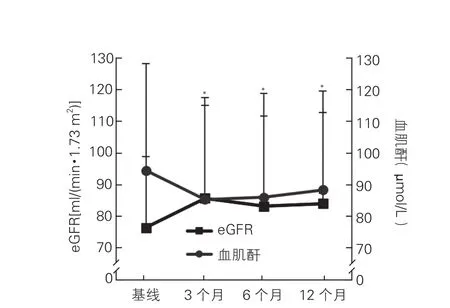
图1 149例患者经皮肾动脉支架置入术后3、6、12个月血肌酐及eGFR变化
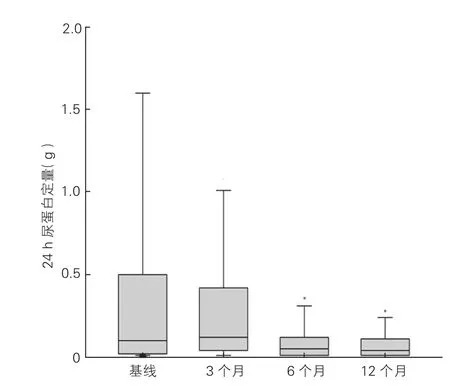
图2 149例患者经皮肾动脉支架置入术后3、6、12个月24 h尿蛋白定量变化
PRAS对血压的影响:在血压控制方面,患者术后3、6、12个月时服用降压药物的种数[依次为(1.54±0.78)种、(1.58±0.80)种和(1.56±0.82)种]较基线[(2.22±0.96)种]明显减少(P均<0.001)。术后3、6及12个月时,患者诊室收缩压和舒张压较基线时均明显下降(P均<0.001,图3);24 h平均收缩压和舒张压较基线时也均明显下降(P均<0.001,图4)。术后12个月时,高血压治愈9例(6%),改善131例(80.5%),无效20例(13.4%)。
PRAS术后不良事件:(1)PRAS术后并发症:1例急性肾功能不全,术后48 h血肌酐较术前上升56 μmol/L,经内科保守治疗,术后4周恢复至术前水平。(2)12个月随访结束时,发生急性心肌梗死1例(0.67 %),脑卒中1例(0.67%)。2例患者出现下肢轻度水肿。

图3 149例患者经皮肾动脉支架置入术后3、6、12个月血压变化
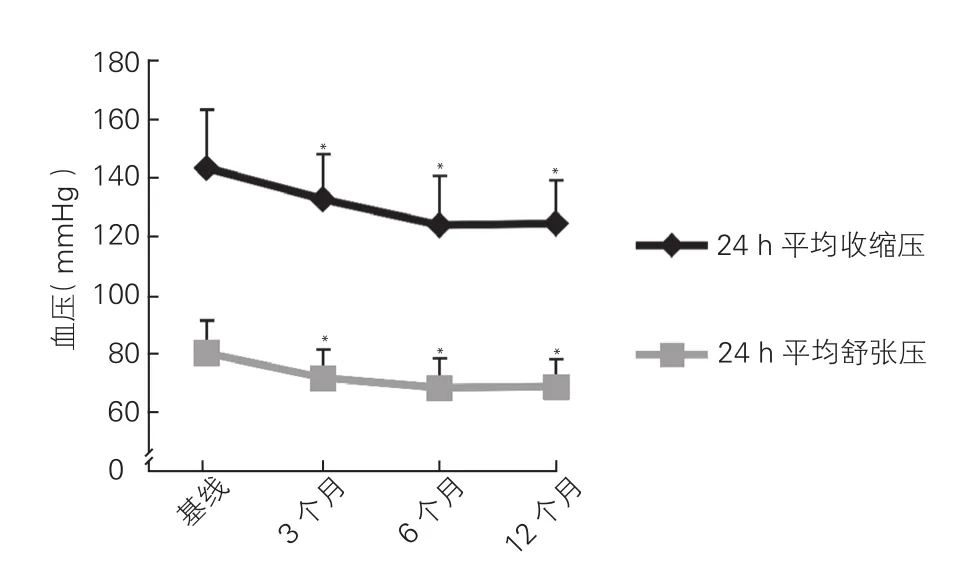
图4 149例患者经皮肾动脉支架置入术后3、6、12个月24 h平均血压变化
3 讨论
对于PRAS的临床疗效,目前仍存在较大争议。已有几项随机临床研究表明,PRAS与单纯药物保守相比不能带来额外获益[4, 5],但肾动脉介入数量大、指征严格的医学中心的临床实践表明PRAS安全有效[8, 15, 16]。我们认为,此争议的关键是病例入选标准不同,目前随机临床研究如ASTRAL研究[4]、CORAL研究[5]只强调肾动脉直径狭窄程度,但并不确定狭窄是否有导致高血压和(或)肾功能损害的功能意义,而介入指征的把握对于介入效果有至关重要的作用,无功能意义的患者可能对支架治疗无反应。本研究显示,与基线相比,伴有功能意义的ARAS患者PRAS结合规范药物治疗12个月时血压明显下降、服用降压药物种数减少,高血压治愈和改善联合发生率达到86.5%;eGFR明显升高,血肌酐下降率为24.8%,24 h尿蛋白定量显著下降。上述结果提示,在介入标准严格、介入经验丰富的医疗中心,PRAS联合规范药物治疗可为ARAS患者带来降压和肾脏保护作用。
早在2002年,美国心血管造影和介入学会就提出了肾动脉狭窄血运重建治疗的解剖指征和临床指征,以避免无效治疗[17]。2014年发布的美国肾动脉支架置入术专家共识[18]再次强调了血液动力学意义,同时提出更有可能从肾动脉支架置入中获益的患者包括:急性肺水肿或急性冠状动脉综合征;难治性高血压[使用足够剂量的3种降压药物(包括1种利尿剂)后血压仍不能控制在140/90 mmHg以下];粥样硬化性缺血性肾病,肌酐清除率<45 ml/min,或无法解释的全肾缺血(孤立肾的单侧肾动脉重度狭窄或双侧肾动脉重度狭窄)等患者。本研究入选病例均为严重肾动脉狭窄伴血液动力学改变的重度高血压或难治性高血压患者,避免了对无明显血液动力学意义或功能意义的病变介入治疗而影响PARS疗效。这一结果提示,在经过筛选的患者中,PARS具有确切疗效,这可能是我们的研究结果优于随机对照研究结果的原因。另一点值得注意的是,本研究围手术期并发症发生率为0.68%,远低于CORAL研究[5]围手术期并发症发生率(19%),提示术者经验可能对手术效果产生一定影响。
此外,药物治疗是ARAS治疗的基石,包括降压、控制血糖、调脂及抗血小板治疗,介入术后规律进行规范的药物治疗对于改善预后有重要作用。本研究中,降压治疗方案以第三代二氢吡啶类钙拮抗剂乐卡地平为基础,其扩张出、入球小动脉作用相当,避免肾小球高灌注、高囊压、高滤过现象的产生,并具有抑制血管平滑肌增殖、改善血管弹性、降低氧化应激、弱化炎症反应等作用[19]。从本研究基线资料可知,ARAS患者合并糖尿病及高脂血症的比例较高,而既往一些研究显示,在糖尿病患者中适当控制血糖可降低微血管及大血管并发症[20],强化血糖控制可进一步降低微血管并发症[21]。在肾脏疾病患者中,血脂异常与进展性肾功能下降及心血管并发症相关,调脂治疗在肾脏疾病患者中具有延缓肾功能恶化、抗炎、延缓粥样硬化进展及降低心血管事件[22-26]。本研究中患者接受规范的药物治疗,严格控制血糖和血脂,对于改善血压和提高eGFR具有积极意义。
本研究存在如下缺陷:首先,该研究为单中心队列研究,未与单纯药物治疗进行随机对照比较;其次,该研究样本量有限,随访时间仅1年,需要高质量的多中心大样本和更长时间的随访研究进一步验证。
综上所述,该研究表明,经严格筛选的ARAS患者在规范药物治疗基础上行PARS可明显改善血压控制以及提高eGFR。我们认为,对于同时具备解剖狭窄和功能意义的患者,PRAS是有价值的。
参考文献
[1] Safian RD, Textor SC.Renal-artery stenosis.N Engl J Med, 2001, 344:431-442.
[2] 蒋雄京, 高润霖.肾动脉支架术的临床地位和争论.中华心血管病杂志, 2010, 38: 3-4.
[3] Bax L, Woittiez AJ, Kouwenberg HJ, et al.Stent placement in patients with atherosclerotic renal artery stenosis and impaired renal function: a randomized trial.Ann Intern Med, 2009, 150: 840-848.
[4] The ASTRAL Investigators.Revascularization versus medical therapy for renal-artery stenosis.N Engl J Med, 2009, 361: 1953-1962.
[5] Cooper CJ, Murphy TP, Cutlip DE, et al.Stenting and medical therapy for atherosclerotic renal-artery stenosis.N Engl J Med, 2014, 370: 13-22.
[6] 李彬, 蒋雄京.粥样硬化性肾动脉狭窄的支架置入术:当前的困惑与未来.中国循环杂志, 2015, 30: 304-305.
[7] 孙红岩, 王禹, 黄党生, 等.229例肾动脉狭窄经皮血管成形术的疗效分析.中国循环杂志, 2010, 165: 360-363.
[8] Jaff MR, Bates M, Sullivan T, et al.Significant reduction in systolic blood pressure following renal artery stenting in patients with uncontrolled hypertension: results from the HERCULES trial.Catheter Cardiovasc Interv, 2012, 80: 343-350.
[9] Chrysochou C, Kalra PA.Epidemiology and natural history of atherosclerotic renovascular disease.Prog Cardiovasc Dis, 2009, 52: 184-195.
[10] Bookstein JJ, Abrams HL, Buenger RE, et al.Radiologic aspects of renovascular hypertension.JAMA, 1972, 220: 1218-1224.
[11] Levey AS, Bosch JP, Lewis JB, et al.A more accurate method to estimate glomerular filtration rate from serum creatinine: a new prediction equation.Modification of Diet in Renal Disease Study Group.Ann Intern Med, 1999, 130: 461-470.
[12] 中国高血压防治指南修订委员会.中国高血压防治指南2010.中华心血管病杂志, 2010, 39: 579-616.
[13] 中国成人血脂异常防治指南制订联合委员会.中国成人血脂异常防治指南.中华心血管病杂志, 2007, 35: 390-419.
[14] 中华医学会糖尿病学分会.中国2型糖尿病防治指南(2007年版).中华医学杂志, 2007, 88: 1227-1245.
[15] Dorros G, Jaff M, Mathiak L, et al.Four-year follow-up of Palmaz-Schatz stent revascularization as treatment for atherosclerotic renal artery stenosis.Circulation, 1998, 98: 642-647.
[16] Rzeznik D, Przewlocki T, Kablak-Ziembicka A, et al.Effect of renal artery revascularization on left ventricular hypertrophy, diastolic function, blood pressure, and the one-year outcome.J Vasc Surg, 2011, 53: 692-697.
[17] Rundback JH, Sacks D, Kent KC, et al.Guidelines for the reporting of renal artery revascularization in clinical trials.J Vasc Interv Radiol, 2002, 13: 959-974.
[18] Parikh SA, Shishehbor MH, Gray BH, et al.SCAI expert consensus statement for renal artery stenting appropriate use.Catheter Cardiovasc Interv, 2014, 84: 1163-1171.
[19] Wu JR, Liou SF, Lin SW, et al.Lercanidipine inhibits vascular smooth muscle cell proliferation and neointimal formation via reducing intracellular reactive oxygen species and inactivating Ras-ERK1/2 signaling.Pharmacol Res, 2009, 59: 48-56.
[20] American Diabetes Association.Standards of medical care in diabetes--2012.Diabetes Care, 2012, 35: S11.
[21] Gerstein HC, Miller ME, Byington RP, et al.Effects of intensive glucose lowering in type 2 diabetes.N Engl J Med, 2008, 358: 2545-2559.
[22] Yukawa S, Mune M, Yamada Y, et al.Ongoing clinical trials of lipid reduction therapy in patients with renal disease.Kidney Int, 1999, 71: S141-143.
[23] Narita T, Kakei M, Ito S, et al.Aggressive antihypertensive treatment and serum lipid lowering therapy are necessary to prevent deterioration of the renal function even in elderly type 2 diabetic patients with persistent albuminuria.Gerontology, 2002, 48: 302-308.
[24] Tsimihodimos V, Dounousi E, Siamopoulos KC, et al.Dyslipidemia in chronic kidney disease: an approach to pathogenesis and treatment.Am J Nephrol, 2008, 28: 958-973.
[25] Sawara Y, Takei T, Uchida K, et al.Effects of lipid-lowering therapy with rosuvastatin on atherosclerotic burden in patients with chronic kidney disease.Intern Med, 2008, 47: 1505-1510.
[26] Ozsoy RC, van Leuven SI, Kastelein JJ, et al.The dyslipidemia of chronic renal disease: effects of statin therapy.Curr Opin Lipidol, 2006, 17: 659-666.
(编辑:朱柳媛)
收稿日期:(2015-07-06)
中图分类号:R54
文献标识码:A
文章编号:1000-3614(2016)02-0122-05
doi:10.3969/j.issn.1000-3614.2016.02.006
作者简介:李彬 硕士研究生 主要研究方向为高血压诊治 Email: libin8666345@163.com*为共同第一作者 通讯作者:蒋雄京 Email:jxj103hotmail.com
目的:评估肾动脉支架置入术联合规范药物治疗对伴有功能意义的粥样硬化性肾动脉狭窄患者的临床疗效。
方法:本研究为前瞻性队列研究,研究对象为2011-09至2013-03于我院行肾动脉支架置入术的患者。所有患者均符合动脉粥样硬化性肾动脉狭窄的诊断并伴有导致高血压和(或)肾功能损害的功能意义,接受规范的抗血小板、降压、调脂、降糖等药物治疗,使血压、血脂和血糖达标。随访至少12个月,观察肾动脉支架置入术对患者血压和肾功能的影响。
结果:入组149例粥样硬化性肾动脉狭窄患者,平均年龄(61.54±9.63)岁。共185条肾动脉行经皮肾动脉支架置入术,平均狭窄率为(83.11±7.30)%,手术成功率为99.32%(148/149)。12个月随诊时,患者估算肾小球滤过率较基线明显升高(P<0.05),从(76.49±22.50)ml/(min·1.73 m2)升至(84.09±28.79)ml/(min·1.73 m2);24 h尿蛋白较基线明显下降(P<0.001),从[0.1(四分位间距0.02,0.5)g]降至[0.04(四分位间距0.01,0.11)g];服用降压药种类较基线时明显减少,从2.22种减至1.56种(P<0.05);诊室血压及24 h动态血压较基线时明显下降(P均<0.05),诊室收缩压/舒张压由(153.4±15.6)/(83.77±12.60)mmHg(1 mmHg=0.133 kPa)降至(134.6±14.4)/(73.57±9.12)mmHg,24 h平均收缩压/舒张压由(143.32±19.87)/(80.51±11.33)mmHg降至(124.44±14.90)/(69.09±9.49)mmHg。
结论:该研究显示,在严格筛选的粥样硬化性肾动狭窄患者中,肾动脉支架置入术联合规范药物治疗可改善血压和肾功能。

