内皮素-1在心房颤动发生中的机制探讨
洪钰杰,钟国强,蒋智渊,方曙,孙培震
内皮素-1在心房颤动发生中的机制探讨
洪钰杰,钟国强,蒋智渊,方曙,孙培震
摘要
关键词心房颤动;内皮素-1;心房纤维化
作者单位:530021 广西省南宁市,广西医科大学第一附属医院 心血管内科
Effect of Endothelin-1 on Atrial Fibrosis in Patients With Atrial Fibrillation
HONG Yu-jie, ZHONG Guo-qiang, JIANG Zhi-yuan, FANG Shu, SUN Pei-zhen.
Department of Cardiology, First Affiliated Hospital of Guangxi Medical University, Nanning (530021), Guangxi, China
Corresponding Author: ZHONG Guo-qiang, Email: gq_zhong@126.com
Abstract
Objective: To explore the effect of endothelin-1 on atrial fibrosis in patients with atrial fibrillation (AF).
Methods: A total of 72 patients with thoracotomy were studied, the patients were divided into 2 groups: AF group, n=39 and Sinus rhythm (SR) group, n=33.The mRNA and protein expressions of endothelin-1 (ET-1), platelet derived growth factor-B (PDGF-B) and collagen I (COL1) in right atrial appendage (RAA) tissue were measured by RT-PCR and Western blot analysis; meanwhile, the impact of ET-1 stimulation and non-selective ET-1 receptor antagonist (sulfafurazole SIZ) on PDGF-B mRNA and protein expressions in H9c2 cells were measured.
Results: ①The RAA tissue mRNA and protein expressions in AF group were higher than those in SR group, as for ET-1 (2.830 ± 2.276) vs (1.220 ± 0.887) and (0.835 ± 0.241) vs (0.286 ± 0.083), both P<0.01; for PDGF-B (2.568 ± 2.348) vs (1.567 ± 0.831) and (0.807±0.241) vs (0.381 ± 0.105), both P<0.05; for COL1 α1 (3.376 ± 1.598) vs (1.629 ± 0.833) and (0.652 ± 0.210) vs (0.312 ± 0.12), both P<0.05.②The protein expressions of ET-1 and COL1 had positive correlation (r=0.580, P<0.01).③ET-1 promoted PDGF-B secretion in H9c2 cells in a concentration and time-dependent manner; SIZ could reduce such promotion.
Conclusion: ET-1 plays an important role in AF occurrence which might be related to PDGF-B regulation.
Key words Atrial fibrillation; Endothelin-1; Atrial fibrosis
(Chinese Circulation Journal, 2016,31:146.)
心房颤动(房颤)是临床上最常见的心律失常,致残、致死率高。房颤发病机制复杂,心房重构是其中心环节。心房纤维化作为心房结构重构最显著的特征,与房颤的发生密切相关[1]。大量研究发现,房颤患者心房组织和外周血内皮素-1(ET-1)表达升高[2-5],但ET-1在房颤发病中的具体作用,目前尚不清楚。已有的研究表明,ET-1与心肌纤维化密切相关[6],并且ET-1对血小板衍生生长因子(PDGF)具有调控作用[7]。PDGF-B是重要的致心房纤维化因子[8],ET-1是否通过调控PDGF-B促进心房纤维化而参与房颤的发生?目前尚少见报道。本研究旨在初步探讨ET-1在房颤发生中的作用和可能的作用机制。
1 资料与方法
对象:选择2012-10至2014-06我院心脏外科住院的72例心脏外科手术患者为研究对象,分为房颤组(39例)和窦性心律(窦律)组(33例)。其中,心脏瓣膜病患者61例,房间隔缺损患者6例,冠状动脉粥样硬化性心脏病患者5例。排除标准:(1)合并感染性心内膜炎;(2)合并风湿活动征象;(3)高血压;(4)内分泌紊乱、甲状腺功能亢进;(5)自身免疫性疾病;(6)严重肝肾功能不全、恶性肿瘤;(7)年龄<18岁;(8)心脏二次手术者。本研究所有入选患者签署书面知情同意书,并获得广西医科大学第一附属医院伦理委员会批准。
两组患者性别、年龄、基础心脏疾病(除外联合瓣膜病变)、纽约心脏协会(NYHA)心功能等差异无统计学意义,但房颤组患者左心房内径明显大于窦律组(P<0.01),差异有统计学意义。(表1)
右心耳标本获取:于建立体外循环插腔静脉管前,切开右心耳时切取约150 mg右心耳组织,部分放入液氮中冻存,部分用4%多聚甲醛固定。
细胞培养:H9c2细胞系(中国科学院典型培养物保藏委员会细胞库)在含有10% 胎牛血清(Gibco),2 mM 谷氨酰胺,100 U/ ml 青霉素和100 μg/ ml链霉素的HG-DMEM 培养基中,37℃,5% CO2环境中培养,倒置相差显微镜观察细胞贴壁和生长情况,待细胞约80%~90%融合时,用0.25%胰蛋白酶消化贴壁的细胞传代,按1:2分瓶接种,每隔48~72 h更换培养基1次。
ET-1干预H9c2细胞:ET-1(PROSPEC)干预前H9c2细胞以无血清培养基同步化24 h。H9c2细胞在含ET-1(0 nmol/L、1 nmol/L、10 nmol/L、100 nmol/L)培养基中分别培养24 h;此后,H9c2细胞在含ET-1 10 nmol/L培养基中,分别培养0 h、24 h、48 h 、72 h;最后,H9c2细胞在含ET-1 10 nmol/L+ SIZ[9](Sigma,美国)2 mmol/L培养基中培养24 h。
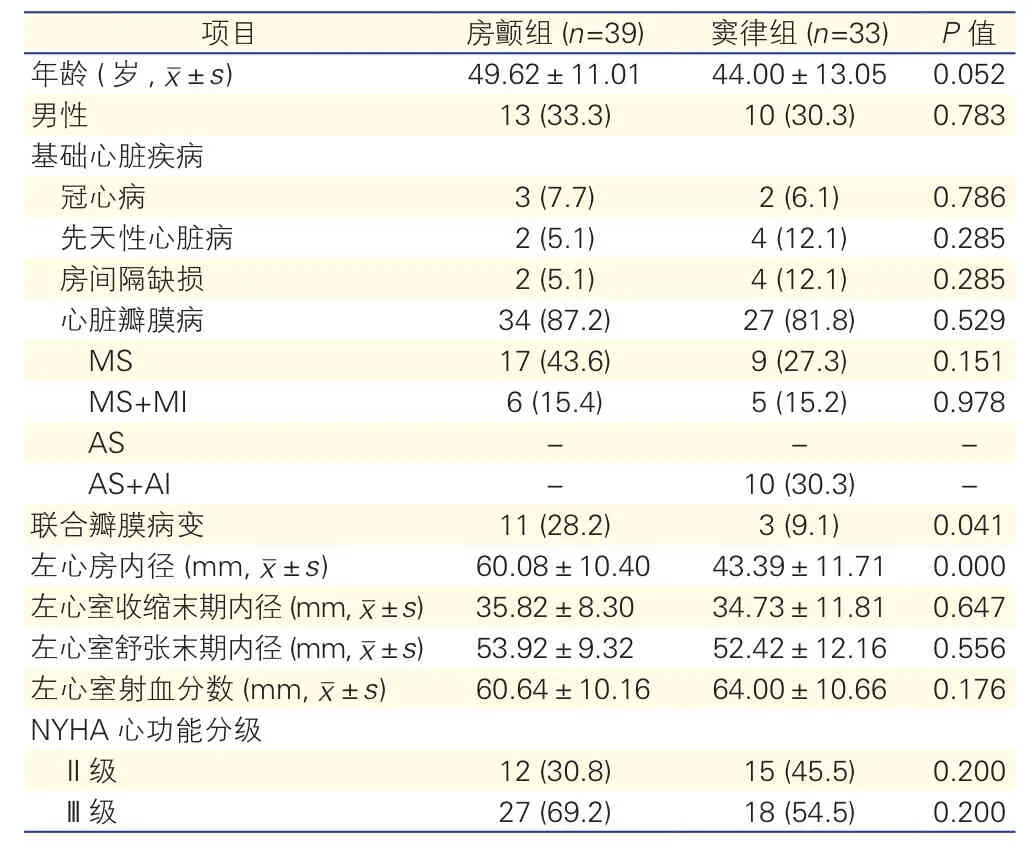
表1 两组患者一般临床资料的比较[例(%)]
右心耳组织马松(Masson)染色:右心耳组织固定后石蜡包埋,制成5 μm石蜡切片,脱蜡、梯度酒精脱水处理,苏木素—伊红染色10 min,Masson复合染液染色5 min,0.2%磷酸钨酸处理切片5~10 min,0.2%醋酸水溶液浸洗2次。亮绿染色5 min,常规无水乙醇脱水、透明及封固,光学显微镜下观察并随机选取5个视野进行拍照。
实时荧光定量聚合酶链反应(PCR):(1)组织及细胞总RNA提取: Trizol(Invitrogen)提取组织和细胞总RNA,NanoDrop2000型微量分光光度计测定RNA的OD280/OD260值(1.8~2.0);(2)cDNA合成:按照PrimeScriptTMRT reagent Kit with gDNA Eraser (TAKARA)试剂盒说明书操作,进行总RNA逆转录反应;(3)引物设计与合成:人ET-1、PDGF-B、I型胶原α1亚基(COL1α1)和内参照磷酸甘油醛脱氢酶(GAPDH)引物,大鼠PDGF-B和内参照GAPDH引物由日本TAKARA公司设计合成(表2);(4)荧光定量PCR: 按SYBR®Premix Ex TaqTM(Tli RNaseH Plus)试剂盒(TAKARA)说明书操作,使用ABI 7300荧光定量PCR仪检测人ET-1、PDGF-B、COL1α1,大鼠PDGF-B mRNA相对表达量,结果以2-△△CT表示。
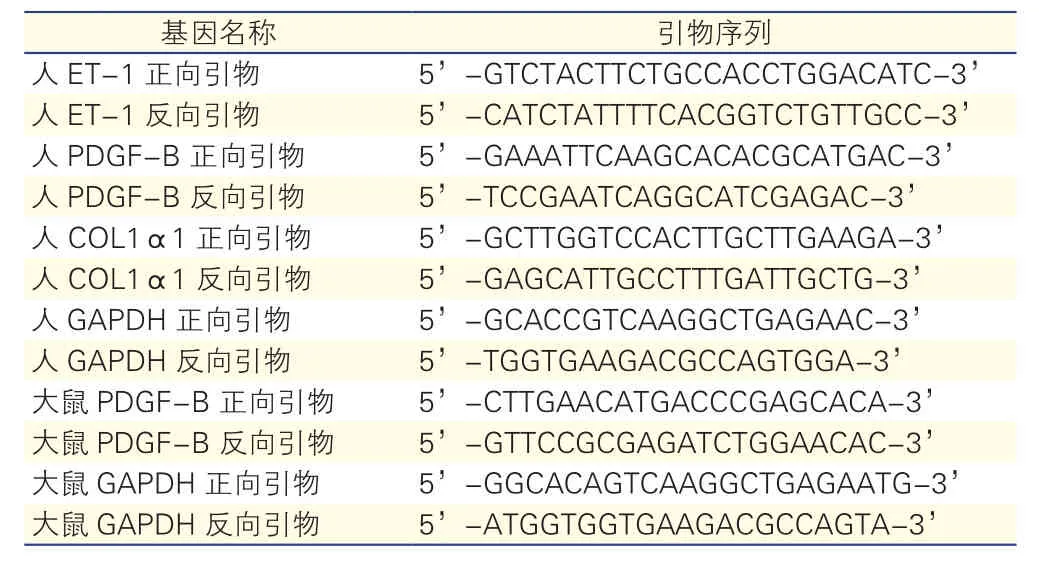
表2 基因引物序列
蛋白免疫印迹(Western blot)检测:提取右心耳组织和细胞总蛋白,各蛋白样孔蛋白上样总量30 μg;十二烷基硫酸钠聚丙烯酰胺凝胶电泳(SDS-PAGE);湿法转膜;孵育一抗(4℃过夜):抗ET-1鼠单克隆抗体 (Abcam) 1:500、抗PDGF-B兔单克隆抗体(Abcam) 1:1 000、抗COL1鼠单克隆抗体(Abcam) 1:500、抗GAPDH鼠单克隆抗体(Sigma)1:10 000;孵育二抗(常温1~2 h):荧光标记羊抗鼠IgG抗体(Licor) 1:10 000、荧光标记羊抗兔IgG抗体(Rockland)1:10 000;Odyssey荧光成像系统扫膜,以GAPDH为内参照,检测人ET-1、PDGF-B、COL1及大鼠PDGF-B蛋白相对表达,结果以目的蛋白条带与相应内参蛋白条带的灰度值比值表示。
统计学分析:采用SPSS 22.0软件进行数据处理,计量资料以均数±标准差(±s)表示,计数资料以率或百分比表示;两组间计量资料比较采用两独立样本的t检验,计数资料比较采用χ2检验;多组间总体均数的比较采用单因素方差分析,多组间均数两两比较,采用q检验;单因素相关分析采用Pearson相关分析。以P<0.05为差异有统计学意义。
2 结果
2.1两组患者右心耳ET-1表达
房颤组患者右心耳ET-1 mRNA表达水平(2.830±2.276)明显高于窦律组(1.220 ±0.887)(t=4.068,P<0.01);蛋白表达水平(0.835±0.241)亦明显高于窦律组(0.286±0.083)(t=-13.309, P<0.01),差异均有统计学意义。(图1A)
2.2两组患者右心耳PDGF-B表达
房颤组患者右心耳PDGF-B mRNA表达水平(2.568±2.348)明显高于窦律组(1.567 ±0.831)(t=2.482,P<0.05);蛋白表达水平(0.807±0.241)亦明显高于窦律组(0.381±0.105)(t=-10.860,P<0.01),差异均有统计学意义。(图1B)
2.3两组患者右心耳COL1表达
房颤组患者右心耳COL1α1 mRNA表达水平(3.376±1.598)明显高于窦律组(1.629±0.833)(t=5.941,P<0.05);COL1蛋白表达水平(0.652±0.210)亦明显高于窦律组(0.312±0.122) (t=-8.565,P<0.05),差异均有统计学意义。(图1C)
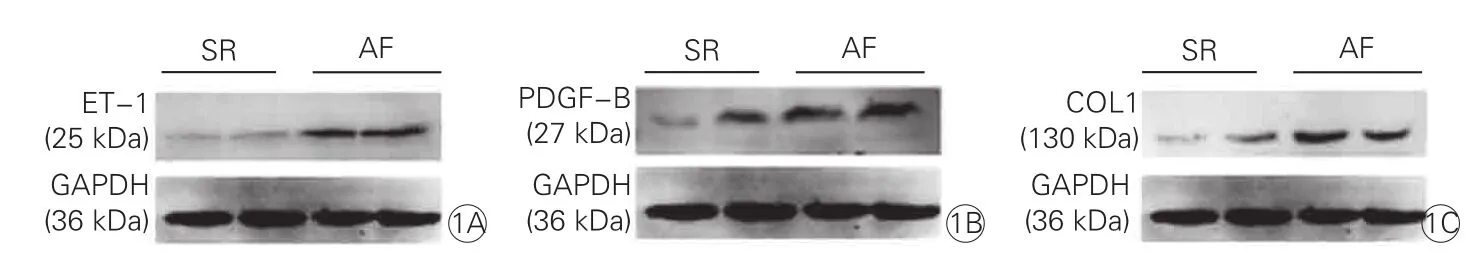
注:AF:房颤组;SR:窦律组;ET-1:内皮素-1;PDGF-B:血小板衍生生长因子-B;COL1:I型胶原;GAPDH: 磷酸甘油醛脱氢酶
2.4ET-1与COL1相关性分析
单因素相关分析显示两组患者右心耳COL1蛋白表达水平与ET-1蛋白表达水平呈明显的正相关(r=0.580,P<0.01),差异有统计学意义。
2.5两组患者右心耳胶原纤维沉积
Masson染色提示房颤组患者右心耳胶原纤维沉积明显多于窦律组患者,呈粗大的束状包裹、分隔心肌纤维。(图2)
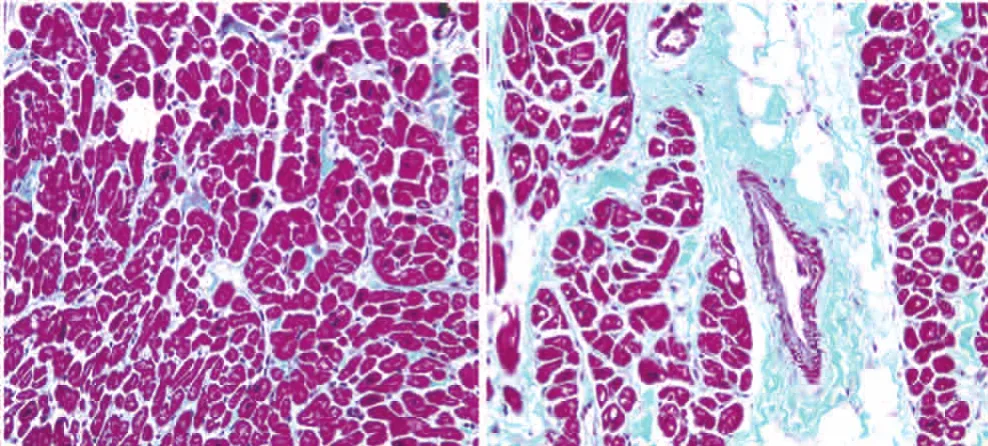
图2 两组患者右心耳胶原纤维沉积
2.6ET-1对H9c2细胞PDGF-B分泌的影响
(1)不同浓度ET-1对H9c2细胞PDGF-B mRNA表达的影响:与0 nmol/L(1.043±0.102)比较,1 nmol/L ET-1(1.314±0.131,q=6.335,P<0.01)、10 nmol/L ET-1(1.671±0.131,q=14.687,P<0.01)、100 nmol/L ET-1(1.973±0.145,q=21.737,P<0.01)、H9c2细胞PDGF-B mRNA表达水平明显升高,且1 nmol/L、10 nmol/L (q=8.352,P<0.01)、100 nmol/L (q=7.050,P<0.01) PDGF-B mRNA表达水平进行性升高,差异有统计学意义。
(2)不同浓度ET-1对H9c2细胞PDGF-B蛋白表达的影响:与0 nmol/L(0.070±0.028)比较,1 nmol/L ET-1(0.163±0.025,q=7.111,P<0.01)、10 nmol/L ET-1(0.355±0.043,q=21.792,P<0.01)、100 nmol/L ET-1(0.623±0.053,q=42.267,P<0.01)H9c2细胞PDGF-B蛋白表达水平明显升高,且1 nmol/L、10 nmol/L (q=14.681,P<0.01)、100 nmol/ L(q=20.475,P<0.01)PDGF-B蛋白表达水平进行性升高,差异有统计学意义。(图3)
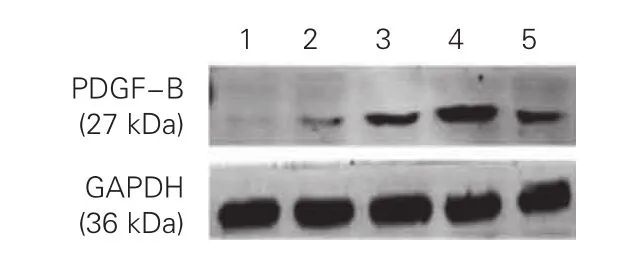
图3 不同浓度ET-1对H9c2细胞PDGF-B蛋白表达的影响
(3)ET-1培养不同时间对H9c2细胞PDGF-B mRNA表达的影响:与0 h(0.966±0.131)比较,24 h(1.671±0.131,q=13.151,P<0.01)、48 h(1.999±0.178,q=19.277,P<0.01)、72 h (2.278±0.194,q=24.462,P<0.01)H9c2细胞PDGF-B mRNA表达水平明显升高,且24 h、48 h (q=6.126,P<0.01)、72 h(q=5.185,P<0.01)PDGF-B mRNA表达水平进行性升高,差异有统计学意义。
(4)ET-1培养不同时间对H9c2细胞PDGF-B蛋白表达的影响:与0 h(0.069±0.019)比较,24 h(0.355±0.043,q=23.428,P<0.01)、48 h (0 .6 2 8±0 .0 3 8,q = 4 5 .7 6 9,P< 0 .0 1)、72 h(0.750±0.041,q=55.721,P<0.01) H9c2细胞PDGF-B蛋白表达水平明显升高,且24 h、48 h(q=22.341,P<0.01)、72 h(q=9.952,P<0.01)PDGF-B蛋白表达水平进行性升高,差异有统计学意义。(图4)
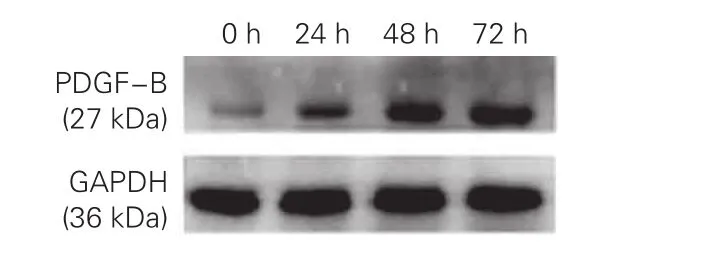
图4 ET-1培养不同时间对H9c2细胞PDGF-B蛋白表达的影响
(5)内皮素拮抗剂对ET-1培养下H9c2细胞PDGF-B表达的影响:与10 nmol/L ET-1比较,ET-1 10 nmol/L+ SIZ 2 mmol/L的H9c2细胞PDGF-B mRNA表达水平(1.426±0.130)明显下降(t=3.633,P<0.01);PDGF-B蛋白水平(0.246±0.022)也明显下降(t=6.510,P<0.01),差异均有统计学意义。(图3)
3 讨论
内皮素是一种由21个氨基酸残基组成的活性多肽,主要由内皮细胞分泌,心肌细胞和成纤维细胞等也有一定表达。ET-1是人体最主要的内皮素,它促进成纤维细胞向肌样成纤维细胞分化,增加细胞外基质合成,是导致心肌纤维化的重要因素[6,10-12]。
近来,ET-1在房颤发病中的作用越来越受重视。Zakeri 等[3]研究表明,与单纯的心力衰竭患者相比,合并房颤者血浆ET-1表达更高。Abed等[13]研究发现,随着山羊体重的增加,其心房ET-1及内皮素受体ETA和ETB表达增加,房颤发生的风险明显升高。Mayyas等[14]发现通过饮食补充ω3不饱和脂肪酸可以减少实验犬心脏术后房颤的发生,并且降低血浆ET-1表达。Nakazawa等[15]发现术前血浆ET-1表达水平是预测环肺静脉消融术后3~6个月复发率的重要指标。Latini等[16]也发现,房颤时血浆ET-1前体肽增加,是预测房颤复发的良好指标。上述研究的共同特点在于,房颤时血浆或是心房ET-1表达明显升高,可见ET-1过度表达在房颤发病中起着重要作用。遗憾的是,上述研究均未对ET-1在房颤发病中的具体作用进行深入的研究。
我们的研究发现,房颤组患者右心耳ET-1、COL1表达以及胶原纤维沉积均明显高于窦律组,且两组患者右心耳COL1表达水平与ET-1表达水平呈明显的正相关,提示ET-1可能通过促进心房纤维化而参与房颤的发生。Mayyas等[4]研究结果与我们的研究相似,他们发现器质性心脏病患者左心耳ET-1表达水平与左心房大小、心房纤维化程度以及房颤的发生有明显的相关性。
我们的研究还发现,ET-1可以促进H9c2细胞PDGF-B mRNA和蛋白的合成,并且表现出浓度依赖性和时间依赖性。SIZ可以减弱ET-1对H9c2细胞PDGF-B合成的促进作用。上述结果表明ET-1可在基因转录水平对PDGF-B信号通路进行调控。
PDGF是多种间充质来源细胞(如成纤维细胞、血管平滑肌细胞等)的主要丝裂原,促进间充质细胞生长、迁移、增殖、分化及细胞外基质的合成,在组织损伤后修复中起着重要作用。但病理状态下,过度激活的PDGF可使成纤维细胞转化为肌样成纤维细胞,分泌多种细胞外基质,导致心房纤维化,促进房颤的发生[8]。PDGF主要以旁分泌的形式作用于其效应细胞,其受体(PDGFR)在成纤维细胞高度表达[17],因此心房成纤维细胞是PDGF最主要的效应细胞之一。据此我们推测,ET-1可能通过刺激心房肌细胞合成PDGF-B,并以旁分泌的形式作用于心房成纤维细胞,促进其分泌细胞外基质,导致心房纤维化和房颤的发生。
我们的研究表明,ET-1可能通过上调PDGF-B促进心房纤维化而参与房颤的发生,有望为房颤的干预提供新的靶点。但目前只是体外实验的结果,有待于体内实验进一步验证。另一方面,由于病例数有限,研究中大部分为心脏瓣膜病患者,仅有少部分为非心脏瓣膜病患者,ET-1在非瓣膜病性房颤中的作用是否如此,仍有待考证。进一步收集病例,探讨ET-1在不同基础心脏疾病房颤发生中的作用,将更加有利于问题的阐明。此外,ET-1促进心肌细胞PDGF-B分泌的具体机制仍有待进一步探索,我们将在今后的研究中逐步完善。
参考文献
[1] Nattel S, Harada M.Atrial remodeling and atrial fibrillation: recent advances and translational perspectives.J Am Coll Cardiol, 2014, 63: 2335-2345.
[2] Lewicka E, Dudzinska-Gehrmann J, Dabrowska-Kugacka A, et al.Neurohumoral factors as markers of recurrence of atrial fibrillation examined in patients with dual-chamber pacemaker.Int J Cardiol, 2014, 175: 213-214.
[3] Zakeri R, Borlaug BA, McNulty SE, et al.Impact of atrial fibrillation on exercise capacity in heart failure with preserved ejection fraction: a RELAX trial ancillary study.Circ Heart Fail, 2014, 7: 123-130.
[4] Mayyas F, Niebauer M, Zurick A, et al.Association of left atrial endothelin-1 with atrial rhythm, size, and fibrosis in patients with structural heart disease.Circ Arrhythm Electrophysiol, 2010, 3: 369-379.
[5] 郑黎晖, 姚焰, 吴灵敏, 等.孤立性心房颤动患者血浆高敏C反应蛋白与大内皮素-1浓度变化及相互的关系.中国循环杂志, 2015, 30: 240-243.
[6] Leask A.Potential therapeutic targets for cardiac fibrosis: TGFbeta, angiotensin, endothelin, CCN2, and PDGF, partners in fibroblast activation.Circ Res, 2010, 106: 1675-1680.
[7] Jaffer FE, Knauss TC, Poptic E, et al.Endothelin stimulates PDGF secretion in cultured human mesangial cells.Kidney Int, 1990, 38: 1193-1198.
[8] Wakili R, Voigt N, Kaab S, et al.Recent advances in the molecular pathophysiology of atrial fibrillation.J Clin Invest, 2011, 121: 2955-2968.
[9] Syed H, Safa R, Chidlow G, et al.Sulfisoxazole, an endothelin receptor antagonist, protects retinal neurones from insults of ischemia/ reperfusion or lipopolysaccharide.Neurochem Int, 2006, 48: 708-717.
[10] Wang X, Guo Z, Ding Z, et al.Endothelin-1 upregulation mediates aging-related cardiac fibrosis.J Mol Cell Cardiol, 2015, 80: 101-109.
[11] Catar RA, Muller G, Brandt A, et al.Increased gene expression of the cardiac endothelin system in obese mice.Horm Metab Res, 2015, 47: 509-515.
[12] Widyantoro B, Emoto N, Nakayama K, et al.Endothelial cellderived endothelin-1 promotes cardiac fibrosis in diabetic hearts throughstimulation of endothelial-to-mesenchymal transition.Circulation, 2010, 121: 2407-2418.
[13] Abed HS, Samuel CS, Lau DH, et al.Obesity results in progressive atrial structural and electrical remodeling: implications for atrial fibrillation.Heart Rhythm, 2013, 10: 90-100.
[14] Mayyas F, Sakurai S, Ram R, et al.Dietary omega3 fatty acids modulate the substrate for post-operative atrial fibrillation in a canine cardiac surgery model.Cardiovasc Res, 2011, 89: 852-861.
[15] Nakazawa Y, Ashihara T, Tsutamoto T, et al.Endothelin-1 as a predictor of atrial fibrillation recurrence after pulmonary vein isolation.Heart Rhythm, 2009, 6: 725-730.
[16] Latini R, Masson S, Pirelli S, et al.Circulating cardiovascular biomarkers in recurrent atrial fibrillation: data from the GISSI-atrial fibrillation trial.J Intern Med, 2011, 269: 160-171.
[17] Donovan J, Abraham D, Norman J.Platelet-derived growth factor signaling in mesenchymal cells.Front Biosci (Landmark Ed),2013,18: 106-119.
(编辑:漆利萍)
收稿日期:(2015-05-20)
中图分类号:R54
文献标识码:A
文章编号:1000-3614(2016)02-0146-05
doi:10.3969/j.issn.1000-3614.2016.02.011
作者简介:洪钰杰 硕士研究生 主要从事心律失常的基础与临床研究 Email:15077177145@163.com 通讯作者:钟国强Email:gq_zhong@126.com
基金项目:广西自然科学基金项目(2013GXNSFAA019167) ;国家自然科学基金课题地区科学基金项目(81460057)
目的:探讨内皮素-1(ET-1)在心房颤动(房颤)和心房纤维化中的作用。
方法:72例开胸手术患者,分为房颤组(39例)和窦性心律(窦律)组(33例)。实时荧光定量聚合酶链反应(PCR)及蛋白免疫印迹(Western blot)分别检测两组患者右心耳ET-1、血小板衍生生长因子-B(PDGF-B)、I型胶原(COL1)mRNA和蛋白表达水平。同时,检测ET-1刺激以及非选择性ET-1受体拮抗剂(磺胺异恶唑,Sulfafurazole,SIZ)对H9c2细胞PDGF-B mRNA和蛋白表达水平的影响。
结果:(1)房颤组患者右心耳ET-1 mRNA表达水平和蛋白表达水平明显高于窦律组(2.830±2.276 vs 1.220 ±0.887)和(0.835±0.241 vs 0.286±0.083),P均<0.01。房颤组患者右心耳PDGF-B mRNA表达水平和蛋白表达水平明显高于窦律组(2.568±2.348 vs 1.567±0.831)和(0.807±0.241 vs 0.381±0.105),P均<0.05。房颤组患者右心耳I型胶原α1亚基(COL1α1) mRNA表达水平(3.376±1.598) 明显高于窦律组(1.629±0.833),P<0.05;蛋白表达水平(0.652±0.210)亦明显高于窦律组(0.312±0.122),P<0.05。(2)两组患者右心耳I型胶原蛋白表达水平与ET-1蛋白表达水平呈明显的正相关(r=0.580,P<0.01)。(3)ET-1促进H9c2细胞分泌PDGF-B,并表现出浓度和时间依赖性。SIZ可减轻上述效应。
结论: ET-1在房颤的发生中起着重要作用,其可能通过调控PDGF-B促进心房纤维化而导致房颤的发生。

