瘦素受体基因Gln223Arg多态性与代谢综合征的相关性及其对心脏结构功能的影响
陈海翎,王倩,李菊芬,邓丽丽
瘦素受体基因Gln223Arg多态性与代谢综合征的相关性及其对心脏结构功能的影响
陈海翎,王倩,李菊芬,邓丽丽
摘要
关键词受体,瘦素;多态性,单核苷酸;肥大,左心室;代谢综合征
作者单位:100035 北京市,北京积水潭医院 内分泌科
Relationship Between Leptin Receptor Gene Gln223Arg Polymorphism and Metabolism Syndrome With its Impact on Left Ventricular Hypertrophy
CHEN Hai-ling, WANG Qian, LI Ju-fen, DENG Li-li.
Department of Endocrinology, Beijing Jishuitan Hospital, Beijing (100035), China
Corresponding Author: CHEN Hai-ling, Email: hailing_chen@263.net
Abstract
Objective: To explore the relationship between 1eptin receptor gene Gln223Arg polymorphism and metabolism syndrome (MS) with its impact on cardiac structure and function.
Methods: Our research included 2 groups: MS group, n=167 patients with first diagnosed MS without treatment in our hospital from 2005-10 to 2008-6 and Control group, n=216 healthy subjects from regular physical examination.Blood pressure, biochemical features, insulin levels and echocardiography were detected; leptin receptor Gln223Arg genotypes were measured by PCR-RFLP; the above indexes were compared between 2 groups.
Results: The patients in MS group had the higher frequency of A allele than Control group.The MS occurrence rate in allele A carrier was 3.302 times higher than allele G carrier (P=0.000; 95% CI 2.432-4.483).The patients in MS group already had left ventricular hypertrophy and impaired diastolic function.Compared with MS G allele carriers, the A allele carriers had the higher BMI, blood pressure, glucose, fasting glucose and insulin levels, longer waist circumference, more serious dyslipidemia and insulin resistance, left ventricular hypertrophy and impaired diastolic function.
Conclusion: Leptin receptor gene Gln223Arg polymorphism is associated with the increased risk of MS occurrence and left ventricular hypertrophy.
Key words Receptors, leptin; Polymorphism, mononucleotide; Hypertrophy, Left ventricle; Metabolism syndrome
(Chinese Circulation Journal, 2016,31:127.)
由肥胖基因编码的蛋白激素瘦素与瘦素受体(LEPR)结合后可抑制食欲、减少热量摄取、提高机体代谢率及减少脂肪堆积。LEPR基因与肥胖、高血糖、高血压、高血脂等代谢综合征组分密切相关。这些组分作为危险因素最终共同引起心血管并发症。目前关于LEPR基因Gln223Arg多态性与代谢综合征的关系及其对心脏结构功能影响的研究较少,本研究针对此问题进行探讨。
1 资料与方法
临床资料:2005-10至2008-06在我院门诊初诊未治疗的167例代谢综合征患者(代谢综合征组):男92例,女75例。均符合2005年国际糖尿病联盟(IDF)代谢综合征诊断标准:中心性肥胖采用中国特异性腰围(WC)切点(男≥90 cm,女≥80 cm),且符合以下任意两条:(1)血压升高趋势,收缩压(SBP)在130 mmHg(1 mm Hg=0.133 kPa)以上、舒张压(DBP)85 mm Hg以上;(2)高密度脂蛋白胆固醇(HDL-C)降低趋势,男<1.0 mmol/L,女<1.30 mmol/L; (3)甘油三酯(TG)在1.70 mmol/L以上;(4)空腹血糖(FPG)在5.6 mmol/L以上。并排除继发性高血压、心肌病、瓣膜病、先天性心脏病。选同期门诊216例无明确疾病史和家族史的健康体检者为对照组:男121例,女95例。
方法:(1)提取人类基因组DNA,设计引物(上游:5’- ACCCTTTAAGCTGGGTGTCCCAAATAG- 3’;下游:5’- AGCTAGCAAATATTTTTGTAAGCAATT -3’)扩增含该位点的序列。(2)以全自动多聚酶链式反应(PCR)扩增仪,加热模板DNA至94℃5 min后降温至58℃,在TaqDNA聚合酶作用下,共36个循环,72℃延展10 min。(3)扩增产物8.2μl, 限制性核酸内切酶Msp I 8 u,10×Buffer 1 μl,双蒸水补至20 μl,37℃水浴4 h酶切。(4)120V电压电泳45 min,紫外灯照相经凝胶成像系统分析电泳图并对各基因型抽样测序(国家人类基因组北方研究中心)。(5)测量SBP、DBP、身高(H)、体重(W)、腰围并计算体重指数(BMI),日立7170型全自动生化仪检测生化指标。北京北方生物制剂所提供试剂,放射免疫法测空腹血清胰岛素(Ins)。稳态模型计算胰岛素抵抗指数(HOMA-IR),即HOMA-IR=空腹胰岛素(mU/L)×FPG(mmol/ L)/ 22.5。按HOMA-IR 50百分位点区分胰岛素相对敏感和抵抗。(6)HP2500型超声心动图仪检测心脏结构功能。左侧卧姿,探头垂直胸壁,以胸骨左缘3~4肋间取左心室长轴切面测主动脉搏幅(AOE)、左心房内径(LAD)及主动脉根部内径(AOD)。取3个心动周期均值。计算左心室重量指数(LVMI)、左心室重量(LVM)和左心室向心性重构指数(CR)。在二尖瓣环远端和瓣口近端瓣叶之间采样二尖瓣血流脉冲多普勒频谱,测量流速积分(ETVI)、舒张早期血流(E波)峰值流速(EPFV)和充盈时间(EDFP);测量心房收缩期血流(A波)峰值流速(APFV)、心房收缩间期(AFP)、舒张充盈期(DFP)、流速积分(ATVI)计算分析患者心脏功能。
统计学分析:应用SPSS19.0软件,计数资料以频数表示,计量资料以±s表示。Hardy-Weinberg平衡、优势比(OR)、基因频率及基因型间率的比较采用χ2检验;不同基因型间计量资料均数比较采用方差分析。以P<0.05为差异有统计学意义。
2 结果
LEPR基因Gln223Arg多态性基因型分析:PCR扩增产物为421bp,3种基因型经酶切后产生3种产物(图1)。AA纯合子(Gln/Gln,Gln223): 421bp ; GG纯合子(Arg/Arg, Arg223): 294+127bp; AG杂合子(Gln/Arg ,Gln223/ Arg223): 421+294+127bp。电泳测序结果见图2。
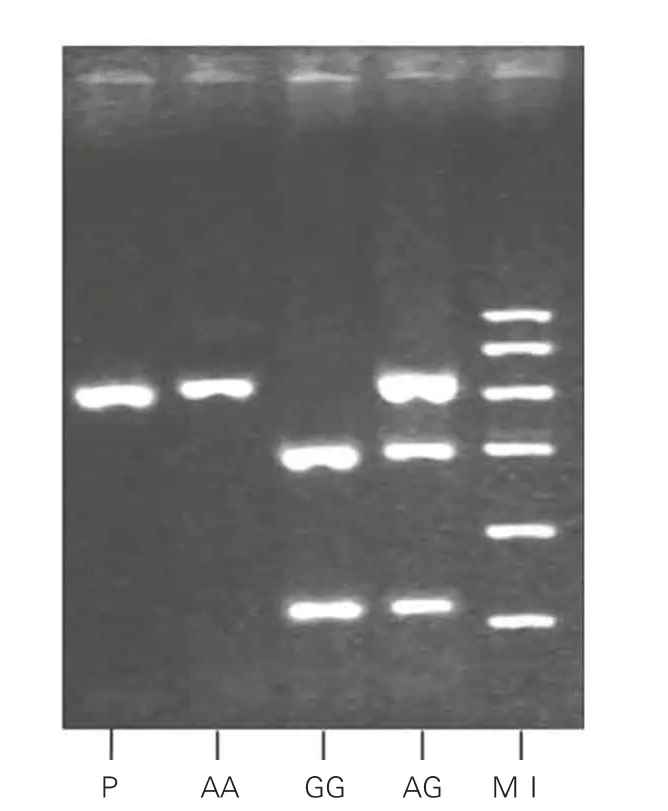
图1 瘦素受体基因Gln223Arg 多态性MspⅠ酶切电泳图
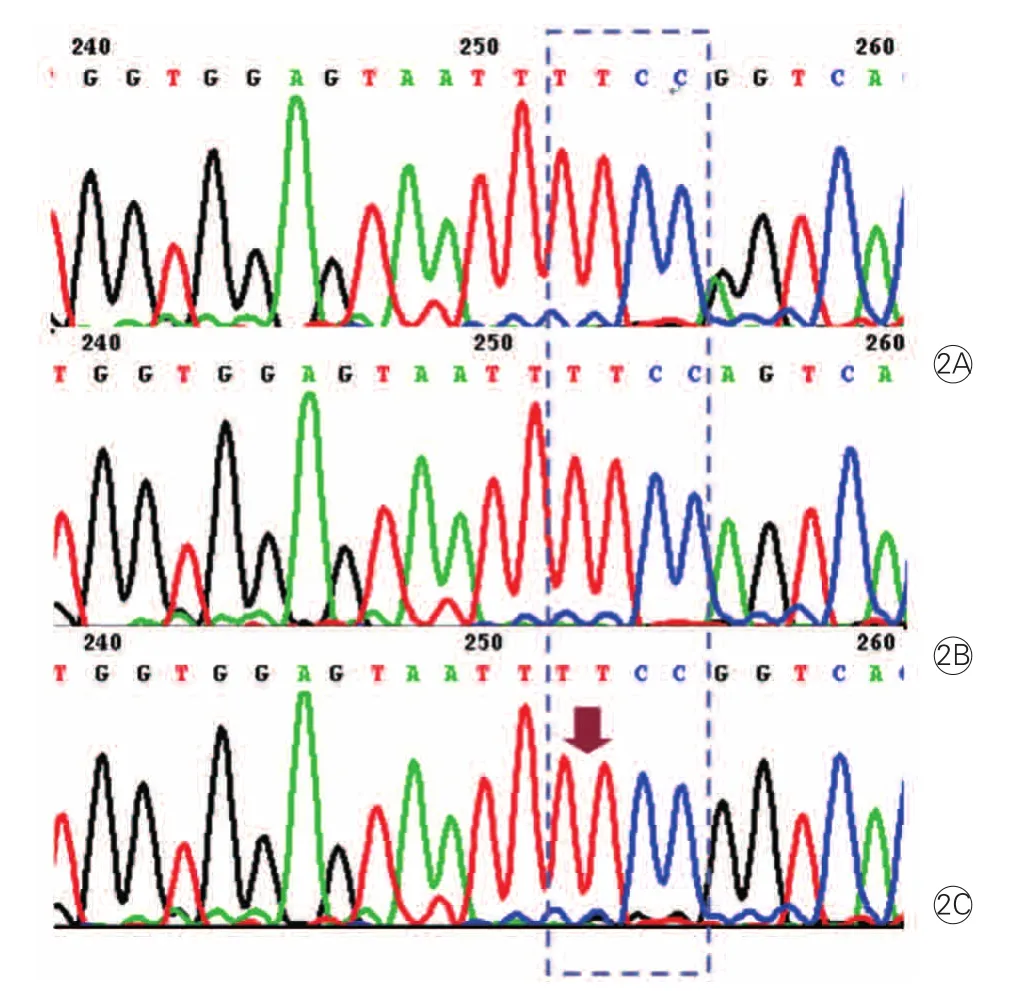
图2 瘦素受体基因Gln223Arg 多态性测序结果
Hardy-Weinberg平衡检验:四格表χ2检验示基因型分布Pearson chi-square P值在对照组和代谢综合征组分别为0.778和0.632, P均>0.05 ,基因型分布频率达到遗传平衡,具有群体代表性。
两组患者一般临床资料及生化指标比较(表1):两组间年龄、性别构成比、吸烟史、饮酒史比例差异无统计学意义。代谢综合征组BMI、血压及不同性别患者的腰围均显著高于对照组(P<0.05~0.01) 。代谢综合征组FPG、TG、TC、低密度脂蛋白胆固醇(LDL-C)、空腹Ins和HOMA-IR均显著高于对照组,HDL-C则显著低于对照组 (P<0.05~0.01),差异均有统计学意义。
两组LEPR基因Gln223Arg多态性各基因型构成比与等位基因频率比较(表2):代谢综合征组AA基因型所占比例和携带A等位基因的频率显著高于对照组(P<0.001),差异有统计学意义。在等位基因频率的比较中, OR值为3.302 [P=0.000,95%可信区间(CI):2.432~4.483]。
LEPR基因Gln223Arg基因型对代谢综合征的影响(表3): AA基因型患者的FPG、BMI、腰围、血压、TG、TC、LDL-C、空腹Ins水平、HOMA-IR均明显高于GG和AG基因型,HDL-C明显低于GG和AG基因型,差异有统计学意义(P<0.05~0.01)。在对照组AA基因型携带者亦有类似趋势,但P>0.05。
表1 两组一般临床资料及生化指标比较(±s)
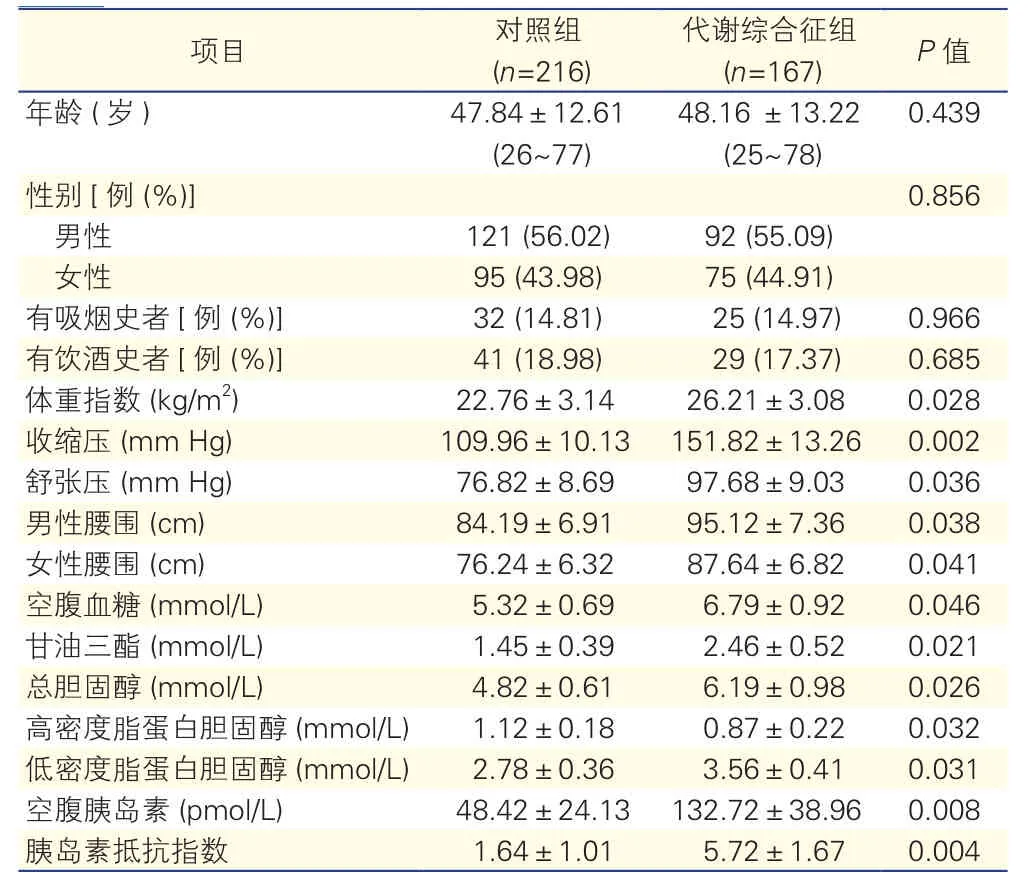
表1 两组一般临床资料及生化指标比较(±s)
注:1 mmHg=0.133kPa
项目 对照组(n=216)代谢综合征组(n=167) P值年龄 (岁) 47.84±12.61 (26~77) 48.16 ±13.22 (25~78) 0.439性别[例 (%)]0.856男性 121 (56.02) 92 (55.09)女性 95 (43.98) 75 (44.91)有吸烟史者[例 (%)] 32 (14.81) 25 (14.97) 0.966有饮酒史者[例 (%)] 41 (18.98) 29 (17.37) 0.685体重指数 (kg/m2) 22.76±3.14 26.21±3.08 0.028收缩压 (mm Hg) 109.96±10.13 151.82±13.26 0.002舒张压 (mm Hg) 76.82±8.69 97.68±9.03 0.036男性腰围 (cm) 84.19±6.91 95.12±7.36 0.038女性腰围 (cm) 76.24±6.32 87.64±6.82 0.041空腹血糖 (mmol/L) 5.32±0.69 6.79±0.92 0.046甘油三酯 (mmol/L) 1.45±0.39 2.46±0.52 0.021总胆固醇 (mmol/L) 4.82±0.61 6.19±0.98 0.026高密度脂蛋白胆固醇 (mmol/L) 1.12±0.18 0.87±0.22 0.032低密度脂蛋白胆固醇 (mmol/L) 2.78±0.36 3.56±0.41 0.031空腹胰岛素 (pmol/L) 48.42±24.13 132.72±38.96 0.008胰岛素抵抗指数 1.64±1.01 5.72±1.67 0.004
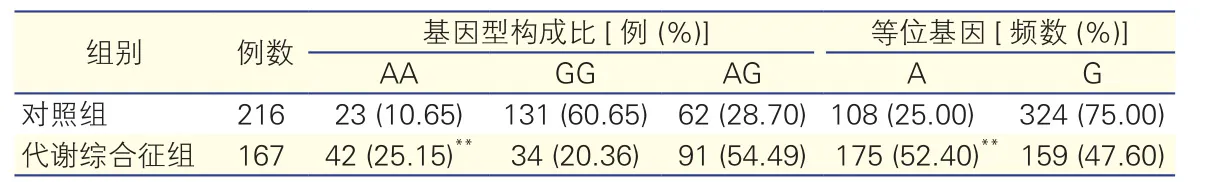
表2 代谢综合征组与对照组瘦素受体基因Gln223Arg基因型构成比与等位基因频率比较[例(%)]
表3 代谢综合征组不同瘦素受体基因Gln223Arg基因型的差异(±s)
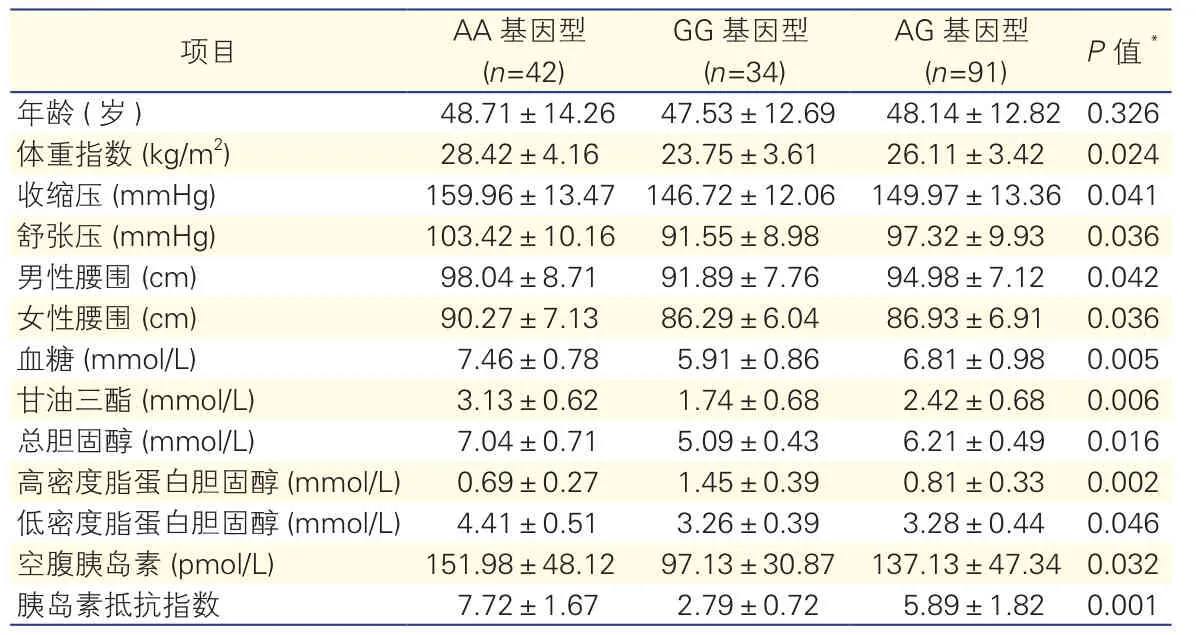
表3 代谢综合征组不同瘦素受体基因Gln223Arg基因型的差异(±s)
注:*与GG和AG基因型比较。1 mmHg=0.133 kPa
项目 AA基因型(n=42) GG基因型(n=34) AG基因型(n=91) P 值*年龄 (岁) 48.71±14.26 47.53±12.69 48.14±12.82 0.326体重指数 (kg/m2) 28.42±4.16 23.75±3.61 26.11±3.42 0.024收缩压 (mmHg) 159.96±13.47 146.72±12.06 149.97±13.36 0.041舒张压 (mmHg) 103.42±10.16 91.55±8.98 97.32±9.93 0.036男性腰围 (cm) 98.04±8.71 91.89±7.76 94.98±7.12 0.042女性腰围 (cm) 90.27±7.13 86.29±6.04 86.93±6.91 0.036血糖 (mmol/L) 7.46±0.78 5.91±0.86 6.81±0.98 0.005甘油三酯 (mmol/L) 3.13±0.62 1.74±0.68 2.42±0.68 0.006总胆固醇 (mmol/L) 7.04±0.71 5.09±0.43 6.21±0.49 0.016高密度脂蛋白胆固醇 (mmol/L) 0.69±0.27 1.45±0.39 0.81±0.33 0.002低密度脂蛋白胆固醇 (mmol/L) 4.41±0.51 3.26±0.39 3.28±0.44 0.046空腹胰岛素 (pmol/L) 151.98±48.12 97.13±30.87 137.13±47.34 0.032胰岛素抵抗指数 7.72±1.67 2.79±0.72 5.89±1.82 0.001
LEPR基因Gln223Arg各基因型对代谢综合征患者心脏结构及功能的影响(表4):代谢综合征组患者无论基因型如何,室间隔厚度(IVST)、CR、左心室后壁厚度(PW)、LVM、LVMI均高于正常值,仅AA基因型差异有统计学意义(P<0.05~0.01),而GG和AG基因型差异无统计学意义。舒张末期容积(EDV)和E/A比值均低于正常值,三种基因型差异均无统计学意义。而AA基因型的代谢综合征患者则较AG及GG基因型有更高的IVST、CR、PW、LVM和LVMI,差异有统计学意义(P均<0.05)。AA基因型患者也较其它基因型EDV和E/A比值更低,但差异均无统计学意义(P>0.05)。
表4 代谢综合征组瘦素受体基因Gln 223 Arg各基因型对心脏结构及功能的影响(±s)
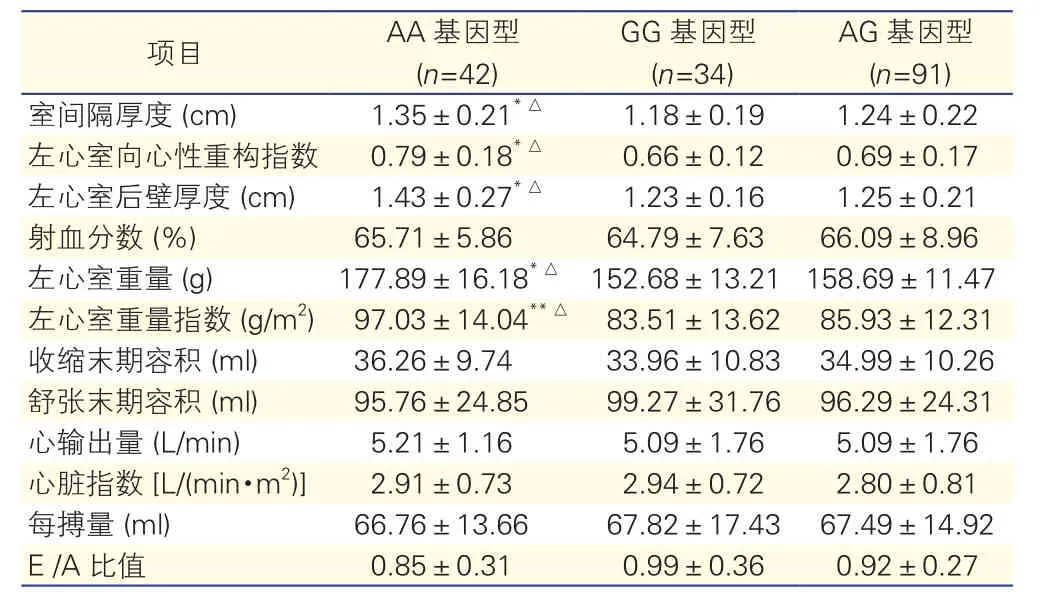
表4 代谢综合征组瘦素受体基因Gln 223 Arg各基因型对心脏结构及功能的影响(±s)
注:与正常值比较*P<0.05**P<0.01;与AG及GG基因型比较△P<0.05。E/A: 二尖瓣扩张舒张早期血流/心房收缩早期血流
AG基因型(n=91)项目 AA基因型(n=42) GG基因型(n=34)室间隔厚度 (cm) 1.35±0.21*△ 1.18±0.19 1.24±0.22左心室向心性重构指数 0.79±0.18*△ 0.66±0.12 0.69±0.17左心室后壁厚度 (cm) 1.43±0.27*△ 1.23±0.16 1.25±0.21射血分数 (%) 65.71±5.86 64.79±7.63 66.09±8.96左心室重量 (g) 177.89±16.18*△152.68±13.21 158.69±11.47左心室重量指数 (g/m2) 97.03±14.04**△ 83.51±13.62 85.93±12.31收缩末期容积 (ml) 36.26±9.74 33.96±10.83 34.99±10.26舒张末期容积 (ml) 95.76±24.85 99.27±31.76 96.29±24.31心输出量 (L/min) 5.21±1.16 5.09±1.76 5.09±1.76心脏指数 [L/(min·m2)] 2.91±0.73 2.94±0.72 2.80±0.81每搏量 (ml) 66.76±13.66 67.82±17.43 67.49±14.92 E /A比值 0.85±0.31 0.99±0.36 0.92±0.27
3 讨论
瘦素是肥胖基因的蛋白产物,有控制食物摄入和能量消耗、防止异位脂质沉积、改变肌肉或肝脏的胰岛素敏感性、联接免疫系统与内分泌系统等生物学效应。与肥胖及代谢紊乱相关,还可引起心室肥厚[1]。瘦素需与其特异性LEPR结合发挥作用。Gln223Arg是LEPR基因变异频率较高的多态性,是LEPR胞外区基因编码区第6外显子第668位碱基突变,谷氨酰胺变为精氨酸后LEPR与瘦素亲和力及信号传导发生改变,影响瘦素发挥作用。
虽曾被质疑[2],但更多的研究证实本多态性与肥胖、2型糖尿病、高血压、血脂紊乱、IR等诸多心血管危险因素密切相关[3-5]。这些因素丛集的代谢综合征会导致更大的心血管危害[6]。而左心室肥厚(LVH)是心脏靶器官损害最突出的表现。LVH可引发室性心律失常、慢性心力衰竭,降低冠状动脉储备,是预测冠心病、猝死、心力衰竭或卒中的独立危险因子[7]。但目前LEPR基因Gln223Arg变异对心脏结构功能的影响尚不明确。
本研究代谢综合征组携带Gln223Arg多态性A等位基因的频率明显高于对照组。而携带A等位基因发生代谢综合征的风险是携带G的3.302倍,且代谢紊乱更严重。这支持LEPR基因Gln223Arg多态性是代谢综合征的易感因素,与Suriyaprom等[8]的研究一致。
本研究还发现,初诊的代谢综合征患者即已出现LVH和舒张功能减低。而且携带Gln223Arg多态性A等位基因的代谢综合征患者还有更严重的LVH,并更倾向于发生舒张功能减低。LEPR基因Gln223Arg多态性变异导致代谢紊乱的可能机制为:基因变异导致LEPR表达减少和蛋白结构异常,影响其信号转导[3],造成受体不敏感,分泌过多瘦素。瘦素与其他细胞因子等相互作用,通过激活交感神经系统[9]、迷走神经调节功能受损[10]、一氧化氮机制[11]、肾素-血管紧张素系统[12]、IR[13]等机制共同促进了肥胖、高血压、高血糖、血脂紊乱等丛集并相互作用、恶性循环,促进了靶器官心脏的过早损害。
除高血压本身可造成LVH外,发生LVH和心脏功能减低的可能机制有:(1)IR能通过以下途径引发LVH[14]:①激活交感神经系统、增加血管紧张素Ⅱ的加压反应、促进肾脏重吸收钠离子和血管壁平滑肌细胞生长;②增加血管紧张素Ⅱ对细胞外信号调节激酶的刺激,致细胞增殖和细胞外基质沉积;③通过细胞外信号调节激酶和(或)蛋白激酶C途径促进心肌生长和心肌成纤维细胞胶原合成。(2)血脂紊乱也对LVH起着重要作用。高浓度的LDL-C经氧化修饰后可损伤内皮细胞并表达多种黏附分子,增强单核细胞及T淋巴细胞向内皮黏附和移动,但是减低的LDL不能够逆转LDL对内皮依赖性血管舒张的抑制作用。而高TG水平可致心肌细胞内TG堆积,造成过氧化物酶增殖物激活受体-α缺乏,促使心肌细胞肥大、间质纤维化并降低心肌顺应性[15]。(3)肥胖时脂肪组织合成分泌肿瘤坏死因子(TNF-α)、 白细胞介素-6 (IL-6)能介导IR、脂代谢障碍以及内皮功能受损。TNF-α可以直接损伤心肌收缩功能,诱导病理性心脏重塑。(4)高瘦素血症会降低迷走神经活性,增强交感神经活性,并促使儿茶酚胺分泌增多和刺激心肌细胞肾上腺能α受体。而IL-6以及转化生长因子β等中介会营养心肌、沉积间质纤维化和细胞外基质,最终导致LVH[16]。
高水平瘦素与动脉粥样硬化发生相关[17]。瘦素主要通过(1)促进C反应蛋白表达并增强巨噬细胞氧化应激导致内皮功能障碍和(2)促进血管平滑肌细胞增殖、迁移并增加其产物金属蛋白酶和纤维细胞生长因子2的表达,进而促进纤维蛋白生成,增加血小板聚集及血管生成,在动脉粥样硬化的早期发展中起重要作用。另外,瘦素通过内皮功能紊乱和增加氧化应激、增加肾脏Na+-K+-ATP 酶活性和Na+重吸收以及减少内皮细胞和平滑肌细胞对NO的生物利用度导致血管收缩,在高血压发病中起到关键作用。
瘦素具有调节心肌收缩力 、新陈代谢、 心肌细胞形态及细胞外基质生成的作用。对心肌最主要的作用是负性肌力作用,减少心脏输出量[17]。
在早前的一项研究中[18],也发现高血压组LEPR基因外显子6 Gln223Arg变异的GG基因型与AA基因型在左心室功能(射血分数、左心室舒张功能指标、左心室短轴缩短率)和肾脏血流动力学指标上存在差异。推测其机制可能与:瘦素水平高会降低动脉的舒张性以及瘦素可以促进血管内皮细胞的增生有关。
由于(1)相同基因突变在不同人群中频率不同,所起的作用可能不同;(2)人类肥胖、血压、血糖等复杂性状受多因素、多基因的影响,单个基因的影响相对较小。而且一个基因上的一点变异也不可能完全概括该基因对表型的全部作用。(3)各研究的方案设计及样本的选择方法也不相同。而本研究入选的是初发代谢综合征患者,平均年龄在中年水平,尽可能减少了这些因素的影响。
种族和表型研究结果的多样化提示LEPR基因Gln223Arg多态性可能为代谢综合征各单一组分的微效作用基因,但重要的是本研究提示了这一变异带来了明显的危险因素丛集、LVH和心脏功能减低趋势,而且心脏结构功能的损害在初诊代谢综合征时即已出现。研究国人这一多态性与代谢综合征及LVH间的关系,有助于找到代谢综合征发病的遗传机制,及早发现危险人群和早期检出心脏并发症。同时本研究提示对于存在Gln223Arg多态性变异的患者应早期开展对心脏病变的1级预防治疗。而且防治措施应该是多角度多环节的。
由于复杂的基因-环境相互作用,本研究样本量仍显不足。本研究也未进行瘦素水平的检测。今后尚需更全面的横向的基因联合变异研究。
参考文献
[1] Korolczuk A, Dudka J.Increased risk of cardiovascular complications in chronic kidney disease: a possible role of leptin.Curr Pharm Des, 2014, 20: 666-674.
[2] Pena Gd, Guimarães AL, Veloso RR, et al.Leptin receptor gene Gln223Arg polymorphism is not associated with hypertension: a preliminary population-based cross-sectional study.Cardiol Res Pract, 2014, 2014: 1-7.
[3] Angeli CB, Kimura L, Auricchio MT, et al.Multilocus analyses of seven candidate genes suggest interacting pathways for obesity-related traits in Brazilian populations.Obesity (Silver Spring), 2011, 19: 1244-1251.
[4] Liu Y, Lou YQ, Liu K, et al.Role of leptin receptor gene polymorphisms in susceptibility to the development of essential hypertension: a case-control association study in a Northern Han Chinese population.J Hum Hypertens, 2014, 28: 551-556.
[5] Li L, Lee KJ, Choi BC, et al.Relationship between leptin receptor and polycystic ovary syndrome.Gene, 2013, 527: 71-74.
[6] Cuspidi C, Sala C, Lonati L, et al.Metabolic syndrome, left ventricular hypertrophy and carotid atherosclerosis in hypertension: a genderbased study.Blood Press, 2013, 22: 138-143.
[7] 卢永昕.高血压: 从左心室肥厚到心力衰竭.中华高血压杂志, 2007, 15: 189-191.
[8] Suriyaprom K, Tungtrongchitr R, Thawnasom K.Measurement of the levels of leptin, BDNF associated with polymorphisms LEP G2548A, LEPR Gln223Arg and BDNF Val66Met in Thai with metabolic syndrome.Diabetol Metab Syndr, 2014, 6: 1-9.
[9] Head GA, Lim K, Barzel B, et al.Central nervous system dysfunction in obesity-induced hypertension.Curr Hypertens Rep, 2014, 16: 466-473.
[10] de Lartigue G, Ronveaux CC, Raybould HE.Deletion of leptin signaling in vagal afferent neurons results in hyperphagia and obesity.Mol Metab, 2014, 3: 595-607.
[11] Tsuda K.Leptin and nitric oxide in blood pressure regulation in humans.Am J Hypertens, 2014 , 27: 1428.
[12] Fontana V, de Faria AP, Oliveira-Paula GH, et al.Effects of angiotensin-converting enzyme inhibition on leptin and adiponectin levels in essential hypertension.Basic Clin Pharmacol Toxicol, 2014, 114: 472-475.
[13] Nalini D, Karthick R, Shirin V, et al.Role of the adipocyte hormone leptin in cardiovascular diseases - a study from Chennai based Population.Thromb J, 2015, 13: 1-7.
[14] Capoulade R, Clavel MA, Dumesnil JG, et al.Insulin resistance and LVH progression in patients with calcific aortic stenosis: a substudy of the ASTRONOMER trial.JACC Cardiovasc Imaging, 2013, 6: 165-174.
[15] 李艳芳, 蒋志丽, 郭彦青, 等.β3肾上腺素受体对前蛋白转化酶枯草溶菌素9和低密度脂蛋白受体表达的影响.中华老年心脑血管病杂志, 2014, 6: 627-629.
[16] Cabassi A, Dancelli S, Pattoneri P, et al.Characterization of myocardial hypertrophy in prehypertensive spontaneously hypertensive rats: interaction between adrenergic and nitrosative pathways .J Hypertens, 2007, 25: 1719-1730.
[17] 石翠翠, 张昕.脂肪因子与心血管疾病的研究进展.中国循环杂志, 2014, 29: 858-860.
[18] 王楠, 李伊林, 成蓓, 等.瘦素受体基因外显子6 Gln223Arg变异与高血压左心室功能及肾脏血流动力学的关系.中国循环杂志, 2007, 22: 260-262.
(编辑: 汪碧蓉)
收稿日期:( 2015-08-27)
中图分类号:R541.6
文献标识码:A
文章编号:1000-3614(2016)02-0127-05
doi:10.3969/j.issn.1000-3614.2016.02.007
作者简介:陈海翎 副主任医师 副教授 博士 研究方向:骨质疏松,代谢综合征,糖尿病 Email: hailing_chen@263.net 通讯作者:陈海翎
基金项目:北京市保健专项资金资助项目(项目编号:京06-09号)
目的:探究瘦素受体基因Gln223Arg多态性与代谢综合征的相关性及其对心脏结构功能的影响。
方法:研究对象为2005-10至2008-06我院门诊初诊未治疗的167例代谢综合征患者(代谢综合征组)和216例健康体检者(对照组)。测量血压、生化指标、胰岛素及超声心动图等,限制性片段长度多态性聚合酶链(PCR-RFLP)法分析Gln223Arg基因多态性和测序验证基因型。
结果: 代谢综合征组携带A等位基因频率明显高于对照组,携带A等位基因者发生代谢综合征的几率是携带G等位基因的3.302倍[P=0.000;95%可信区间(CI): 2.432~4.483]。初诊而未治疗的代谢综合征患者已出现左心室肥厚重构和舒张功能减低。代谢综合征组携带A等位基因的患者较携带G等位基因者有更高的体重指数、血压、血糖和空腹胰岛素水平,更大的腰围,更严重的血脂紊乱、胰岛素抵抗、左心室肥厚及舒张功能减低。
结论:瘦素受体基因Gln223Arg多态性A等位基因携带者发生代谢综合征的风险较大,更倾向于发生左心室肥厚。

