微星RNA对p16基因表达的调控
吕小云
(青海大学基础部,青海 西宁 810016)
吕小云(1970~),男,土族,博士在读,副教授
微星RNA对p16基因表达的调控
吕小云
(青海大学基础部,青海 西宁 810016)
摘要目的了解mir346和mir639对周期蛋白依赖激酶抑制剂2A(p16)基因表达的调控。方法以定点突变法为基础,设计获得c.-21 C >T和c.-34 G>T p16INK4a5′-UTR突变型。用选定的mirRNA和包含野生型和突变型p16INK4a5′-UTR的pGL3质粒共转染。24小时后进行双萤光素酶试剂(Promega)检测分析和实时PCR定量分析。结果Mir346和mir636 相对mir639 和mir935在MDF7和Mel28细胞有较高表达。随着mir346的导入,MCF7细胞野生型荧光酶活性显著降低(57%);突变型荧光酶活性也明显降低(39%)。并且在mir346存在时,野生型和突变型都显示出相同程度的表达量。mir639对WM266细胞荧光酶活动没有表现出显著影响。结论mir346在MCF7细胞可显著下调p16的表达,而mir639在WM266细胞对p16的表达没有显著影响。
关键词mirRNAmir63p16INK4aUTR
中图分类号R555
文献标识码识码A
DOI:10.13452/j.cnki.jqmc.2015.02.010
AbstractObjectiveTo investigate the impact of mir346 and mir639 on the regulation of p16INK4a5′-UTR expression.Method A site-directed mutagenesis approach was developed to obtain the c.-21 C>T and the c.-34 G>T p16INK4a 5′-UTR mutations.With the chosen mirRNA and pGL3-based luciferase vectors containing the wild type or the mutated p16INK4a5′-UTR transfected the cancer cell line.The cells were harvest in 24 h and then luciferase assays and real time PCR analysis were carried out using the dual-luciferase reagent.Result Mir346 and mir636 showed a higher expression in MDF7 and Mel28 cell lines compared to mir639 and mir935.The lusiferase activity of wild type p16 in MCF7 cell line decreases notably(57%)and variant type decreases also down to 39%.Both the wild and variant p16 expressed the same level when mir346 existing.mir639 have not show a notable impact on WM266 cell line.Conclusion mir346 can download the expression of p16INK4a5′-UTR in MCF7 cell and mir639 has no direct impact on in WM266 cell line.
KeywordsmirRNAmir 639p16INK4aUTR
收稿日期2014-12-13
MODULATING EFFECT OF mirRNA ON p16 GENE EXPRESSION
Lü Xiaoyun
(Department of Basic science,Qinghai University,Xining,Qinghai 810016)
MicroRNA(miRNA)是一种内生的、大小约20~24个核苷酸的单链小分子RNA。长度大约为300~1000个碱基的pri-miRNA经过一次加工后,成为长度大约为70~90个碱基的具有发夹结构的单链RNA前体pre-miRNA,pre-miRNA再经过Dicer酶酶切后,成为长约20~24 nt的成熟miRNA。MicroRNAs(miRNAs)不同于siRNA(双链),但是和siRNA密切相关。据推测,这些非编码小分子RNA(miRNAs)参与调控基因表达,但其机制区别于siRNA介导的mRNA降解。每个miRNA可以有多个靶基因,而几个miRNAs也可以调节同一个基因。这种复杂的调节网络既可以通过一个miRNA来调控多个基因的表达,也可以通过几个miRNAs的组合来精细调控某个基因的表达。据推测,miRNA调节着人类三分之一的基因。 第一个被确认的miRNA是在线虫中首次发现的lin-4 和let-7,随后多个研究小组在包括人类、果蝇、植物等多种生物物种中鉴别出数百个miRNAs[1]。
研究发现,在基因RIP140 mRNA(receptor-interacting protein 140)的5′UTR(5′-untranslated region)区域存在一个miRNA(microRNA)mir-346的靶序列[2]。
人类TAP1(the ER antigen peptide transporter 1)mRNA是miR-346的一个直接靶基因。TAP1的3′-UTR包含一个miR-346的典型种植区域(canonical seeding site)。miR-346抗素(miR-346 antagomir)能够反转和内质网(Endoplasmic Reticulum)应激相关的TAP1 mRNA和蛋白质还原反应[3]。
周期蛋白依赖激酶抑制剂2A(Cyclin-dependent kinase inhibitor 2A)(CDKN2A,p16Ink4A) ,也称多肿瘤抑制基因(multiple tumor suppressor 1,MTS-1),在人类是P16蛋白的编码基因[4]。MTS-1位于人类的第9号染色体短臂2区1带(9p21),由2个内含子及3个外显子组成,第1外显子(exon1a)由126bp组成,主要编码p16INK4aa蛋白;第2外显子(exon1b)由307 bp组成,主要编码p14ARF蛋白。p16蛋白,定位于细胞核内,是作用于细胞分裂周期关键酶之一的CDK4的抑制因子。p16基因在细胞周期调控、细胞分化和增殖中发挥着重要作用,包括黑色素瘤(melanoma)、胰腺癌(Pancreatic adenocarcinoma)、食管癌(esophageal cancer)、胃癌(gastric cancer)等很多肿瘤细胞中都发现p16纯合子的缺失和突变[5-6]。很多研究都证实在这个基因的编码区的突变都关联着黑色素瘤的病例[7-9],但也有研究发现非编码区5′UTR的突变同样与黑色素瘤的发生有关:5′UTR的34G >T 和21C>T突变[10-11]。
研究发现,p16基因和很多基因(SERTAD1[12],CCNG1[13],死亡相关蛋白 6[14],P53、Mdm2和RPL11[15],E4F1[16],周期蛋白依赖激酶4和6[17]等)相互作用。利用生物信息学法推测,我们发现在周期蛋白依赖激酶抑制剂2A基因的5′UTR区域存在mir346、mir636、mir639和mir935四种MicroRNA的靶序列。本研究根据这几种MicroRNA在癌细胞的表达情况,调查了mir346和mir935对p16基因表达的调控。结果表明,mir346可显著下调P16的表达,而mir935对P16的表达没有影响。另外,在本研究中,考虑到p16INK4a3′-UTR潜在的病理调控机制,我们同时也在pGL3质粒Luc+下游Xbal和Hpal限制性内切酶位点之间克隆了3′-UTR。有关3′-UTR的实验结果和数据将在后续文章发表。
1材料与方法
1.1 生物信息学预测
通过生物信息学预测,在周期蛋白依赖激酶抑制剂2A 基因的5′UTR区域存在mir346、mir636、mir639和mir935四种MicroRNA的靶序列,表1是这几个microRNA的种植区域(seeding site)和p16INK4a5′-UTR的结合位点分析。下划线为和CDKN2A 5′UTR的结合区域。Mir346和p16INK4a5′-UTR野生型有7个结合碱基对,突变型有5个结合碱基对;Mir636和p16INK4a5′-UTR野生型有8个结合碱基对,突变型有6个结合碱基对;Mir639和p16INK4a5′-UTR野生型有6个结合碱基对,突变型有5个结合碱基对;Mir935和p16INK4a5′-UTR野生型有6个结合碱基对,突变型有7个结合碱基对。
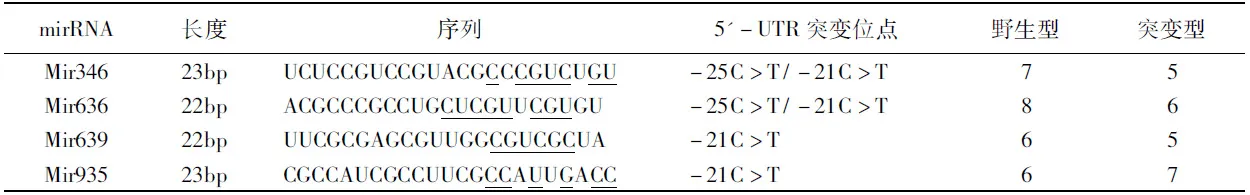
表1 预测的mirRNA和p16INK4a5′-UTR结合位点分析
1.2 细胞株和培养
人类乳腺癌细胞MCF-7、人类神经母细胞瘤SH-SY5Y细胞和人类黑色素瘤细胞G361和SK-Mel-5来自意大利CIBIO生物研究中心,这些细胞保养在追加了10% FCS和抗生素(100 uits/mL青霉素和100g/mL链霉素)的DMEM培养基中。
1.3 质粒克隆
本研究中我们所使用的野生型p16INK4a5′-UTR,是the Ensembl Genome Browser(http://www.ensembl.org/index.html)所表征的一段271 bp的片段。利用在5′端包含对Fw-C的HindIII-XbaI-EcoRI 和对Rev-C的NcoI-NdeI-ClaI的限制性内切酶位点的引物,我们PCR扩增了来自SH-SY5Y细胞基因组DNA的p16INK4a5′-UTR,然后利用HindIII-NcoI限制性内切酶,把扩增元克隆到商业性的pGL3-basic和pGL3-promoter质粒中。在pGL3-promoter质粒中,p16INK4a5′-UTR直接克隆在萤火虫互补DNA(Firefly cDNA)起始密码子上游和来自SV40增强子的下游来评估5′-UTR序列对报告基因的影响。
我们以定点突变法为基础,设计了获得c.-21 C>T 和 c.-34 G>T p16INK4a5′-UTR突变的PCR实验方法。使用一段包含突变的长30 nt的互补引物,结合合适的外侧Fw-C或Rev-C引物,获得了搭接有包含突变的30 nt内测引物的271 bp的p16INK4a5′-UTR。以它为模板,再利用外侧引物进行二次PCR,并利用EcoRI-NdeI内切位点把包含突变的p16INK4a5′-UTR克隆到报告质粒上。所有克隆的质粒都经过了限制酶切图和DNA测序检验。
1.4 细胞萤光素酶检测
转染前24小时,在24孔培养盘上种植5×104个细胞。然后根据使用说明,用FuGENE 6或Myrus LT-1试剂进行转染。p16INK4a5′-UTR报告质粒为350 ng,对照pRLSV40质粒为50 ng。转染24小时后行双萤光素酶试剂(Promega)检测分析。
1.5 萤光素酶mRNA表达的实时PCR定量分析
MCF7和WM266种植在6孔培养盘里,用选定的mirRNA和包含野生型和突变型p16INK4a5′-UTR的pGL3质粒共转染。24小时后处理,先用PBS清洗。 用AllPrep DNA/RNA Mini Kit (Qiagen, 米兰,意大利)试剂盒提取总RNA和基因组DNA,纯度和浓度用NanoDdrop ND1000分光光度计检测。用AffinityScript cDNA Synthesis Kit(Stratagene,米兰,意大利)试剂盒和1g的RNA进行cDNA的合成。用RotorGene 6000 thermal cycler(Corbett Life Science,Ancona,意大利)和5PRIME Sybr-Green MasterMix(Eppendorf,米兰,意大利)进行实时PCR扩增。用DCt法进行mirRNA和mRNA表达的定量分析。用同一培养盘提取的基因组DNA的相同PCR引物进行转染细胞的质粒拷贝数定量分析。
2结果和讨论
2.1 mirRNA表达
我们用实时PCR的方法检测了预测的Micro-RNA的表达。定量RT-PCR实验(Quantitative RT-PCR experiments)显示了四种预测的mirRNA(Mir346、mir636、mir639和mir935)在三种癌细胞里的表达。Mir346和mir636相对mir639和mir935在MCF7和Mel28细胞有较高表达,但在WM266细胞,mir346相比后者没有显著区别(图1)。
2.2 mirRNA对P16基因表达的调控
我们开发了荧光酶报告实验(luciferase-based reporter assays)来作相关研究:我们将萤火虫(firefly)cDNA的5′UTR的上游直接酶接到pGL3-basic和pGL3-promoter质粒上。由于存在来自SV40的启动子,pGL3-promoter质粒的荧光强度高于pGL3-basic。我们把p16INK4a50-UTR克隆到病毒启动子的外测和下游,以其他能被整体转录,并代替萤火虫荧光酶的5′-UTR。3′-UTR定位在Luc+下游Xbal和Hpal限制性内切酶位点之间。这些构建的质粒和参照质粒 pRL-SV40(the control luciferase pRL-SV40 plasmid)一经传染到MCF7和WM266细胞,就进行了荧光酶实验。 这些癌细胞本身都没有p16INK4a蛋白的表达。在MCF7细胞里,荧光实验显示(图2),对照组突变型荧光酶活性稍低于野生型(30%),随着mir346的导入,野生型荧光酶活性显著降低(57%);突变型荧光酶活性也明显降低(39%)。并且在mir346存在时,野生型和突变型都显示出相同程度的表达量。WM266细胞里对照组突变型和野生型荧光酶活性几乎相同(差别6%,图3)。mirRNA639导入时,p16INK4a5′-UTR荧光酶活动没有明显区别,其中野生型增加10%,突变型降低29%。
Mir346相比mir639在MCF7细胞对p16INK4a5′-UTR具有明显调控作用,可能与该微星RNA在MCF7细胞相比WM266细胞具有相对较高的表达有关。后续研究有待检测mir346在相对表达较低的WM266细胞中对p16INK4a5′-UTR的调控。同时,mir636在WM266细胞也具有相对较高表达,后续研究也有待检测该微星RNA在WM266细胞的调控作用。

图1四种预测的mirRNA在三种癌细胞中的表达
Figure 1Comparison of expression level of the predicted mirRNAs in three different cell lines

图2 MCF7细胞中mir346对p16INK4a5′-UTR荧光酶活性的影响图
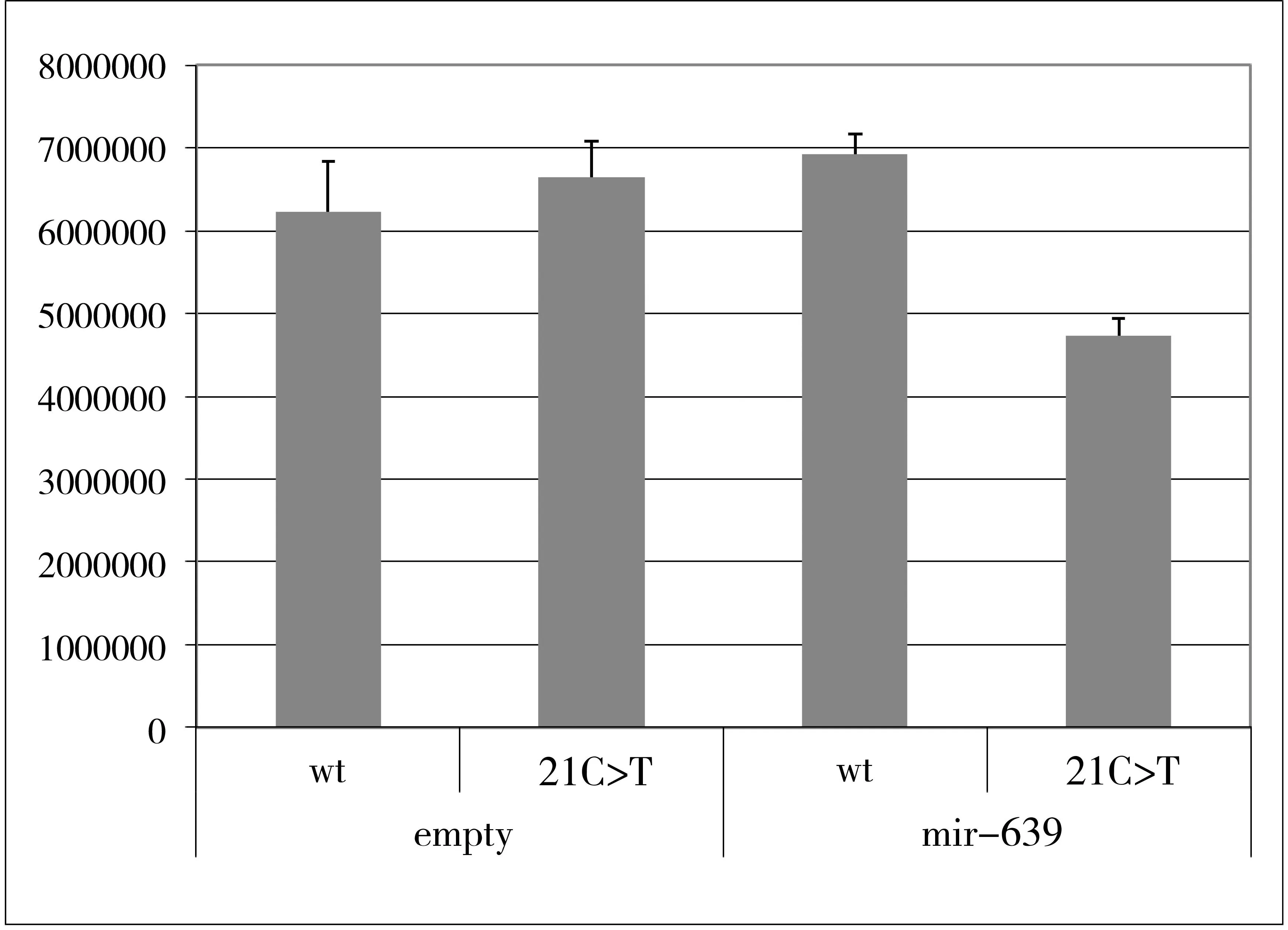
图3 WM266细胞中mir639对p16INK4a5′-UTR荧光酶活性的影响
从以上数据可以看出,微星RNA在细胞的表达量应该与它们和p16INK4a5′-UTR的结合位点的多少没有直接关系。比如Mir346和mir639与突变型p16INK4a5′-UTR的结合位点都是5个,但在MCF7和Mel28细胞的表达量差别很大,而在WM266细胞却有相同的表达。至于这些微星RNA对p16INK4a5′-UTR的表达的调控机理的进一步确定,还需要更多的实验数据来提供依据。
参考文献
[1]Kusenda B,Mraz M,Mayer J,et al.MicroRNA biogenesis,functionality and cancer relevance[J].Biomed Pap Med Fac Univ Palacky Olomouc Czech Repub,2006,150(2):205-15.
[2]Tsai NP,Lin YL,Wei LN.MicroRNA mir-346 targets the 5′-untranslated region of receptor-interacting protein 140(RIP140)mRNA and up-regulates its protein expression[J].Biochem J,2009,424(3):411-8.
[3]Rafal Bartoszewski,Joseph W.Brewer,Andras Rab,et al.The Unfolded Protein Response(UPR)-activated Transcription Factor X-box-binding Protein 1(XBP1)Induces MicroRNA-346 Expression That Targets the Human Antigen Peptide Transporter 1(TAP1)mRNA and Governs Immune Regulatory Genes[J].The Journal of Biological Chemistry,2011,286:41862-41870.
[4]Stone S,Jiang P,Dayananth P,et al.Complex structure and regulation of the P16(MTS1)locus[J].Cancer Res,1995,55(14):2988-94.
[5]Nobori T,Miura K,Wu DJ,et al.Deletions of the cyclin-dependent kinase-4 inhibitor gene in multiple human cancers[J].Nature,1994,368(6473):753-6.
[6]Liggett WH,Sidransky D.Role of the p16 tumor suppressor gene in cancer[J].J.Clin.Oncol,1998,16(3):1197-206.
[7]Walker,G.J.,Gabrielli,et al.Functional reassessment of P16 variants using a transfection-based assay[J].Int. J.Cancer,1999,82:305-312.
[8]Kannengiesser,Brookes,del Arroyo,et al.Functional,structural,and genetic evaluation of 20 CDKN2A germline mutations identified in melanoma-prone families or patients[J].Hum Mutat,2009,30:564-574.
[9]Becker,T.M.,Rizos,H.,et al.Functional impairment of melanoma-associated p16(INK4a)mutants in melanoma cells despite retention of cyclin-dependent kinase 4 binding[J].Clin.Cancer Res,2001,7:3282-3288.
[10]Liu,L.,Dilworth,et al.Mutation of the CDKN2A 50-UTR creates an aberrant initiation codon and predisposes to melanoma[J].Nat.Genet,1999,21,128-132.
[11]Alessandra Bisio,Sabina Nasti,Jennifer J.et al.Functional analysis of CDKN2A/p16INK4a 50-UTR variants predisposing to melanoma[J].Human Molecular Genetics,2010,19(8):1479-1491.
[12]Li,Junan,Tsai Ming-Daw,Muscarella Peter,et al.The nuclear protein p34SEI-1 regulates the kinase activity of cyclin-dependent kinase 4 in a concentration-dependent manner[J].Biochemistry,2004,43(14):4394-9.
[13]Zhao,Lili,Winckler Sarah,et al.Cyclin G1 has growth inhibitory activity linked to the ARF-Mdm2-p53 and pRb tumor suppressor pathways[J].Mol.Cancer Res,2003,1(3):195-206.
[14]Ivanchuk,Stacey M,Rutka James T,et al.p14ARF interacts with DAXX:effects on HDM2 and p53[J].Cell Cycle,2008,7(12):1836-50.
[15]Zhang,Yanping,Bhat Krishna,et al.Ribosomal Protein L11 Negatively Regulates Oncoprotein MDM2 and Mediates a p53-Dependent Ribosomal-Stress Checkpoint Pathway[J].Mol.Cell.Biol,2003,23(23):8902-12.
[16]Rizos,Helen,Badhwar Prerna,et al.Association of p14ARF with the p120E4F transcriptional repressor enhances cell cycle inhibition[J].J.Biol.Chem,2003,278(7):4981-9.
——一道江苏高考题的奥秘解读和拓展

