移居青海高原汉族HIF-1α基因rs11549467多态性与慢性高原病易感性※
熊辉霞,李占全,崔 森,杨应忠
(1.青海大学附属医院血液科,青海 西宁 810000;2.青海大学高原医学研究中心,青海 西宁 810001)
熊辉霞(1977~),女,汉族,硕士,副教授
移居青海高原汉族HIF-1α基因rs11549467多态性与慢性高原病易感性※
熊辉霞1,李占全1,崔森1,杨应忠2
(1.青海大学附属医院血液科,青海 西宁 810000;2.青海大学高原医学研究中心,青海 西宁 810001)
摘要目的探讨移居青海高原汉族HIF-1α基因rs11549467单核苷酸多态性与慢性高原病(chronic mountain sickness,CMS)易感性。方法收集移居青海高原汉族CMS男性患者和体检健康男性各120例,采用聚合酶链反应-限制性片段长度多态性(PCR-RFLP)法检测HIF-1α基因rs11549467位点多态性,基因突变者采用测序验证,分析其与CMS的易感性。 结果HIF-1α基因rs11549467位点存在G、A两个等位基因和GG、GA两种基因型,病例组和对照组各基因型及等位基因频率比较均无显著性差异,P>0.05。结论移居青海高原汉族人群HIF-1α基因rs11549467位点基因多态性可能与CMS易感性无关。
※:青海省自然科学基金(No.2011-Z-927Q)
关键词慢性高原病缺氧诱导因子1α单核苷酸多态性
中图分类号R394.5
文献标识码识码A
DOI:10.13452/j.cnki.jqmc.2015.02.006
AbstractObjectiveTo explore the relationship between the single nucleotide polymorphism(SNP)rs11549467of hypoxia inducible factor-1alpha(HIF-1α)gene and chronic mountain sickness(CMS)in Han Chinese migrated to Qinghai plateau.Methods 120 patients with CMS were selected as case group and 120 healthy volunteers were matched as control group.Genotypes were identified with a combination of polymerase chain reaction-restriction fragment length polymorphism(PCR-RFLP).The mutation genotype were tested by gene sequencing.Results G and A allele types,GG and GA genotypes were identified in the populations.The distribution of the frequencies of genotypes and alleles in the two groups showed no significant difference(P>0.05).Conclusion HIF-1α gene rs11549467 polymorphism have probably no relationship with CMS in Han Chinese migrated to Qinghai plateau.
KeywordsChronic mountain sicknessHypoxia-induciblefactor-lα Single nucleotide polymorphism
收稿日期2015-02-03
RELATIONSHIP BETWEEN HIF-1α GENE rs11549467
POLYMORPHISM AND CHRONIC MOUNTAIN SICKNESS IN HAN
CHINESE MIGRATED TO QINGHAI PLATEAU
Xiong Huixia1,Li Zhanquan1,Cui Sen1,Yang Yingzhong2
(1.Department of Hematology,The Affiliated Hospital of Qinghai University,Xining,Qinghai 810000;
2.Research Center for High Altitude Medical Sciences of Qinghai University,Xining,Qinghai 810001)
在同一海拔地区,移居人群的慢性高原病(chronic mountain sickness,CMS)发病率显著高于世居人群[1,2],Jiang等[3]报道移居青藏高原汉族CMS的发病率高达26.5%(海拔3700 ~5380m)。青海地区平均海拔3000 m以上,随着移居高原汉族人口急剧增加,CMS发病率亦呈上升趋势。阐明CMS的发病机制和寻找有效的防治措施已经成为一个亟待解决的问题。HIF-1α是机体缺氧反应中最重要的转录调控因子,其表达水平和基因多态性可能对下游基因的表达有明显的影响,继而影响机体对高原低氧环境的习服适应。因此,HIF-1α基因的SNP可能成为CMS易感筛选的一个标志。本研究对移居青海高原汉族人群HIF-1α基因第12外显子区的rs11549467位点多态性与CMS进行了关联研究,现报告如下。
1资料与方法
1.1 一般资料
由于CMS发病多为男性,因而本课题全部选择移居高原汉族男性作为研究对象,来源为青海省果洛州玛沁县、玉树州结古镇、海南州贵南县、海西州都兰县移居汉族男性,生活地域海拔范围在3100 ~4000 m,移居高原前均世居平原,移居高原时间≥3年。CMS组:选择符合2004年第六届国际高原医学和低氧生理学术大会制订的慢性高原病青海诊断标准[4]的CMS患者120例,年龄在18岁~58岁,平均35岁;对照组:血红蛋白浓度<21 g/dL,年龄、职业、居住地海拔、移居时间与病例组相匹配的健康体检者120例。所有研究对象间均无血缘关系。
1.2 仪器与试剂
PCR扩增仪(美国BIO-RAD伯乐公司),水平电泳仪(北京六一仪器厂),自动凝胶成像仪(BIO-RAD、GelDoc凝胶成像系统)。基因组DNA提取试剂盒[天根生化科技(北京)有限公司],PCR引物(上海捷瑞生物工程技术有限公司),AciⅠ限制性内切酶(New England Biolabs),dNTPs、Taq DNA聚合酶[天根生化科技(北京)有限公司]。
1.3 多态性检测方法
研究对象采集外周静脉血2 mL,EDTA抗凝,严格按照DNA提取试剂盒说明书提取DNA。引物序列为F:5′-AAGGTGTGGCCATTGTAAAAACTC-3′,R:5′-TGACTCAAAGCGACAGATAACACG-3′。PCR反应体系为25 μL,内含DNA模板500 ng,取10 umol/L的引物各0.5 μL,取2×Tap Plus PCR MasterMix 12.5 μL(内含0.1U Taq Plus Polymerase/μL、500μM dNTP 、20mM Tris-HCl、100mM KCl、3mM MgC12)。循环参数:95 ℃预变性3 min;95 ℃变性30 s,55 ℃退火30 s,72 ℃延伸30 s,30个循环;最后于72 ℃延伸10 min。PCR产物用AciⅠ(5U/μL)限制性内切酶酶切。酶切产物15 μL在2.5%琼脂糖凝胶、0.5×TBE缓冲液中行水平电泳,电压150 V,时间30 min,以DNA Marker DL2000作标准参照,通过自动凝胶成像仪成像并观察结果,扫描保存检测基因型。基因突变者采用测序验证。
1.4 统计分析方法
运用SPSS17.0统计软件。病例组和对照组各基因型分布频率先进行Hardy-Weinberg(H-W)平衡检验以确定群体的代表性,不同组基因型频率比较采用χ2检验,P<0.05为差异有统计学意义。
2结果
2.1 HIF-1α基因rs11549467基因多态性
rs11549467位点扩增片段长475 bp,其G 等位基因型可被AciⅠ酶切为145 bp和330 bp的2 个片段,1790位G突变为A 则AciⅠ的酶切位点消失。所有样本均检出G、A两个等位基因,检出GG、GA两种基因型,未见AA基因型。基因突变者采用测序验证,测序结果与PCR-RFLP分型结果吻合,提示PCR-RFLP基因分型的结果准确可信。见图1~2。
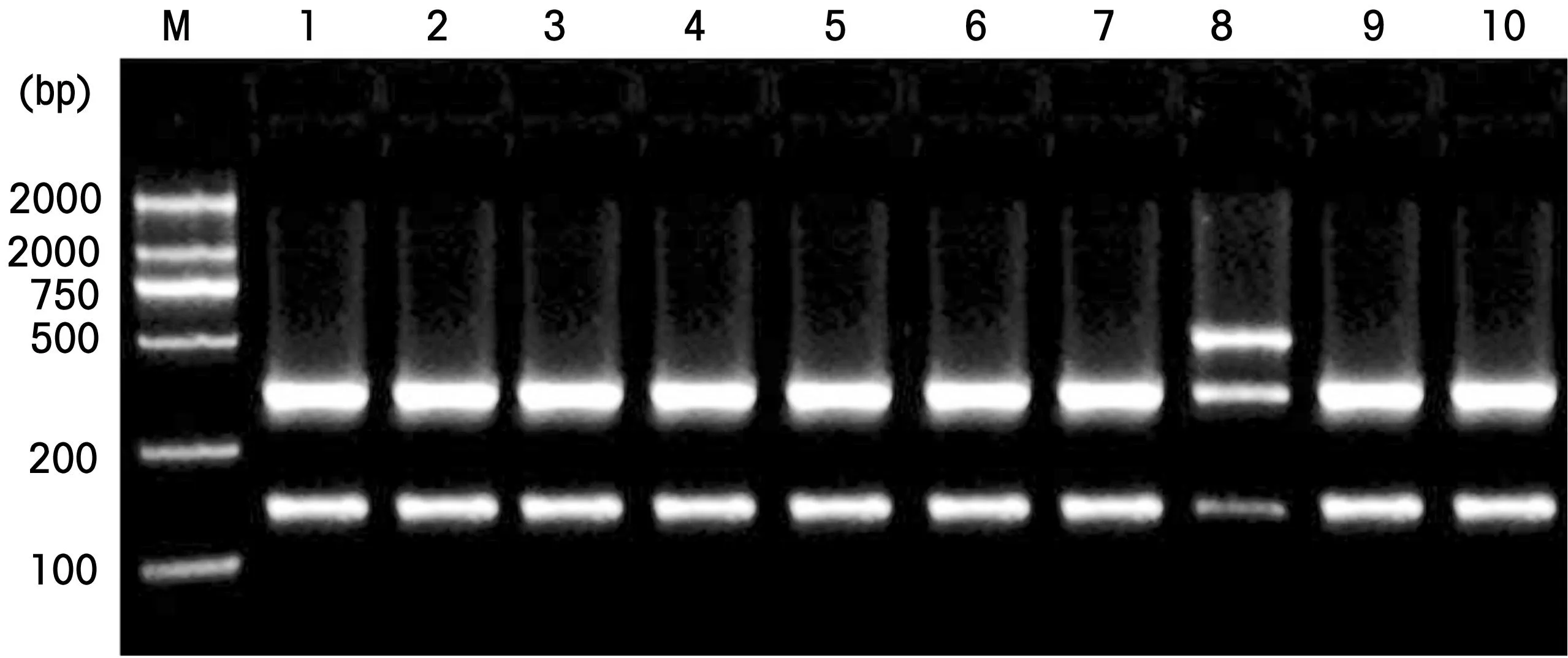
M:MarkerD2000;8号为GA型,其余为GG型
图1酶切电泳图
Figure 1Electrophoresis of PCR -RFLP

图2 基因测序图
2.2 Hardy-Weinberg平衡检验
病例和对照组中rs11549467位点基因型频率均符合Hardy-Weinberg 遗传平衡(病例组:χ2=0.108,P>0.05;对照组:χ2=0.227,P>0.05),群体具有代表性。
2.3 病例组与对照组基因型和等位基因频率分布
病例组和对照组各基因型及等位基因频率比较均无显著性差异,P>0.05。见表1。

表1 HIF-1α基因rs11549467基因型和等位基因频率分布[n(%)]
3讨论
CMS 发病具有明显的种族差异和个体易感倾向。国内外高原医学工作者比较了四个不同高原的人群(南美印第安人、尼泊尔夏尔巴人、青藏高原居民和美国科罗拉多州的利德维尔人),结果表明,移居青藏高原的汉族和移居南美洲的西班牙人其CMS发病率显著高于当地的世居者,青藏高原的藏族和夏尔巴人极少发生CMS,提示CMS存在易感人群和非易感人群,CMS的发生可能是遗传因素和环境因素相互作用的结果[5,6]。随着人类基因组计划的完成,人们越来越相信基因中的这类多态性有助于解释个体的表型差异、不同群体和个体对疾病,特别是复杂疾病的易感性以及对环境因子的反应。目前,SNP与疾病的相关性研究已经进入了一个新时代。研究核基因组DNA单核苷酸多态性与CMS发病的遗传易感机制,寻找到确定的遗传分子标记,并通过基因工程技术,干预靶基因的表达水平,无疑将为CMS易感者的筛查、预测提供理论和实验依据。
慢性缺氧导致的红细胞过度增生与肺部血管重塑是CMS最主要的病理生理学改变,而HIF-1α是此过程中最重要的调控环节,也是哺乳动物不同组织、细胞形成缺氧耐受的共同的分子生物学机制。HIF-1α可调控多个下游基因的表达,如 EPO、NOS、ET-1和VEGF等,在增强细胞对低氧的耐受能力的同时,通过红细胞过度生成,血管新生及微血管密度增高、血管阻力增加等环节介导CMS的发生。Pattinso等[7]的动物实验提示,HIF-1α有助于高原病形成过程中低氧性肺动脉高压的发生,增加或抑制HIF-1α的生成,有可能影响人体对低氧的生理反应。高原土著人群的HIF-1α的 mRNA水平显著高于平原世居人群。氧浓度高时,HIF-1α的表达低,而氧浓度低时,HIF-1α的表达高,提示高原土著人群的HIF-1α的高表达可能是对缺氧环境的一种相对适应[8]。在不同人群的比较研究中发现夏尔巴人HIF-1α基因 GT14 等位基因的频率显著高于日本人,G1790A 的频率显著高于汉族人,HIF-1α的这些SNPs与高原习服适应相关[9]。
本研究选择HIF-1α第12外显子区的rs11549467位点探讨其与移居青海高原汉族男性CMS易感性的关系,该位点位于氧依赖性降解区域(oxygen dependent degeneration domain,ODD)结构域,与HIF-1α对下游基因的转录激活能力密切相关[10]。结果显示,病例组与对照组之间各基因型频率及等位基因频率比较均无显著性差异(P>0.05),即HIF-1α基因rs11549467位点多态性可能与移居青海高原汉族男性CMS无关。而李晓娜等[11]的研究却发现这两个位点的突变杂合子基因型的发生率在高原红细胞增多症患者明显高于对照组。Ke等[12]在对rs11549467位点用限制性内切酶AciⅠ进行分型时发现,该位点的前1个碱基位置存在1个C/T SNP,C/T基因的突变导致其所在的编码的密码子由UCC变为UCU,这两个都是丝氨酸的密码子,因此该突变导致了一个同义突变。因此当出现这个G/A突变或者C/T基因型时,都会产生相同的酶切结果,影响对结果的判读,因此有必要对纯合子也进行测序。但是,环境影响下基因型决定个体表型这一观点仍然没有变化。因为人类对高海拔低氧的环境压力的反应是多方面的,因此受到多个基因座的影响,虽然每个基因的影响是微小的但却是重要的。在以后的研究中,我们有必要扩大候选基因数目,进行大量样本的筛查,并且将基因组学、遗传学、分子生物学、生理学等学科结合起来,才能对高海拔人群的适应性有更好地理解,同时也有助于对高原相关疾病的预防与治疗。
参考文献
[1]Xing G,Qualls C,Huicho L,et al.Adaptation and mal-adaptation to ambient hypoxia;Andean,Ethiopian and Himalayan patterns[J].PLoS One,2008,3(6):e2342.
[2]Wu TY.Chronic mountain sickness on the Qinghai-Tibetan plateau[J].Chin Med J(Engl),2005,118(2):161-8.
[3]Jiang C,Chen J,Liu F,et al.Chronic mountain sickness in Chinese Han males who migrated to the Qinghai-Tibetan plateau:application and evaluation of diagnostic criteria for chronic mountain sickness[J].BMC Public Health,2014,9(14):701.
[4]国际高原医学会慢性高原病专家小组.慢性高原病青海诊断标准[J].青海医学院学报,2005,26(1):3-5.
[5]Beall CM.Human adaptability studies at high altitude:research designs and major concepts during fifty years of discovery[J].Am J Hum Biol,2013,25(2):141-7.
[6]Bigham AW,Wilson MJ,Julian CG,et al.Andean and Tibetan patterns of adaptation to high altitude[J].Am J Hum Biol,2013,25(2):190-7.
[7]Pattinson KT,Sutherland AI,Smith TG,et al.Acute mountain sickness,vitamin C,free radicals,and HIF-1alpha[J].Wilderness Environ Med,2005,16(3):172-173.
[8]Guan L,Chi W,Xiao W,et al.Analysis of hypoxia-inducible factor alpha polyploidization reveals adaptation to Tibetan Plateau in the evolution of schizothoracine fish[J].BMC Evol Biol,2014,14:192.
[9]Suzuki K,Kizaki T,Hitomi Y,et al.Genetic variation in hypoxia-inducible factor 1alpha and its possible association with high altitude adaptation in Sherpas[J].Med Hypotheses,2003,61:385-389.
[10]Fu SL,Miao J,Ding B,et al.Neoplasma.A polymorphism in the 3′ untranslated region of Hypoxia-Inducible Factor-1 alpha confers an increased risk of cervical cancer in a Chinese population[J].Neoplasma,2014,61(1):63-69.
[11]李晓娜,任海林,马德庆,等.高原红细胞增多症患者低氧诱导因子-1α基因第12外显子多态性分析[J].环境与健康杂志,2012,29(12):1105-1107.
[12]Ke JK,Yao YF,Shi L,et al.Study of nine single nucleotide polymorphism loci of human HIF1A gene in three Tibetan groups[J].Zhonghua Yi Xue Yi Chuan Xue Za Zhi,2010,27(5):584-589.

