急性低氧过程中内源性肾上腺素对麻醉大鼠低氧性肺水肿的保护机制※
李筱玥,蔡秋瑾,张 欢,刘瑞欣,纪巧荣,周 振,张 伟
(青海大学医学院,西宁 810001)
急性低氧过程中内源性肾上腺素对麻醉大鼠低氧性肺水肿的保护机制※
李筱玥,蔡秋瑾,张欢,刘瑞欣,纪巧荣,周振,张伟*
(青海大学医学院,西宁 810001)
摘要目的探讨急性低氧过程中内源性肾上腺素对麻醉大鼠低氧性肺水肿的保护机制。方法将SD大鼠随机分为对照组、肾上腺切除组、低氧对照组和低氧肾上腺切除组。采用PowerLab生物信号采集系统分别在常氧(20%O2,80%N2)、低氧(15%O2,85%N2)条件下实时、动态监测系统平均动脉压(mean artery pressure,MAP)、肺动脉压(pulmonary artery pressure,PAP)、左心房压(left arterial pressure,LAP)、中心静脉压(central venous pressure,CVP)、气道压力(airway pressure,Paw)、升主动脉血流量(ascending aorta blood flow,ABF)和心率(heart rate,HR),观察切除肾上腺后急性低氧对麻醉大鼠血流动力学的指标变化。结果常氧下肾上腺切除组的MAP、PAP、HR、ABF无明显变化。急性低氧过程中,对照组与肾上腺切除组的MAP、ABF、HR和体循环阻力(Toll resistance,TPR)均降低,PAP均增高(P<0.05),差异有显著性;肾上腺切除组的肺循环阻力(Pulmonary vascular resistance,PVR)升高(P<0.05);两组的LAP和Paw无明显变化。低氧对照组与对照组相比,则低氧对照组的MAP、ABF、TPR明显降低,PAP增高,差异有显著性。结论急性低氧刺激会使大鼠TPR降低,双侧肾上腺切除后会使大鼠的TPR进一步降低,且PVR升高。急性低氧过程中,肾上腺所分泌的内源性肾上腺素能在一定程度上抑制PAP的增高,可能是阻止机体发生低氧性肺水肿的机制。
关键词急性低氧内源性肾上腺素麻醉大鼠肺水肿机制
通信作者李筱玥(1989~),女,汉族,河北籍,青海大学医学院2012级科学班研究生.*:,教授,博士生导师,电话:0971-6109507.
※:国家自然科学基金资助(No.81160012),教育部新世纪优秀人才项目(No.NCET-12-1022),青海省自然科学基金项目(No.2012-Z-915Q),青海大学医学院中青年科研基金团队项目(No.2013-KT-4).
中图分类号R363
文献标识码识码A
DOI:10.13452/j.cnki.jqmc.2015.02.002
AbstractObjectiveTo investigate the protective mechanism of endogenous epinephrine for hypoxic pulmonary edema in anesthesia during acute hypoxia in rats.Methods SD rats were randomly divided into four groups:control group,adrenalectomy group,hypoxia control group and hypoxia adrenalectomy group(n=7).Using Power Lab biological signal collecting system under normoxia(20%O2,80%N2)and hypoxia(15%O2,85%N2)at the same time to detect the real-timely monitoring mean artery pressure (MAP),pulmonary artery pressure(PAP),left atrial pressure(LAP),central vein pressure(CVP),airway pressure(Paw),ascending aorta blood flow(ABF),heart rate(HR),respectively,and the index changes of acute hypoxia on hemodynamics in anesthetized rats were observed after excision of adrenal gland.Results MAP,PAP,HR andABF in adrenalectomy group had no obvious change.In the process of acute hypoxia,all of MAP,ABF,HR,toll resistance and TPR in the control group and adrenalectomy group were decreased,whereas the PAP increased and showed a significant difference(P<0.05).Pulmonary vascular resistance and the PVR in the adrenal gland resection group were increased(P<0.05);the two groups′ LAP and Paw had no obvious change.The hypoxial group′s MAP,ABF,TPR were significantly decreased.PAP in Hypoxia control group was increased compared with the control group,but the difference was significant.Conclusion Acute hypoxiacancan decrease the TPR in rats and adrenalectomy may further decrease the TPR and lead PVR increase.It shows that in acute hypoxia process,endogenous adrenaline secreted by the adrenal can inhibit the increase of pulmonary artery pressure in a certain extent,may be a protective mechanism for hypoxic pulmonary edema.
KeywordsAcuteHypoxiaEndogenous epinephrineAnesthesiaPulmonary edema
收稿日期2015-02-06
THE PROTECTIVE MECHANISM OF ENDOGENOUS
EPINEHYRINE FOR ANESTHETIZED HYPOXIC PULMONARY
EDEMA DURING ACUTE HYPOXIA IN RATS
Li Xiaoyue,Cai Qiujin,Zhang Huan,Liu Ruixin,Ji Qiaorong,Zhou Zhen,Zhang Wei*
(Qinghai University Medical College,Xining,Qinghai 810001,China)
急性高原病中以高原肺水肿(high altitude pulmonary edema,HAPE)和高原脑水肿(high altitude cerebral edema,HACE)较为多见,其中HAPE 的发病率高、危害性大[1],也是引起HACE的主要原因。HAPE是由于高原低压缺氧、寒冷、疲劳所诱发的以急性肺水肿为临床表现的一种严重危及生命的疾病[2]。因此对HAPE发病机制的研究具有重大意义。目前认为HAPE是肺动脉压(pulmonary artery pressure,PAP)过度升高而引起的一种漏出性水肿,但引起这种血流动力学改变的具体机制,以及缺氧时参与影响血流动力学的各种血管活性物质在HAPE的发生、发展过程中的具体作用并不清楚。Cannon曾提出应急学说[3-4],认为高原缺氧时对肺血管有直接收缩作用。Dagber[5]的动物实验证明了PAP增高在先,而肺水肿发生在后。PAP增高是发病的关键因素。本研究给予大鼠不同氧含量气体模拟平原和高原低氧环境,通过实时、动态监测并比较其血流动力学指标的变化,探讨急性低氧下麻醉大鼠的生理变化,了解交感肾上腺髓质系统对肺血流动力的影响作用,更好地解释其对HAPE的保护机制,为HAPE的预防和治疗提供可靠、切实的理论依据。
1材料与方法
1.1 动物
雄性SD大鼠40只,体重(350±30)g,由北京维通利华实验动物技术有限公司提供,许可证号:SCXK(京)2012-0001,NO.11400700064575。大鼠置于23 ℃、12:12昼/夜交替、无菌、自由采食水和食物的条件下饲养。
1.2 材料与试剂
自动调温加热垫(154 Huron Avenue Clifton,NJ 07013 USA);机械辅助呼吸机(950 North Hague Avenue Columbus,Ohio 43204-2121 U.S.A);超声血流仪(T420),超声血流探头(MA PR 2.5);压力传感器(MLT0380/A,Australia);PowerLab 16/35系统(AD Instruments,Castle Hill,Australia);聚乙烯导管(实验用聚乙烯导管,医用无毒级别,夏目制作所,东京,日本);制冰机(F100,USA)。
2.5%戊巴比妥钠(0.2mL/100g),上海泰瑞尔生物技术有限公司生产,批号:(071025);肝素生理盐水—效价为150的肝素粉,电子天平称取300 mg,溶于45 mL生理盐水制成浓度为1000 U/mL的肝素盐水,密封保存于4 ℃冰箱。药物购自Sigma化学公司。
1.3 方法
1.3.1实验分组方法
对照组(Normoxia control group):常氧下(20%O2,80%N2)输入生理盐水(N.S,4mL·kg-1·h-1)监测;肾上腺切除组(Normoxia adrenalectomy group):常氧下(20%O2,80%N2)切除双侧肾上腺后同时输入生理盐水(N.S,4mL·kg-1·h-1)监测;低氧对照组(Hypoxia control group):予低氧(15%O2,85%N2)5 min时输入生理盐水(N.S,4mL·kg-1·h-1)监测;低氧肾上腺切除组(Hypoxia adrenalectomy group):切除双侧肾上腺后予低氧(15%O2,85%N2)5 min时输入生理盐水(N.S,4 mL·kg-1·h-1)监测。
1.3.2术前准备方法
大鼠用2.5%戊巴比妥钠 (50mg/kg-1,i.p) 麻醉,仰卧放在一个自动调温加热垫上,将体温加热棒至于大鼠直肠中,使体温维持在37 ℃。调节呼吸机,呼吸频率70次/ min,潮气量7 mL/kg,呼气末正压2.5 cmH2O。实验期间人工通气的Paco2和Pao2分别为(35~40)mmHg、(100~110)mmHg。Paw通过载气线路上的T型管测量。每隔15 min,短时闭塞呼气线路,使呼气末压增加(2.5cmH2O)来防止吸收性肺萎缩。将压力传感器、聚乙烯导管内的气泡排空。
1.3.3手术方法
做颈部正中切口,分离右颈静脉后用聚乙烯导管(ID 0.8mm,OD 1.0mm)行插管术,导管进入约1.5 cm以测量中心静脉压(CVP);分离气管做气管插管(插管内径2mm);分离左颈总动脉行插管术,聚乙烯导管(ID 0.5mm,OD 0.8mm) 插入约2 cm测系统平均动脉压(MAP);左侧腹股沟处作约(1.0~1.5)cm切口,分离左股静脉后将聚乙烯导管(ID 0.5mm,OD 0.9mm) 插入约3 cm以给药和补液。沿胸部正中切开,电凝止血,分离升主动脉放置血流超声探头,测升主动脉血流量(ABF),测量期间用生理盐水淹埋探头。将聚乙烯导管(ID 0.5mm,OD 0.9mm) 插入到右心室并用固定夹固定以测量PAP;另一聚乙烯导管(ID 0.5mm,OD 0.8mm)插入左心房测量LAP,创面覆盖塑料膜进行检测。沿大鼠腹部正中作纵切口,切除双侧肾上腺。
1.3.4实验方法
将各组进行颈总动脉插管、颈外静脉插管、气管插管、左股静脉插管、右心室插管和左心房插管,实验过程中采用恒温加热板,体温恒定在37 ℃,实时、动态监测并记录MAP、CVP、PAP、Paw、ABF、LAP,HR根据所描记的动脉血压脉冲周期由Lab Chart软件计算,并以波形的形式记录(采样频率为200 Hz,Lab Chart 7)。
所有实验都在开胸的麻醉大鼠体上进行,经水银检压计校准,压力传感器校准后置于大鼠左心房的水平位置,实时、动态监测CVP、MAP、PAP、LAP、ABF、Paw。所有插管完成后,待各项描记指标稳定采集数据,给予刺激前数据记录为处理前数据,给予刺激后记录为处理后数据,分别描记在常氧和低氧条件下,对照组与肾上腺切除组各变量描记5 min的变化波形图及统计图,0 min记录为处理前数据,5 min记录为处理后数据。
TPR和PVR使用下列公式计算:
TPR=(MAP-CVP)/ABF
PVR=(PAP-LAP)/ABF
1.3.5统计学分析方法
采用统计软件StatView(5.0,SAS Institute Inc,Cary,NC)进行统计分析,数据用均数±标准差(±s)表示,显著性检验采用Fisher’ PLSD,即方差分析后的比较用LSD(least significance difference,最小显著差)法,检验水准α=0.05。
2结果
2.1 内源性肾上腺素调节麻醉大鼠在不同氧含量下血流动力学的作用(表1)
表1 内源性肾上腺素调节麻醉大鼠在不同氧含量下血流动力学的作用(±s)
Table 1 The hemodynamic effect of Endogenous adrenaline adjust anesthesia under different contents
of oxygen in rats(±s)
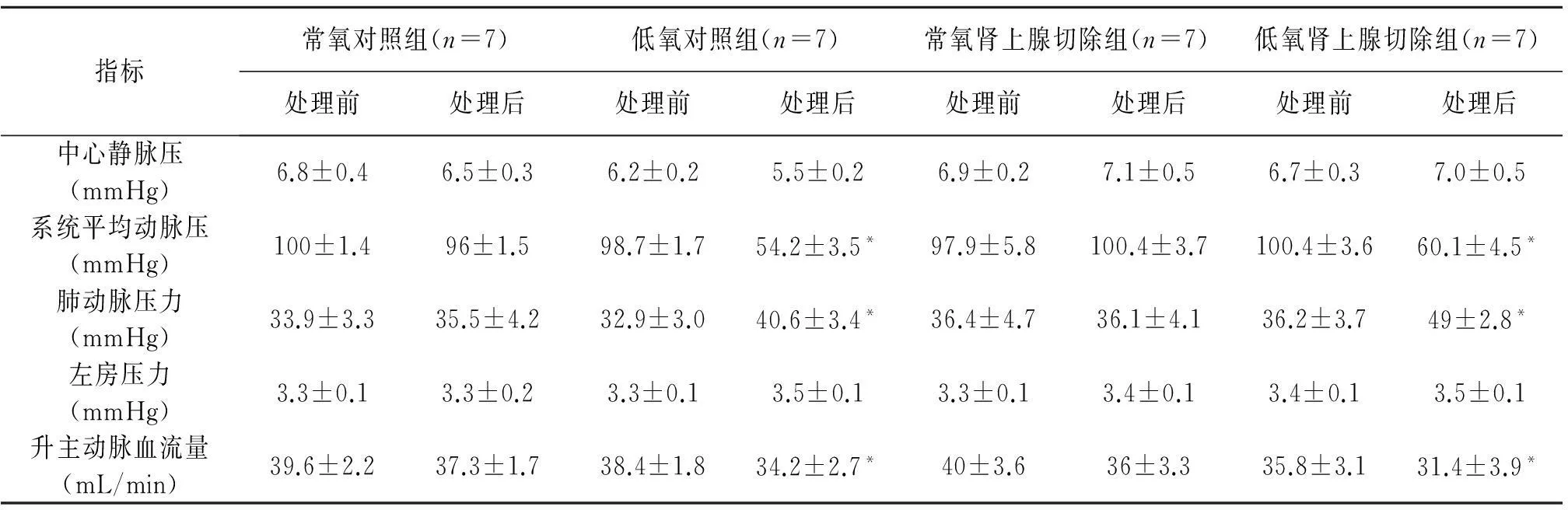
表1 内源性肾上腺素调节麻醉大鼠在不同氧含量下血流动力学的作用(±s)
指标常氧对照组(n=7)低氧对照组(n=7)常氧肾上腺切除组(n=7)低氧肾上腺切除组(n=7)处理前处理后处理前处理后处理前处理后处理前处理后中心静脉压(mmHg)6.8±0.46.5±0.36.2±0.25.5±0.26.9±0.27.1±0.56.7±0.37.0±0.5系统平均动脉压(mmHg)100±1.496±1.598.7±1.754.2±3.5*97.9±5.8100.4±3.7100.4±3.660.1±4.5*肺动脉压力(mmHg)33.9±3.335.5±4.232.9±3.040.6±3.4*36.4±4.736.1±4.136.2±3.749±2.8*左房压力(mmHg)3.3±0.13.3±0.23.3±0.13.5±0.13.3±0.13.4±0.13.4±0.13.5±0.1升主动脉血流量(mL/min)39.6±2.237.3±1.738.4±1.834.2±2.7*40±3.636±3.335.8±3.131.4±3.9*

续表:
注:*,vs常氧对照组比较,P<0.05.
表1显示,在低氧刺激下未切除双侧肾上腺的大鼠MAP、ABF、HR、TPR均降低,PAP升高(P<0.05);且急性低氧过程中切除大鼠双侧肾上腺后MAP、ABF、HR均明显下降,PAP显著性升高(P<0.05)。常氧下切除大鼠双侧肾上腺前后指标变化,与对照组相比无显著差异。
2.2 不同氧含量下对照组及肾上腺切除组PowerLab波形描记图(图1)


图1 不同氧含量下对照组及肾上腺切除组PowerLab波形描记图
图1示,常氧下肾上腺切除组各指标与对照组相比无明显变化;急性低氧过程中,对照组和肾上腺切除组大鼠MAP、ABF和HR均明显下降,PAP明显升高。
2.3 急性低氧过程中对照组与肾上腺切除组各指标统计图(图2)
图2示,低氧刺激下对照组和ADX组MAP、ABF、HR、TPR均明显降低,PAP均升高。其中ADX组的PVR受ABF降低的影响逐渐升高(P<0.05),其余变量无统计学意义。

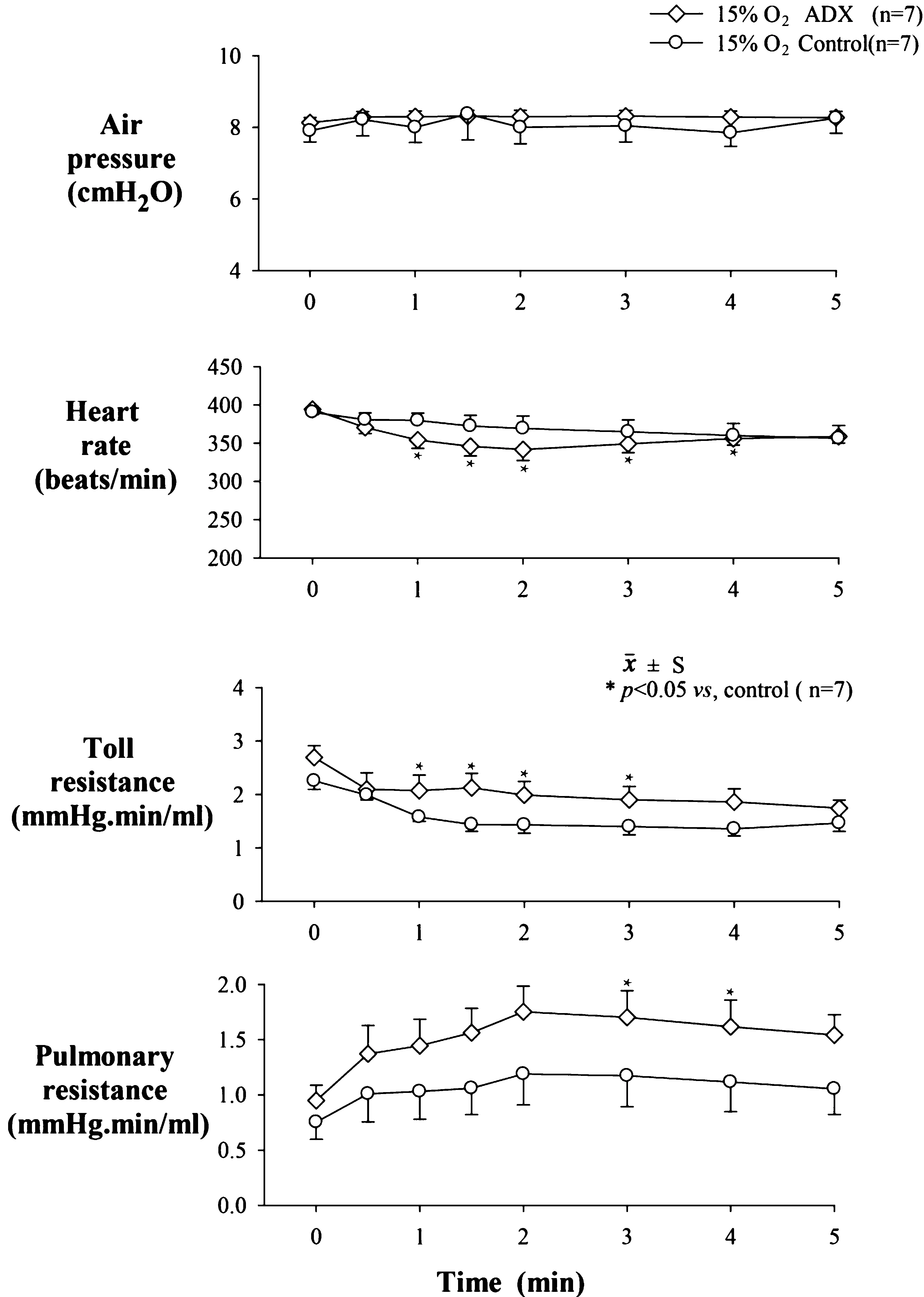
图2 急性低氧过程中对照组与肾上腺切除组各指标统计图
3讨论
本研究旨在探讨急性低氧过程中内源性肾上腺素对麻醉大鼠低氧性肺水肿的保护机制。有以下发现,第一,以往研究发现急性或慢性低氧应激都能够有效激活下丘脑-垂体-肾上腺轴(hypothalamicpituitary-adrenal axis,HPA)[6],进而引起一系列代谢改变,如血压升高、心率增快、各脏器血流灌注减少等[7]。如图1~2所示低氧组的MAP和HR均明显降低,说明急性低氧使细胞生成的大量乳酸及NO等扩血管物质所引起的外周血管扩张和回心血量减少等扩血管效应占优势,或是可能与动物经全身麻醉后对低氧刺激的敏感性降低,儿茶酚胺量并没有大量分泌有关。同时贾司光认为[8]急性严重缺氧时出现的心率减慢,血压降低是交感神经占优势转为迷走神经活动占优势所致。另有研究表明,低氧刺激会使大鼠MAP降低[9-10],这与本实验结果相符。第二,急性低氧时肾上腺切除组的PAP和PVR均明显增高且高于低氧对照组,TPR较低氧对照组低(P<0.05)。说明内源性肾上腺素在低氧刺激时可降低PAP,使PVR降低,TPR升高从而起到一定保护作用。同样,常氧下肾上腺切除后,大鼠的各项指标均无显著性变化,但在急性低氧中,由于阻断了内源性肾上腺素的来源导致大鼠的MAP、HR、ABF明显下降,PAP升高,进一步证实内源性肾上腺素在急性低氧过程中的重要作用。
近年来研究表明[11],机体缺氧直接引起的肺小动脉收缩及血管内皮的损伤,是 HAPE发生的基本原因。由于HAPE的发病机制较为复杂,但与低氧刺激有直接关系,急性缺氧可使外周血管收缩、回心血量和肺血流量增加,随着肺小动脉不均匀性收缩使局部小动脉痉挛,血流量减少,而其他肺血管收缩较轻的区域则血流量增加,微循环内液体漏出[7],从而导致毛细血管内压增高出现间质性肺水肿和肺泡水肿。此外,低氧可引起血液生理性的处于高凝状态,局部血流阻力增大加重肺动脉高压[12]。其次PVR的升高和TPR的降低与HAPE有密切关联,如图1~2所示,低氧组的TPR降低,PVR和PAP均升高(P<0.05),同时肾上腺切除组较对照组升高明显(P<0.05),是由于低氧刺激和阻断了β-AR的综合效应,由于肺血管上表达α和β两种肾上腺素受体,调节肺血管舒缩及发育过程中肺血管的形成,在肺循环系统中,β-AR作用占优势,有利于肺血管舒张并且抑制平滑肌增殖[13]。因此,就目前的研究而言,表明β-肾上腺素在一定程度上可以降低肺动脉压力,以此保护机体防止发生低氧性肺水肿。临床上关于预防和治疗HAPE的药物,主要是α1-肾上腺素阻滞剂,研究显示尤其硝普钠可以缓解低氧性肺动脉高压[14],另外还有前列环素类、5型磷酸二酯酶抑制剂、内皮素受体拮抗剂等治疗药物,但关于β-肾上腺素的应用未见报道。急性低氧刺激会使大鼠TPR降低,双侧肾上腺切除后会使大鼠的TPR进一步降低,且PVR升高。急性低氧过程中,肾上腺所分泌的内源性肾上腺素能在一定程度上抑制PAP的增高,可能是阻止机体发生低氧性肺水肿的机制。
综上所述,本研究全程在LabChart上实时、动态描记,更加真实全面地观察不同氧含量下对照组和肾上腺切除组的血流动力学变化,发现急性低氧下两组大鼠血压和心率均明显下降,可能是由于大鼠在此过程中机体出现失代偿,交感神经活动被抑制有关。另外交感-肾上腺素作为一个重要因素存在于急性高原病发生发展中,能够降低肺动脉压,避免发生低氧性肺水肿。
参考文献
[1]Stream JO,Grissom CK.Update on high-altitude pulmonary edema:pathogenesis,prevention,and treatment[J].Wilderness Environ Med,2008,19(4):293-303.
[2]陈有,牟信兵,高钰琪.高原肺水肿发病机制研究进展[J].高原医学杂志,2005,15(2):62.
[3]Marlowe W.Eldridge,Ruedi K,et al.Effects of altitude and exercise on pulmonary capillary integrity:evidence for subclinical high-altitude pulmonary edema[J].J Appl Physiol,2006,100:972.
[4]乔人立,刘双.急性高山病的预防与治疗[J].国际呼吸志,2007,27(16):1276.
[5]Dagber G J.Mechanism of Pulmonary by Hypertension in acute hypoxia[J].J Thor Cardiovasc Surg,1961,42:473.
[6]Mueller N K,Dolgas C M,Herman J P.Stressor-selective role of the ventral subiculum in regulation of neuroendocrine sress responses[J].Endocrinology,2004,145(8):3763-3768.
[7]Segawa H,Mori K,Kasai K,et al.The role of the phrenic nerves in stress response in upper abdominal surgery[J].Anesth Analg,1996,82(6):1215-1224.
[8]贾司光,杨天德,张宝兰,等.人体急性缺氧型循环功能代谢障碍[J].中国应用生理学杂志,1985,1(3):159-165.
[9]James P,Mendoza.Role of nitric oxide-containing factors in the ventilatory and cardiovascular responses elicited by hypoxic chanllenge in isoflirance-anesthetized rats[J].J Appl Physiol,2014,116:1371-1381.
[10]Huang KL,Wu CP,Kang BH,et al.Chronic hypoxia attenuates nitric oxide-dependent hemodynamic responses to acute hypoxia[J].J Biomed Sci,2002,9:206-212.
[11]Hulgren HN.High altitude pulmonary edema:hemodynamic aspects[J].Int J Sports Med,1997,18(1):20-25.
[12]任雨笙,崔芳.高原肺水肿患者凝血纤溶系统的变化[J].中国病理生理杂志,2004,20(3):432-436.
[13]王虹,解卫平.α-1肾上腺素受体与肺动脉高压[J].国外医学内科学分册,2001,28(6):244-252.
[14]岑维浚,陈诗泉,李建民,等.应用硝酸钠治疗急性高原肺水肿[J].中华内科杂志,1991,30 (7):412-414.