低氧下Crocin联合顺铂对人胃癌BGC-823细胞增殖的影响*
骆玉霜,格日力,沈存芳,李 燕,范宝华
(1.青海大学高原医学研究中心,青海 西宁 810001;2.青海大学附属医院肿瘤内科,青海 西宁 810001)
低氧下Crocin联合顺铂对人胃癌BGC-823细胞增殖的影响*
骆玉霜1,2,格日力1△,沈存芳2,李燕2,范宝华2
(1.青海大学高原医学研究中心,青海 西宁 810001;2.青海大学附属医院肿瘤内科,青海 西宁 810001)
摘要目的探讨藏红花素联合顺铂(Crocin+DDP)低氧下对人胃癌细胞增殖的影响。方法实验分对照组、C1组、C2组、Z1组、Z2组、C1+Z1组、C1+Z2组、C2+Z1组、C2+Z2组。在低氧环境下培养人胃癌BGC-823细胞,经Crocin、DDP处理后,采用高倍显微镜观察细胞形态变化;各组药物处理胃癌BGC-823细胞后,利用MTT检测细胞增殖情况。结果1)从形态学观察,2%低氧下BGC-823细胞大量死亡,5%低氧下数量减少,MTT示:低氧下48 h BGC-823细胞OD值低于常氧下。2)低氧下DDP处理BGC-823细胞后从形态学观察:细胞固缩、细胞数量减少。MTT示:低氧条件下C1、C2抑制率(分别为30.2%、52.7%)低于在常氧下抑制率(分别为34.9%、59.4%),P<0.01。3)从形态学观察,常氧下16 mg/mL以下Crocin作用BGC-823细胞后,细胞形态无明显改变,而在低氧下数量增多。MTT示:在低氧下Z2组OD值为0.657±0.038,与低氧对照组(OD值0.554±0.028)比较,存活的细胞增多,P<0.01。4)MTT示:5%低氧下C1+Z1组作用BGC-823细胞48 h,其抑制率为34.7%,与C1组(30.2%)比较,抑制率下降;C1+Z2组抑制率为22.3%,与C1组比较,抑制率下降,P<0.05。C2+Z1组作用BGC-823细胞48 h,抑制率(37.2%)与C2组(52.7%)比较,抑制率下降,P<0.01;C2+Z2组抑制率(51.4%)与C2组比较,抑制率下降。结论1)低氧抑制BGC-823的细胞增殖,低氧可能增加BGC-823细胞对DDP的耐药性。在低氧条件下,一定浓度的Crocin对BGC-823细胞可能起保护作用,抑制DDP对BGC-823细胞抗增殖能力。
关键词藏红花素顺铂细胞增殖低氧BGC-823细胞
项目基金*:青海省科技厅科研(2014-ZJ-737),青海大学附属医院中青年科研 (ASRF-2014-22)
骆玉霜(1972~),女,汉族,河南籍,主任医师.△:通迅作者,E-mail:geriligao@hotmail.com
中图分类号R735
文献标识码识码A
DOI:10.13452/j.cnki.jqmc.2015.02.004
AbstractObjectiveTo investigate the effect of Crocin combining with cisplatin on the proliferation of gastric cancer BGC-823 cells under hypoxia.Methods Microscope was used to observe morphological changes of BGC-823 cells after cultured with different concentrations of crocin or cisplatin.Anti-proliferation effect was detected by MTT assay.The trial was set up control group,C1 group(0.8μg/mL DDP),C2 group(1.6μg/mL DDP),Z1 group(8mg/mL Crocin),Z2 group(16 mg/mL Crocin),C1+Z1 group,C1+Z2 group,C2+Z1 group and C2+Z2 group.Results 1)Morphologically,a large number of BGC-823 cell deaths were observed after 48 h culture in hypoxic(2% O2)condition.A reduction of the amount of cells was observed after 48 h culture in hypoxic(5% O2)condition.The OD value in hypoxia measured by MTT assay was lower than that in normoxia.2)Pyknosis and significant reduction of the amount of BGC-823 cells were observed after being treated by DDP in hypoxia.The inhibitory rates of C1 group and C2 group under hypoxia were 30.2% and 52.7% respectively,which were lower than those under normoxia(34.9%,59.4%),P<0.01.3)Few alterations of BGC-823 cell morphology were observed after being treated by crocin with concentration below 16 mg/mL under normoxia.The OD value of BGC-823 cells treated by Z2 group was 0.657±0.038,which was higher than that of control group(0.554±0.028)under hypoxia,P<0.01.4)The inhibitory rate of C1+Z1 group was 30.2%,which was lower than that of C1 group;the inhibitory rate of C1+Z2 group was 22.3%,which was lower than that of C1 group(P<0.05)under hypoxia.The inhibitory rate of C2+Z1 group was 50.7%,which was lower than that of C2 group,P<0.01;the inhibitory rate of C2+Z1 group was 51.4%,which was lower than that of C2 group under hypoxia.Conclusions Hypoxia inhibits proliferation of BGC-823 cell and increases drug-resistance to DDP.Crocin protects BGC-823 cells from the ability of DDP on anti-proliferation and anti-apoptosis under hypoxia.
KeywordsCrocinCisplatin(DDP)Cell proliferationHypoxiaBGC-823 cell
收稿日期2015-01-06
THE EFFECT CROCIN COMBINING WITH CISPLATIN
ON PROLIFERATION OF GASTRIC CANCER BGC-823
CELLS UNDER HYPOXIA
Luo Yushuang1,2,Ge Rili1△,Shen Cunfang2,Li Yan2,Fan Baohua2
(1.Research Center for High Altitude Medicine,Qinghai University School of Medicine,Xining,810001;
2.Department of oncology,Affiliated hospital of Qinghai university,Xining 810001,China)
全身化疗是晚期胃癌患者的主要治疗措施。其中顺铂(Cisplnt,DDP)为最常用的化疗药物。到目前为止,由于耐药所致,晚期胃癌的化疗有效率仍然在50%左右。
由于多数中药具有多靶点作用的特点,作为肿瘤多药耐药逆转剂较化学逆转剂有很大的优越性。研究发现,藏红花素(Crocin)不仅可增强低氧耐受,而且对多种肿瘤细胞有抑制作用[1-5]。但Crocin在低氧环境下对肿瘤细胞抑制作用及机制不明。
我们的研究拟证实:Crocin可改善肿瘤细胞低氧环境,增加DDP抗肿瘤作用。
1材料与方法
1.1 主要药品与试剂选择
Crocin、PDD(Sigma公司);人胃癌细胞株BGC-823(中科院细胞库);RPMI-1640培养基(Hyclone);胎牛血清(Gibco);MTT粉(上海生物工程技术服务有限公司);二甲亚砜(dimethyl sulfoxide,DMSO,Sigma)。
1.2 Crocin溶液的配制
将1000 mg Crocin粉末溶于20 mL PBS(0.01mol/L、pH=7.2)中,并加入62.5 mg EDTA配成贮存液,4 ℃保存。以PBS稀释至应用浓度。
1.3 细胞培养
将人胃癌BGC-382细胞放入含10%胎牛血清和1%双抗的RPMI-1640培养基,并置于细胞培养箱(37℃、5%CO2,饱和湿度)培养。每天观察细胞生长情况,2~3 d换液一次。当细胞生长达到铺满70%~80%时,以0.25%胰蛋白酶消化,通常按照1:3~1:5的比例传代,每周传代两次,当细胞传至8~10代时进行实验。细胞低氧环境培养采用美国Queue多气体细胞培养箱,N2调节孵箱内O2分压,使O2分压为2%~5%、CO2分压为5%。
1.4 高倍显微镜观察细胞形态变化
在常氧、低氧下,在BGC-823细胞中加入不同浓度的Crocin、DDP并作用48 h后,使用高倍倒置显微镜观察BGC-823细胞形态特点并拍照。
1.5 细胞增殖抑制率测定
取对数生长期的细胞以3×107/L的密度接种于96孔培养板,每孔体积为200 μL,待细胞贴壁后分别加入Crocin(浓度2、4、8、10、20mg/L)、DDP(浓度0.2、0.4、0.6、0.8、1.0、2.0、3.0μg/mL),并设阴性对照组(细胞正常生长组),每个浓度组设5个复孔,四周加入不含药物的细胞培养液作空白对照。培养48 h后,每孔加入5 g/L的MTT溶液20 μL,继续培养4 h,轻轻吸尽上清液,每孔加入DMSO 150 μL,振荡10 min,在酶标仪上490 nm波长处测每孔的吸光度(A)值,并取5孔的平均值,细胞生长抑制率=(对照孔A值-实验孔A值)/对照孔A值×100%。本实验重复3次,最终取平均值。
1.6 实验分组
根据Crocin、DDP作用48 h的半数抑制浓度IC50及Crocin母液的浓度,实验分组:1)对照组(Control);2)C1(0.8μg/mL DDP)组;3)C2(1.6μg/mL DDP)组;4)Z1(8mg/mL Crocin)组、Z2(16 mg/mL Crocin)组、C1+Z1(0.8μg/mL DDP+8mg/mL Crocin)组、C1+Z2(0.8μg/mL DDP+16mg/mL Crocin)组、C2+Z1(1.6μg/mL DDP+8mg/mL Crocin)组、C2+Z2(1.6μg/mL DDP+16mg/mL Crocin)组。
1.7 统计学处理
用统计软件SPSS17.0分析,计量资料以均数±标准差(±s),各组间比较采用单因素方差分析,同一药物浓度下两组间比较采用两样本均数比较t检验,以P<0.05表示显著性差异。
2结果
2.1 低氧48 h对胃癌BGC-823细胞增殖的影响
倒置显微镜下观察BGC-823细胞形态:细胞成簇生长,量多密集,细胞大小基本一致(图1)。2%低氧下BGC-823细胞大量死亡,以培养的293T细胞和L929细胞作为参考,生长基本正常;5%低氧下培养的BGC-823细胞数量有所减少(图2)。MTT示:低氧48 h BGC-823细胞OD值(0.554±0.028)与常氧48 h OD值(0.694±0.043)相比存活细胞减少,P<0.01(表1)。提示:低氧抑制BGC-823细胞增殖。
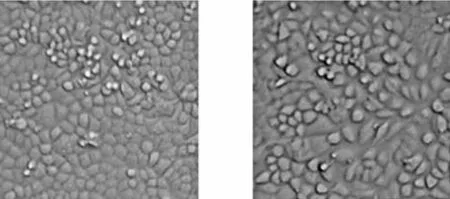
常氧5%低氧
图1常氧、5%低氧对BGC-823细胞增殖的影响图
Figure 1BGC-823 cell proliferation under hypoxia(5% O2)and normoxia

L929 293T BGC-823
2.2 低氧条件下顺铂对胃癌BGC-823增殖的影响
常氧下DDP作用BGC-823 48 h的IC50为1.634 μg/mL。从倒置显微镜下观察,低氧下DDP处理BGC-823细胞48 h后的细胞数量明显减少,细胞固缩(图3)。MTT示:在低氧条件下C1、C2抑制率(分别为30.2%、52.7%)高于低氧对照组(20.8%),差异均有统计学意义(P<0.01,表2),低氧条件下C1、C2抑制率低于在常氧下抑制率(分别为34.9%、59.4%)(P<0.01,表1)。提示:低氧可能增加BGC-823细胞对DDP的耐药性。

表1 Crocin对BGC-823细胞的增殖抑制率
※:与低氧对照组比较,P<0.01;▲:与C1组比较,P<0.01.

图3 低氧下顺铂对BGC-823增殖的影响图
2.3 Crocin在低氧条件下对BGC-823细胞增殖的影响
常氧下Crocin作用BGC-823 48 h的IC50为28.129 mg/mL。从倒置显微镜下观察,在低氧下Crocin(8、16mg/mL)作用BGC-823细胞48 h后,BGC-823细胞数量无明显减少,细胞形态无明显改变,细胞体积大小基本一致(图4~5)。MTT示(表2):在低氧下,加入Crocin 16 mg/mL 48 h即刻OD值为0.657±0.038,与低氧对照组(OD 0.554±0.028)比较,存活的细胞增多,P<0.05。提示:在低氧下一定浓度Crocin可能对BGC-823细胞有一定保护作用。

Crocin 8 mg/mLCrocin 16 mg/mL
图4常氧下Crocin作用于BGC-823细胞的影响(×20)
Figure 4Effect of Crocin on BGC-823 cells proliferation under normoxia(×20)
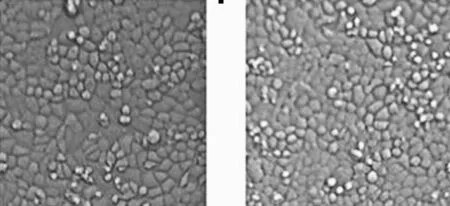
Crocin 8 mg/mL Crocin 16 mg/mL
2.4 Crocin联合DDP在低氧下对BGC-823细胞增殖的影响
5%低氧下C1+Z1组作用BGC-823细胞48 h,其抑制率为34.7%,与C1组(30.2%)比较,抑制率下降;C1+Z2组抑制率为22.3%,与C1组比较,抑制率下降,P<0.01。C2+Z1组作用BGC-823细胞48 h抑制率为37.2%,与C2组(52.7%)比较,抑制率下降,P<0.01;C2+Z2组抑制率51.4%,与C2组比较,抑制率下降但无统计学意义(表2)。提示:在低氧条件下一定浓度的Crocin对BGC-823细胞可能起保护作用,从而抑制DDP对BGC-823细胞的杀伤作用。

表2 DDP联合Crocin低氧下对BGC-823细胞48h的增殖抑制率
※:与低氧对照组比较,P<0.01;▲:与C1组比较,P<0.01;★:与C2组比较,P<0.01;◆:与Z1组比较,P<0.01;●:与Z2组比较,P<0.01;■:与C1+Z1组比较,P<0.01;*:与C1+Z2组比较,P<0.01;#:与C2+Z1组比较,P<0.01.
3讨论
低氧是人类和动物肿瘤的共同特征,它是肿瘤发展过程中所必须经历的环境条件之一。由于肿瘤细胞存在对缺氧的自身调节和适应,短时间的低氧可促进细胞增殖,抑制细胞凋亡,但持续缺氧可以促进细胞凋亡[6]。事实上,低氧对不同肿瘤细胞株增殖、凋亡的敏感性不同。Horiuchi等[7]的研究结果显示缺氧对卵巢癌细胞株细胞数目影响不明显。张亚莉[8]的研究结果显示低氧处理HL-60细胞后,生长却明显受抑制。我们的研究显示,BGC-823细胞置2%低氧下48 h 时大量死亡,5%低氧作用48 h时OD值低于常氧下值。提示:BGC-823细胞增殖对低氧比较敏感。
现研究发现[9],缺氧处理肿瘤细胞对于许多化疗药存在抵抗。目前公认[10]的机制主要有以下四种:1)环磷酰胺、铂类、多柔比星等是氧依赖性的化疗药物,其在细胞内生成自由基,夺获电子然后传递给氧,从而对肿瘤细胞起杀伤作用。2)缺氧通过对肿瘤细胞基因组和蛋白组表达的调控,可以诱导基因突变,增加基因不稳定性和异质性,进而导致耐药。3)肿瘤缺氧通常伴随血液流变学的异常,随着弥散距离的增加,有些药物在半衰期内无法从血管弥散到肿瘤细胞,肿瘤局部药物浓度低,使肿瘤细胞免遭破坏。4)缺氧的细胞远离血管,远离血管的肿瘤细胞逃离了药物的作用。我们的研究显示,从倒置显微镜下观察,常氧下DDP处理BGC-823细胞48 h后的细胞数量明显减少,细胞固缩。随着DDP浓度的增加,其对BGC-823细胞抑制增殖作用增强。低氧条件下1.6 μg/mL DDP处理BGC-823 48 h即刻,其抑制率低于在常氧下抑制率(P<0.01)。提示:低氧可能增加BGC-823细胞对顺铂的耐药性。
Crocin的细胞保护作用在近年来备受争议。现已有研究表明,Crocin能有效抑制活性氧自由基的产生及黄呤氧化酶的活性,表现出抗氧化生物活性。其多种药学作用可能与此相关,如延长低氧小鼠的存活时间[11],保护低氧心肌细胞[12],抑制化疗药物引起的肝损伤[13]等。丁雯雯[14]等研究显示,适宜浓度的Crocin可显著增强体外造血干祖细胞集落形成,对造血干祖细胞具有保护作用。Crocin通过提高超氧化物歧化酶(Superoxide dismutase,SOD)、谷胱甘肽过氧化物酶(glutathione peroxidase,GSH-px)及过氧化氢酶(catalase CAT)抗氧化酶的活性,减轻了顺铂对小鼠肝肾的氧化损伤,对顺铂引起的小鼠急性肝肾毒性具有良好的保护作用[15]。
我们的研究显示,BGC-823细胞加入Crocin在低氧下作用48 h,其OD值增加,且随着Crocin浓度增高而增加。5%低氧下Crocin联合DDP作用BGC-823细胞,其抑制率明显低于单用DDP(P<0.05),且随Crocin浓度的增加,细胞的抑制率下降。提示:在低氧条件下一定浓度的Crocin对BGC-823细胞可能起保护作用,抑制DDP对BGC-823细胞的杀伤作用。但还需体内、体外实验进一步验证。这也是首次发现Crocin在低氧下对部分肿瘤细胞可能起保护作用。是否低氧下Crocin通过抗氧化生物活性对BGC-823细胞产生保护作用需进一步证实。
参考文献
[1]赵培,罗春丽,吴小候,等.Crocin对人膀胱移行细胞癌T24细胞裸鼠移植瘤的实验研究[J].中国组织化学与细胞化学杂志,2008,17(3):308-312.
[2]Noureini SK,Wink M.Antiproliferative effects of crocin in HepG2 cells by telomerase inhibition and hTERT down-regulation[J].Asian Pac J Cancer Prev,2012,13(5):2300-2309.
[3]Sun J,Xu XM,Ni CZ,et al.Crocin inhibits proliferation and nucleic acid synthesis and induces apoptosis in the human tongue squamous cell carcinoma cell line Tca8113[J].Asian Pac J Cancer Prev,2011,12(10):2679-2683.
[4]王新星,于正洪,侍述璟,等.Crocin对人肺腺癌SPC-A1细胞的增殖抑制作用及机制研究[J].临床肿瘤学杂志,2013,18(4):295-299.
[5]夏丹,孟琴,杨晓庆.Crocin诱导卵巢癌细胞凋亡的体外实验[J].临床与实验病理学杂志,2011,29(5):535-539.
[6]胡艳红,李晓明.低氧对人喉癌Hep-2细胞增殖及凋亡的影响[J].临床耳鼻咽喉头颈外科杂志.2014,28(12):817-873.
[7]Horiuchi A,Imai T,Shimizu M,et al.Hypoxia induced changes in the expression of VEGF,HIF-1α pha and cell cycle-related molecules in ovarian cancer cells[J].Anticancer Res,2002,22:2697-2702.
[8]张亚莉,徐琳,邱健.低氧对人白血病细胞株HL-60细胞增殖及HIF-1α表达的影响[J].南方医科大学学报.2011,31(11):1890-1894.
[9]Francis P,Namløs HM,Müller C,et al.Diagnostic and prognostic gene expression signatures in 177 soft tissue sarcomas:hypoxia-induced transcription profile signifies metastatic potential[J].Bmc Genomics,2007,8:73-89.
[10]何凌,朱付凡,刘毅智.缺氧与肿瘤化疗耐药关系研究[J].肿瘤药学,2011,1(5):409-413.
[11]余国禧,陈素燕.藏红花对缺氧模型小鼠的保护作用研究[J].中药材,2006,29(6):590-591.
[12]吴杨,潘瑞蓉,王玉琴,等.Crocin对大鼠缺氧心肌的保护作用及其机制研究[J].中国循环杂志,2011,26(1):61-64.
[13]杨春潇,李丽丽,席烨,等.藏红花对CCL4致小鼠急性肝损伤的保护作用[J].现代中医药,2009,29(2):64-65.
[14]丁雯雯,王文华,孙立荣.Crocin对骨髓造血干-祖细胞集落形成的影响[J].齐鲁医学杂志,2013,28(4):346-348.
[15]孙研.Crocin对顺铂致小鼠急性肝、肾损伤的保护作用及其机制研究[D].博士学位论文,青岛大学,2014.

