正交实验优选益视口服液纯化工艺
·方药研究·
正交实验优选益视口服液纯化工艺
陈亚龙,李昭,曹林林,王兴海,王露,郭东艳*
(陕西中医药大学,陕西 咸阳 712046)
摘要:目的考察壳聚糖澄清剂用于益视口服液的纯化工艺。方法以益视口服液中2,3,5,4’-四羟基二苯乙烯-2-O-β-D-葡萄糖苷的转移率及干膏率为考察指标,采用L9(34)正交试验设计,优选壳聚糖絮凝沉降法的纯化工艺条件;并对纯化前后药液的黏度、浊度、蛋白质及鞣质含量进行测定。结果壳聚糖絮凝沉降法的最佳条件是药液质量浓度是1.0 g/mL,壳聚糖的加入量为30%,药液pH 4,温度是40 ℃,经纯化后黏度、浊度、蛋白质及鞣质含量均有所下降。结论壳聚糖絮凝沉降法可用于益视口服液的纯化。
关键词:壳聚糖;益视口服液;纯化工艺;二苯乙烯苷;干膏率
DOI:10.13463/j.cnki.cczyy.2015.06.006
中图分类号:R284.1文献标志码:A
文章编号:2095-6258(2015)06-1115-04
基金项目:陕西省重大科技创新项目(2011ZKC08-1)。
作者简介:陈亚龙(1967-),男,硕士,副教授,主要从事中医肾病临床及新药研究。
收稿日期:(2015-07-06)

*通信作者:郭东艳,女,博士,教授,电话-13992090011
Optimization of The Chitosan Purification Process of Yishi Oral Solution by Orthogonal Test
CHEN Yalong, LI Zhao,CAO Linlin,WANG Xinghai,WANG Lu,GUO Dongyan*
(Shanxi University of Traditional Chinese Medicine, Xianyang 712046, Shanxi Province, China)
Abstract:ObjectiveTo investigate purification technology of Yishi Oral liquid with chitosan as clarification agent. MethodThe transfer rate of 2,3,5,4’-styrene-4-hydroxy -2-O-β-D-glycosidase and extraction rate as indexes,the best purification process conditions of chitosan flocculation settlement method were optimized by using L9(34) orthogonal experiment design,and the viscosity, turbidity, the content of protein and tannin were determinated before and after purification liquid. ResultOptimum purification process of chitosan flocculation sedimentation method was:the mass concentration of liquid1.0 g/mL,the addition amount of chitosan 30%,pH 4 at 40 ℃.The viscosity, turbidity , the content of protein and tannin were decreased after purification. ConclusionChitosan flocculation settlement method can be used for purification of Yishi Oral Solution.
Keywords:chitosan;Yishi oral solution;purification process;stilbene glycosidee;extraction rate
益视口服液是由部颁标准收载品种益视颗粒(WS3-B-3307-98)改剂型而来,由党参、当归、五味子(蒸)、山药、制何首乌、金樱子、覆盆子、厚朴(姜制)、木香、白术(焦)、山楂(焦)、石楠叶、菟丝子、六神曲(焦)等药味组成,具有滋肾养肝、健脾益气、调节视力的作用,临床上主要用于治疗肝肾不足、气血亏虚引起的青少年近视及视力疲劳[1]。方中何首乌能补肝肾、益精血, 其有效成分二苯乙烯苷(2,3,5,4’-四羟基二苯乙烯-2-O-β-D-葡萄糖苷) 是其药效物质基础之一,也是制剂质量控制中常用的指标成分[2]。近年来,壳聚糖絮凝沉降法用于中药提取液的纯化显示出了较好的效果[3-5]。因此本实验拟采用L9(34)正交试验设计,以二苯乙烯苷及干膏得率为评价指标,优选壳聚糖絮凝的最佳工艺条件。
1实验材料
1.1仪器Agilent1260高效液相色谱仪(DAD检测器,ChemStation for LC 3D systems);530低速离心机(湖南赛物湘离心机仪器有限公司);PTF-A500电子天平(福州华志科学仪器有限公司);BROOKFIELD博力飞DV-I+黏度计(美国);WGZ-3P浊度计(上海昕瑞仪器仪表有限公司);UV1102紫外/可见分光光度计(上海);GB204电子分析天平(瑞士);SHZ-B恒温振荡器(天津);AL204电子天平(梅特勒-托利多仪器(上海))。1.2药材与试剂试验用饮片由陕西昊源中药饮片有限公司提供,经检验均符合《中国药典》2010年版1部各饮片项下有关规定。 牛血清蛋白(BSA)(北京典博星生物技术有限责任公司,批号:120330);考马斯亮蓝G-250(上海西宝生物科技有限公司,20130506);皮粉(含铬)(上海迈坤化工有限公司,批号:20140224);色谱乙腈(Honeywell);色谱甲醇(MREDA);水为娃哈哈纯净水;2,3,5,4’-四羟基二苯乙烯-2-O-β-D-葡萄糖苷对照品(中国食品药品检定研究院提供,批号:110844-201109,供含量测定用);壳聚糖(国药集团化学试剂有限公司,批号:20121112)。
2 方法与结果
2.12,3,5,4’-四羟基二苯乙烯-2-O-β-D-葡萄糖苷的含量测定2.1.1色谱条件色谱柱:Thermo DBS-C18分析柱(250 mm×4.6mm,5 μm),流动相:水-乙腈(85∶15),柱温:20 ℃,检测波长:320 nm,在此条件下,2,3,5,4’-四羟基二苯乙烯-2-O-β-D-葡萄糖苷的峰与其他峰达到基线分离,不干扰含量测定。2.1.2对照品溶液的制备取2,3,5,4’-四羟基二苯乙烯-2-O-β-D-葡萄糖苷对照品适量,精密称定,加稀乙醇制成每l mL含0.2 mg的溶液,即得。2.1.3水提液的制备按处方比例称取党参、当归、五味子、山药、制何首乌、金樱子、覆盆子、厚朴(姜制)、木香、白术(焦)、山楂(焦)、石楠叶、菟丝子、六神曲(焦)14味药,加入10倍量水提取2 次(第1次2 h,第2次1 h),过滤,合并滤液,浓缩至1.0 g/mL,即得水提液,备用。2.1.4标准曲线的绘制精密吸取2,3,5,4’-四羟基二苯乙烯-2-O-β-D-葡萄糖苷对照品溶液0.5、1.0、2.0、4.0、8.0、10.0 μL,注入高效液相色谱仪,测定峰面积,以对照品含量为横坐标,峰面积为纵坐标,进行线性回归。结果2,3,5,4’-四羟基二苯乙烯-2-O-β-D-葡萄糖苷在0.1 ~2.0 μg范围内有较好的线性关系。2.1.5重复性试验按2.1.3项下方法制备水提液,稀释至适宜浓度,共5组,测定含量,记录峰面积,计算RSD值。结果RSD为2.10%,表明该方法的重现性良好。2.1.6精密度试验取水提液,稀释至适宜浓度,重复测定5次,记录峰面积,计算RSD值。结果RSD为1.12%,表明仪器精密度良好。2.1.7稳定性试验取水提液,稀释至适宜浓度,分别在0、2、4、8、12 h测定其含量,记录峰面积,计算RSD值。结果RSD为1.01%,表明该供试品溶液在12 h内均稳定。2.1.8加样回收率试验取水提液共6分,精密称定,按照0.8∶1.0∶1.2的比例加入对照品溶液进行加样回收率试验,测定峰面积。计算平均回收率为98.53%,RSD为1.72%。2.2干膏率测定精密吸取供试品溶液10 mL,置于已干燥至恒重的蒸发皿中,水浴蒸干后放入105 ℃烘箱中,干燥5 h,取出后置于干燥器中冷却0.5 h后称取重量,计算干膏得率。2.3壳聚糖絮凝工艺的考察2.3.1壳聚糖溶液的配制称取5.0 g壳聚糖,以1%醋酸为溶剂配成1%的壳聚糖溶液500 mL,备用。2.3.2单因素考察及因素水平的确定根据相关文献[6-14],壳聚糖絮凝对中药提取液絮凝的静置温度一般控制在40~50 ℃,pH一般控制在4~6,根据此条件对温度,pH进行了单因素考察。而壳聚糖的加入量以及药液浓度则根据益视口服液的具体情况进行单因素考察。2.3.2.1药液浓度的考察药液浓度为1.0 g/mL时,二苯乙烯苷转移率最高,干膏收率略有增加。2.3.2.2壳聚糖加入量的考察结果表明,壳聚糖加入量与二苯乙烯苷及干膏收率均成反比。2.3.2.3静置温度的考察见表1。
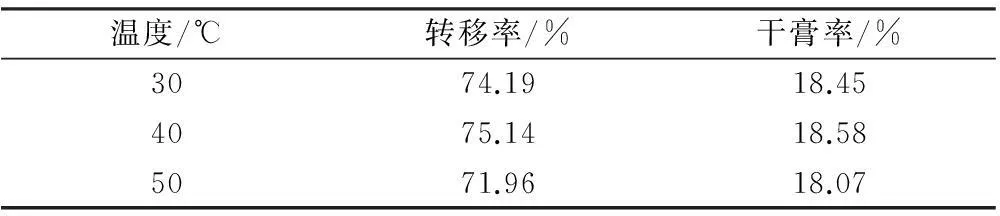
表1 静置温度对二苯乙烯苷转移率和干膏率的影响
结果表明,温度为40 ℃时,二苯乙烯苷转移率最高,干膏收率略有增加。
2.3.2.4药液酸碱度的考察见表2。
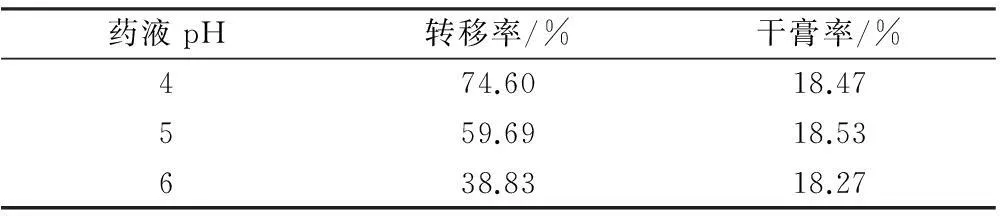
表2 药液酸碱度对二苯乙烯苷转移率和干膏率的影响
注:原药液 pH 值约为 4,采用10%NaOH 溶液调节pH值
结果表明,不调节pH值时,二苯乙烯苷转移率最高,干膏收率相对较低。
2.3.3壳聚糖絮凝正交试验设计因素水平表见表3,方差分析见表4,正交试验设计与结果见表5。

表3 因素水平表

表4 正交试验方差分析表
实验结果表明,以综合评分(综合评分=0.6W1/W1max+0.4Wmin/W2)为考察指标,由表5中极差值R大小显示,各因素的作用主次为B(pH)>C(药液浓度)>A(温度)>D(壳聚糖的加入量)。表4方差分析结果表明,B、C因素各水平间具有显著性差异,综合上述试验结果,拟定以A2B1C3D2为最佳纯化工艺条件,即不调节pH、药液浓度为1.0 g/mL,加入体积比为30%的壳聚糖溶液,于40 ℃的恒温水浴静置。

表5 正交试验设计与结果
注:综合评分=0.6W1/W1max+0.4Wmin/W2,W1为二苯乙烯苷转移率,W2为干膏收率
2.3.4絮凝澄清工艺的验证按照上述正交试验优选出的最佳工艺条件,进行验证试验(n=3)。结果表明,采用不调节pH、药液浓度为1.0 g/mL,加入体积比为30%的壳聚糖溶液,于40 ℃的恒温水浴静置最佳条件时,二苯乙烯苷转移率可达到83.39%,干膏率降低到20.45%(纯化前干膏率为29.37%),且该方法比较稳定。
2.4黏度的测定
2.4.1供试品溶液的制备取益视口服液水提液适量,按照最优工艺条件进行纯化精制,并浓缩到适宜浓度,即得供试品溶液。
2.4.2测量转子及转速的选择试验选择Brook Field 博力飞DV-I黏度计的不同转子系统S00、S61、S62、S63型等转子[15],对不同供试品溶液的适应性进行考察,结果:仅有S00型的转子测得的数据稳定且扭矩>10%,符合黏度测定要求,故选择S00型转子以100 RPM的转速进行测定。
2.4.3黏度的测定结果取供试品溶液,分别配制成浓度为0.25、0.5、0.75、1.0 g/mL的溶液,测定黏度。结果纯化前浓度分别为5.43、6.21、8.98、9.79 g/mL;纯化后浓度分别为2.77、3.37、4.61、7.57 g/mL。
2.5浊度的测定取供试品溶液,分别配制成浓度为0.25、0.5、0.75、1.0 g/mL的溶液,测定浊度值。结果纯化前浓度分别为798.2、996.8、1 204.1、1 305.7 g/mL;纯化后浓度分别为436.3、789.2、 999.7、1 013.9 g/mL。
2.6蛋白质的测定
2.6.1测定方法1)显色剂的配制:取G-250 100 mg,加入50 mL 95% EtOH,溶解后再加入100 mL 85%(W/V)H3PO4,用水调至1 000 mL,即为考马斯亮蓝工作液。2)标准曲线的绘制:精密吸取牛血清蛋白试剂适量,配置浓度分别为0.1、0.2、0.4、0.6、0.8、1.0 mg/mL的标准溶液,在595 nm处进行紫外测定,以浓度为横坐标,吸光度为纵坐标,计算回归方程为Y=0.000 6X—0.080 2,R2=0.999 6,表明牛血清蛋白在0.1~1.0 mg/mL范围内与吸光度线性范围良好。
2.6.2测定结果吸取待测样品0.1 mL,加入5 mL考马斯亮蓝G-250蛋白试剂5 mL,充分混合,放置2 min后测其吸光度,通过标准曲线得蛋白质浓度,计算纯化后蛋白质的清除率为12.3%。
2.7鞣质的测定
2.7.1测定方法1)量取供试品溶液(包含原药液)各250 mL,备用。2)总水溶性部分的测定:精密量取供试液25 mL,蒸干,残渣于105 ℃干燥3 h至恒重,称重(T1)。3)不与皮粉结合的水溶性部分的测定:精密量取供试液100 mL,加皮粉5 g,振摇15 min,滤过,精密量取滤液25 mL,蒸干,残渣于105 ℃干燥3 h至恒重,称重(T2)。4)皮粉水溶性部分的测定:精密量取水100 mL,加皮粉5 g,振摇15 min,滤过,精密量取滤液25 mL,蒸干,残渣于105 ℃干燥3 h至恒重,称重(T0)。
2.7.2测定结果以鞣质%=(T1-T2+T0)×10/W %,计算鞣质清除率,结果表明采用壳聚糖絮凝后,鞣质清除率为27.5%。
3小结
澄明度是口服液的重要质控指标,它反映了产品稳定性,是口服液制备中的关键问题。中药口服液的澄明度受很多因素的影响,如pH,电导率,鞣质,蛋白质等,更重要的是中药口服液本身就是一个不稳定的体系。以本试验通过对其物理参数的考察来进一步阐释壳聚糖絮凝沉降工艺对该制剂的影响[16-18]。 黏度和浊度是反映中药口服液的重要因素,在纯化工艺中除要考虑其有效成分保留率的同时,对口服液的外观性状也应关注。众所周知,中药大多为多味药配伍组成,成分复杂多变,药物在煎煮提取过程中除了提取出大量有效物质外,常含有大量无效物质,所以通过对其黏度和浊度的考察,使其在保证药效的同时还能满足降低黏度提高澄明度的作用。蛋白质和鞣质一般情况也是中药复方中要除去的杂质,益视口服液采用壳聚糖絮凝沉降后对其均有一定的除杂作用。但是最终纯化工艺还有待于进一步结合药效学实验结果进行确定。
参考文献:
[1]卫生部药典委员会.中华人民共和国卫生部药品标准:中药成方制剂[S].北京:人民卫生出版社,1997: 151-224.
[2]国家药典委员会.中华人民共和国药典:1部[M].北京.化学工业出版社,2010.
[3]朱立俏,盛华刚,魏强强,等.壳聚糖絮凝沉降法对延胡索水提液的纯化工艺研究[J].中药新药与临床药理,2012,23(2):212-214.
[4]罗兴洪,周进东,吴静,等.壳聚糖用于咳喘宁口服液澄清工艺的研究[J].中成药,2002,24(5):337-339.
[5]邢树文,姚洁如.壳聚糖对番石榴汁澄清作用的研究[J].现代食品科技,2008,24(9):914-916.
[6]张栓,宁显唯,王夕静.壳聚糖对八正合剂的澄清作用的实验研究[J].陕西中医学院学报,2003,26(4):48-50.
[7]官东秀,冯祚臻,陈群,等.壳聚糖絮凝法制备贞芪扶正口服液[J].沈阳药科大学学报,2003,20(1):5-7.
[8]张彤,徐莲英,俞良武.壳聚糖澄清剂对水提液中淫羊藿苷的影响[J].江西医药,2001,36(4):264-265.
[9]吴巧凤,楼小红.壳聚糖澄清法代替醇沉法制备复方参苓口服液[J].中国中医药科技,2000,7(5):313-314.
[10]廖春燕,邓冬梅,张竺英.壳聚糖絮凝桔梗水提液的研究[J].广东农业科学,2012,39(13):139-142.
[11]孙星,盛华刚,张超,等.壳聚糖絮凝沉降法对葛根芩连汤中黄酮和生物碱类成分的影响[J].中国实验方剂学杂志,2012,18(20):12-16.
[12]贺培益,王米,孟新宇,等.壳聚糖絮凝法澄清复方黄芪水提液的工艺研究[J].中国生化药物杂志,2010,31(3):173-175.
[13]张敏,樊小平,花慧.壳聚糖用于健脾壮腰药酒澄清工艺的实验研究[J].中国医药导报,2011,8(12):74-75.
[14]罗世江.影响壳聚糖絮凝法澄清效果因素浅析[J].中国医药指南,2012,10(12):455-457.
[15]唐志书,郭立玮,陈大平,等.不同伴生物三七总皂苷主要物理化学参数测定研究[J].现代中医药,2011,31(1):57-59.
[16]关文秋.中药口服液提浸纯化工艺评述[J].实用中医药杂志,2004,20(10):602-603.
[17]张来华,王博,朱盛山.中药水提液纯化技术研究进展[J].亚太传统医药,2009,5(7):154-157.
[18]谢崇义,李国忠,夏明堂,等.中药提取液纯化精制新技术研究进展[J].安徽医药,2008,12(12):1225-1227.
------Bayadi”鲜食葡萄贮藏后果实品质及抗氧化能力的影响

