不同目标血糖管理对脓毒症大鼠肝脏损伤的影响
曾建琼,程青虹,何永来,齐 研
脓毒症是重症监护病房(ICU)最为常见的疾病,随着病情发展,机体各脏器会受到不同的损伤,肝脏是脓毒症状态下最易受累的器官之一,肝功能不全是脓毒症发展为多器官衰竭的早期表现之一[1]。肝脏中特有分布的肉毒碱棕榈酰基转移酶1(liver carnitine palmitoyltransferase 1,L-CPT-1)在病理状况下对肝脏脂肪酸氧化有重要作用。L-CPT-1是决定长链脂酰辅酶A 转入线粒体的限速步骤,并接受过氧化物酶体增殖物激活受体α(PPAR-α)的调控[2]。高血糖是脓毒症患者死亡危险因素,早期强化胰岛素治疗严格控制患者的血糖可降低其病死率[3]。本研究观察胰岛素控制不同目标血糖水平对脓毒症大鼠转氨酶、血脂及肝脏中PPAR-α和L-CPT-1表达的影响,探讨目标血糖管理对脓毒症肝损伤是否具有保护作用及其作用机制。
1 材料与方法
1.1 实验材料和仪器
40只SPF级健康雄性成年SD 大鼠,体重(300±20)g,由新疆医科大学实验中心提供;游离脂肪酸(FFA)试剂盒,购自南京建成生物公司,批号A042;PPAR-a抗体,购自武汉博士德生物工程公司,批号10L180;CPT-1抗体,购自艾博抗(上海)贸易有限公司,批号MS1070;速效胰岛素,国药准字H32020614,效价400 u/10 mL,由江苏万邦生物医药公司生产;乳酸钠林格液,国药准字H20057107,由山东鲁抗辰欣药业有限公司生产。使用的仪器包括:快速血糖仪(美国强生医疗器材有限公司)、WZS-50F6型微量注射泵(北京恒奥德仪器仪表有限公司)和Automatic analyzer7600-110 型生化分析仪(日本Olympus公司)。
1.2 动物分组及模型制备
1.2.1 实验分组 40只SD 大鼠,随机分为5组:假手术组仅做开、关腹处理;脓毒症组给予手术后微量泵静脉泵入与各血糖控制组等容量生理盐水;脓毒症血糖控制A 组、B组和C组分别为造模成功后血糖控制在4.4~6.1 mmol/L、6.2~8.3 mmol/L和8.4~10.0mmol/L水平。胰岛素用法:15 u加生理盐水20 mL,微量泵静脉泵入,以快速血糖仪检测血糖水平,及时调整微量泵速度。
1.2.2 脓毒症大鼠模型建立 所有大鼠术前禁食12 h,不禁水,戊巴比妥钠100 mg/kg腹腔注射麻醉,仰卧位固定。颈、腹部备皮,右颈外静脉置管用于输液,以改良的盲肠结扎穿孔术法制备大鼠脓毒症模型。盲肠结扎穿孔术具体方法:中、下腹正中切口2 cm,盲肠根部结扎,自制穿孔针在距盲肠末端1 cm 处戳孔,直径0.5 cm,挤出约黄豆粒大小粪便,结扎离断双侧大网膜,缝合关闭腹腔。术后立即皮下注射乳酸钠林格液50 mL/kg,所有大鼠经静脉给予营养支持(蛋白质占总供能的22.4%,脂肪占11.8%,碳水化合物占65.8%的比例配置[4]。模型成功标准:可达到动物全身炎性反应综合征参照标准[5],且经组织病理观察可见脓毒性肝脏损伤。
1.3 标本采集与处理
各组大鼠造模后12 h,分别作以下处理:①从右颈外静脉取血1 mL,3 000 r/min,室温下离心15 min后取血清分装后存放于-80℃冰箱,以备检测相应指标;②各组大鼠断头处死,迅速开腹留肝脏标本2份,4%甲醛固定。
1.4 观察指标
1.4.1 肝功能及血脂检测 采用Automatic analyzer7600-110 型生化分析仪检测各组血清样本中丙氨酸转氨酶(ALT)、天冬氨酸转氨酶(AST)和FFA 的水平,FFA 的检测严格按照检测说明书操作。
1.4.2 肝脏病理形态学分析 将肝脏组织从4%甲醛中取出,行石蜡包埋、切片和HE 染色,观察肝脏组织病理学改变及炎性细胞浸润情况,参照文献[6]的方法评判肝脏的病理损伤。
1.4.3 肝脏PPAR-α和CPT-1蛋白表达的检测切片后免疫组化法染色,具体步骤:脱蜡、水化、抗原修复、显色、复染、封片、镜检;采用平均阳性染色面积百分比法半定量分析PPAR-α及CPT-1 蛋白表达的部位及强弱。
1.5 统计分析
应用SPSS 17.0软件进行统计分析,计量资料以均数±标准差表示,整体比较方差齐行单因素方差分析,方差不齐行秩和检验,P<0.05为差异有统计学意义。
2 结果
2.1 肝功能及血脂检测
脓毒症组与假手术组和各血糖控制组相比,ALT、AST 和FFA 的水平显著增高(P<0.05),A组较B、C 组明显降低(P<0.05),B 组低于C 组(P<0.05),见表1。
2.2 肝组织病理学变化及组织病理评分分析
光镜下假手术组肝小叶形态结构基本正常,肝小叶规则,肝细胞排列整齐,在中央静脉周围呈放射状分布,肝细胞中央有大而圆的核,细胞质均匀,未见脂肪变性和炎性细胞侵润;脓毒症组肝细胞损伤明显比其他组严重,肝小叶结构不清,细胞弥漫性水样变性,脂肪变性明显,肝血窦高度扩张充血,部分可见碎屑状坏死,小叶内及汇管区可见炎性细胞浸润;而各血糖控制组上述病理变化亦存在,但较脓毒症组明显减轻,随着血糖水平升高,其肝细胞水样变性、脂肪变性、间质炎性反应及间质充血均逐渐加重,A 组最轻,B 组次之,C 组最重,见图1。根据参照文献[6]的方法评判肝脏的病理损伤评分标准,5组均没有出现肝细胞弥漫坏死或者桥接坏死,且只在脓毒症组出现了碎屑状坏死。肝病理组织损伤总评分脓毒症组均明显高于假手术组及各血糖控制组(P<0.05),A 组较B、C 组明显降低(P<0.05),B组病理损伤评分低于C 组(P<0.05)见表2。通过评分,与假手术组比较,血糖控制A、B、C 组及脓毒症组,肝损伤程度呈逐渐加重趋势。
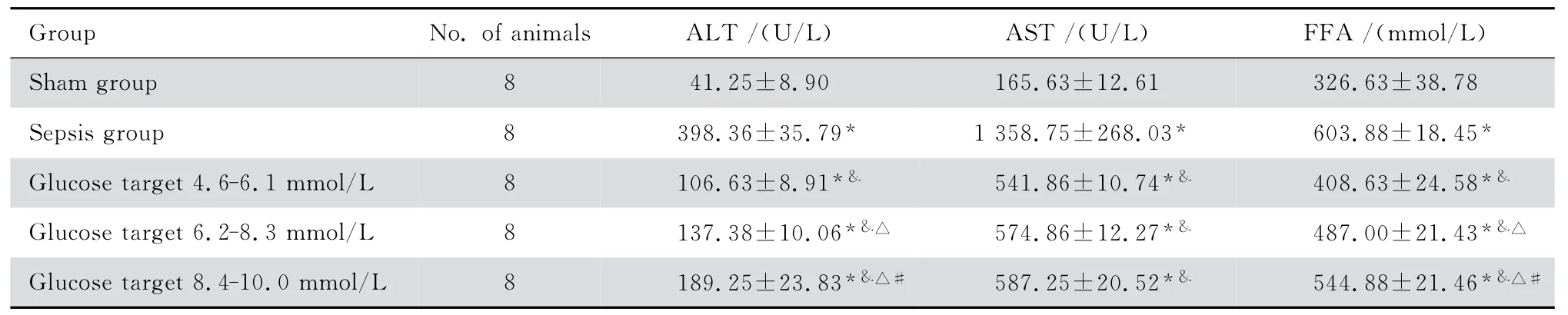
表1 各组大鼠血清ALT、AST、FFA 的水平Table 1 Serum ALT,AST and FFA levels in rats after different interventions(mean±SD)

图1 各组大鼠肝组织病理照片Figure 1 Pathological findings of liver damage in rats after different interventions(hematoxylin and eosin stain×400)
2.3 肝脏免疫组化染色分析PPAR-α、CPT-1蛋白表达部位及相对含量
阳性着色表现为胞质染成棕黄色或棕褐色,CPT-1主要分布在汇管区及中央静脉旁,见图2。假手术组CPT-1 阳性细胞数分布在汇管区及中央静脉旁,表达量较高,染色强度2~3,阳性细胞数为70%,平均染色积分6.73±1.54;脓毒症组CPT-1阳性细胞数分布在汇管区及中央静脉旁,低表达,染色强度0~1,阳性细胞数为16%,平均染色积分0.73±0.45;血糖控制A 组CPT-1阳性细胞数分布在汇管区及中央静脉旁,表达量高,染色强度2~3,阳性细胞数为45%,平均染色积分4.90±1.37;血糖控制B 组CPT-1阳性细胞数分布在汇管区及中央静脉旁,表达量较高,染色强度1~2,阳性细胞数为70%,平均染色积分3.85±0.83;血糖控制C 组CPT-1阳性细胞数分布在汇管区及中央静脉旁,表达量较低,染色强度1,阳性细胞数为20%,平均染色积分1.3±0.46。PPAR-α分布在全小叶肝细胞,见图3。假手术组PPAR-α阳性细胞数分布在全小叶肝细胞,表达量较高,染色强度3,阳性细胞数为70%,平均染色积分6.70±1.34;脓毒症组PPAR-α阳性细胞数分布在汇管区及中央静脉旁,表达量低,染色强度2~3,阳性细胞数为24%,平均染色积分2.10±1.55;血糖控制A 组PPAR-α阳性细胞数分布在全小叶肝细胞,表达量高,染色强度2,阳性细胞数为65%,平均染色积分5.55±0.85;血糖控制B组PPAR-α阳性细胞数分布在全小叶肝细胞,以汇管区表达明显,表达量高,染色强度1,阳性细胞数为55%,平均染色积分3.03±1.15;血糖控制C组PPAR-α阳性细胞数分布在全小叶肝细胞,以中央静脉周围区表达明显,表达量高,染色强度1,阳性细胞数为40%,平均染色积分2.33±0.69。脓毒症组肝组织CPT-1及PPAR-α的表达明显低于各血糖控制组,但与C组差异无统计学意义(P>0.05),A组较B、C组明显增高(P<0.05),B组高于C组(P<0.05),见表2。
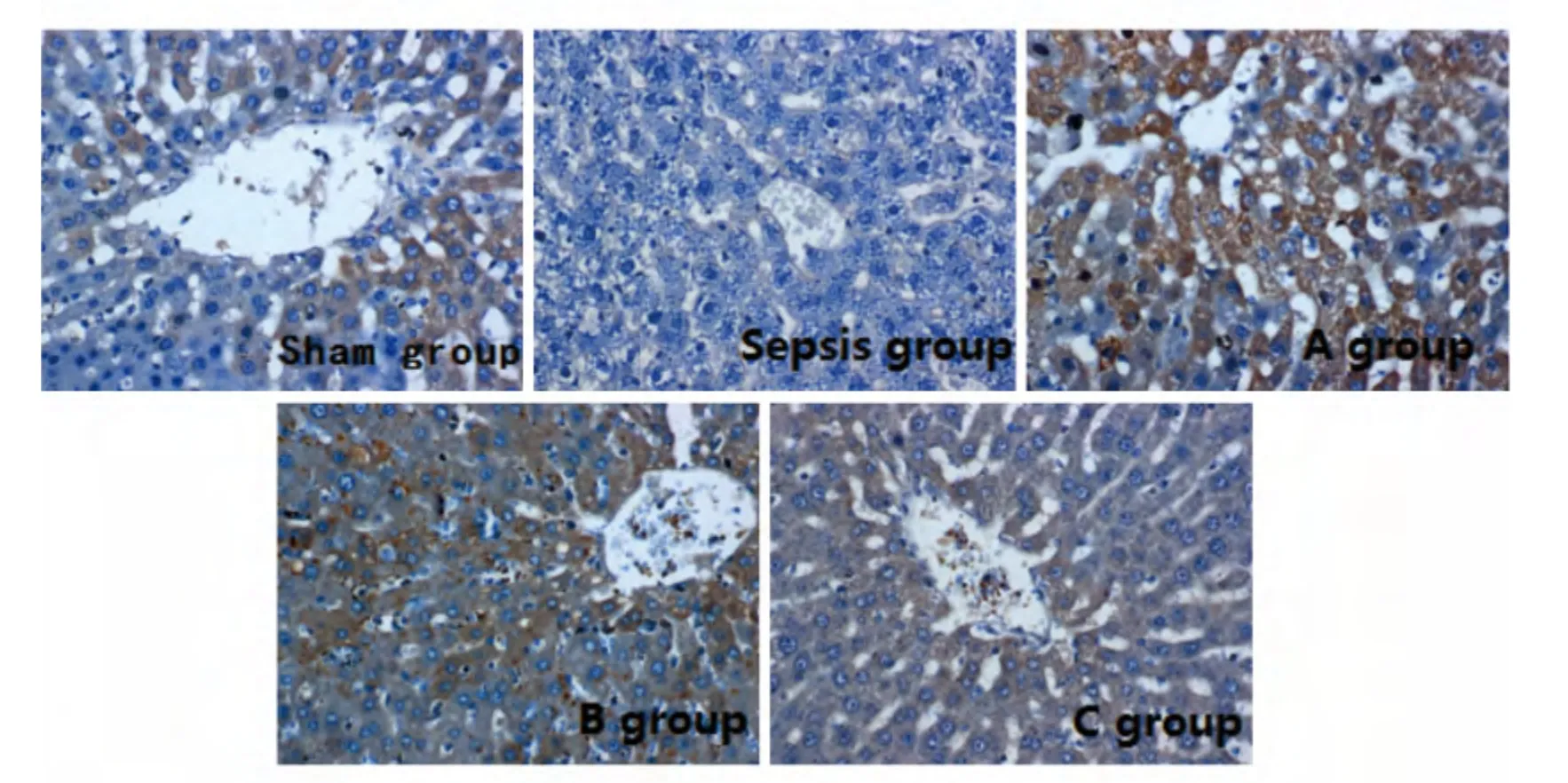
图2 各组大鼠肝脏CPT-1表达免疫组化染色照片Figure 2 Expression of liver carnitine palmitoyltransferase 1in rats after different interventions(immunohistochemical stain,×400)

图3 各组大鼠肝脏PPAR-α表达免疫组化染色照片Figure 3 Expression of PPAR-αin liver of rats after different interventions(immunohistochemical stain,×400)
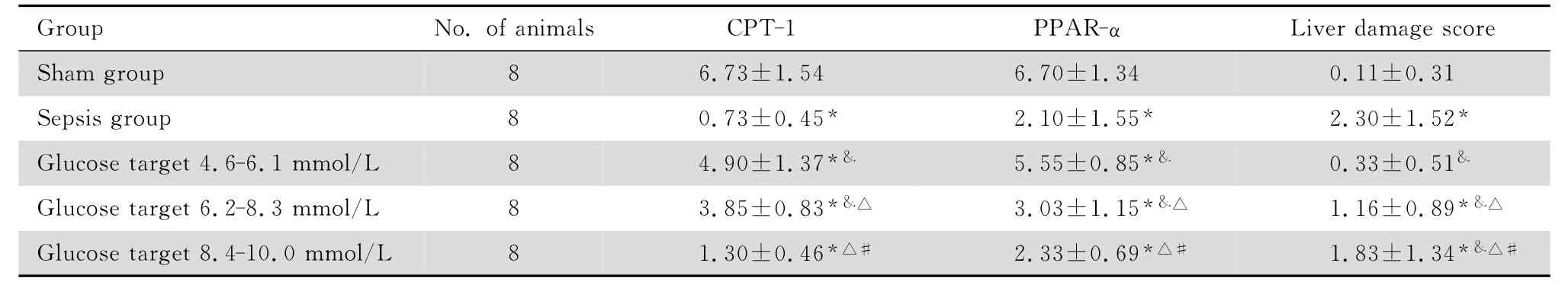
表2 各组大鼠CPT-1、PPAR-α及肝病理损伤评分的表达Table 2 Expression levels of CPT-1 and PPAR-αin the liver of rats and liver damage score after different interventions(mean±SD)
3 讨论
脓毒症是感染所致的全身炎性反应综合征,严重感染诱发脓毒症,机体多处于应激状态,代谢发生剧烈的变化,表现为血糖升高、脂肪动员增强、蛋白质分解增强[7]。在脂代谢方面,FFA 增多,FFA 主要参与氧化供能。本实验通过盲肠结扎穿孔术,制造与临床感染相似的脓毒症动物模型,组织病理学分析及血清ALT、AST、FFA水平测定观察肝组织损伤的严重程度,结果表明脓毒症组ALT、AST、FFA 较假手术组显著增高,而且病理变化显著,肝小叶结构破坏,肝细胞弥漫性水肿、脂肪变性,部分坏死,大量炎性细胞浸润,这提示已造成一定程度的肝损伤。
CPT-1位于线粒体内膜,是脂肪酸β氧化的限速酶。目前在哺乳动物中发现CPT-1至少有2 种亚型:肝型(L-CPT-1)和心脏/肌肉型(M-CPT-1)。肝脏中主要表达L-CPT-1,有过氧化酶体增殖物调控元件(PPRE)结构[8]。PPAR 是核激素受体超家族成员,是配体激活的核转录因子,分α、β、γ3种亚型[9],肝脏是调节机体能量代谢的重要器官,3 种PPAR 在肝脏均有不同程度的表达,其中PPAR-α表达最为丰富,肝脏PPAR-α在血脂代谢中发挥重要作用,PPAR-α可被饱和或不饱和脂肪酸激活,在调节能量稳态、炎性反应、免疫、纤维化、凋亡等方面发挥着重要作用[10-12]。尽管多项研究表明PPAR-α具有明确的抗炎作用,但在炎性反应作为其主要病生理机制的脓毒症肝损伤的发生发展过程中,PPAR-α的作用及机制目前尚无研究报道。PPAR-α主要表达于高脂肪酸β 氧化的组织,如肝脏、心脏、肾脏、骨骼肌、褐色脂肪组织,PPAR 被激活后可通过调节脂代谢相关酶类,如肉碱脂酰转移酶I、脂酰辅酶A 脱氢酶、脂酰辅酶A 氧化酶的基因表达,促进脂质分解以及脂肪酸的摄取、氧化和利用[13-14]。肝脏是氧化分解脂肪酸的主要场所,脂肪酸β-氧化可以供应机体所需要的大量能量,当脂肪酸β-氧化受损时,势必影响能量的产生。此外,脂肪酸β-氧化受限会使游离脂肪酸在肝细胞内堆积,进而导致肝脂肪变性、肝细胞坏死,从而影响肝功能[15]。肝脏中的CPT-1受PPAR-α调节,PPAR-α调控CPT-1 mRNA 表达的上 游基因,PPAR-α 被FFA 激活后将诱导L-CPT-1mRNA 的 表达,增 加L-CPT-1的合成,促进脂肪酸β氧化,减少脂肪酸在肝细胞内的沉积,减轻肝细胞的脂肪变性[16]。本实验结果显示,脓毒症组大鼠较各血糖控制组大鼠的PPAR-α和CPT-1的表达显著降低,FFA 明显升高,且差异有统计学意义,提示在脓毒症状态下,随着炎性反应加重,肝脏受损程度加重,PPAR-α和L-CPT-1表达明显下降。PPAR-α和L-CPT-1的低表达,直接影响了脂肪酸转运进入线粒体过程的进行,已进入细胞的脂肪酸及其活化产物脂酰辅酶A 沉积在胞浆内,在线粒体的外膜外难以顺畅地进入线粒体基质中进行β氧化以实现能量生成,最终导致肝细胞出现脂肪变性,肝细胞水肿明显,部分肝细胞坏死,炎性细胞浸润,ATP 生成减少,能量代谢出现异常,糖原异生增多,进而肝功能异常,最终导致肝脏损伤。
高糖血症是危重症患者尤其是脓毒血症患者常见的一种症状,高血糖对脓毒血症患者产生不利影响,有研究显示,高血糖持续时间与患者病情严重程度呈明显正相关[17-18]。究其原因可能与以下因素有关:①持续高血糖影响巨噬细胞、中性粒细胞的功能,并损伤部分皮肤屏障的营养作用,从而增加了患者继发感染的发病风险,如果患者原发病较重,则感染一旦发生便难以控制;②高血糖可以促进机体内的炎性反应,加速脓毒症患者病情的发展;③高血糖可直接影响重要脏器组织的修复功能。因此,改善脓毒症患者的高血糖状态对于疾病的治疗极为重要。然而,常规胰岛素治疗对此类患者血糖水平的控制效果不佳,疗效较差。因此,近年来,胰岛素强化治疗的观点受到了国内外广大学者的重点关注。有学者认为,胰岛素强化治疗可以降低患者的病死率,改善患者的预后[19]。强化胰岛素治疗的主要目标是要将血糖快速控制在一个理想的范围内,但对血糖水平控制的目标范围仍存在争议。本研究采用完全随机对照实验设计,观察目前争议较集中的3个血糖控制水平对脓毒症肝脏损伤的影响,结果显示,各血糖控制组与脓毒症组比较,AST、ALT 及FFA 明显下降,且CPT-1及PPAR-α的表达增高,表明强化胰岛素治疗可明显减轻肝脏功能的损伤及改善脂代谢。光镜观察可见各血糖控制组与脓毒症组比较,肝脏病理损伤程度明显减轻,进一步证实了强化胰岛素治疗可保护脓毒症的肝脏损伤,肝脏病理损伤评分的比较证实了这些改变具有统计学意义。在3个不同血糖控制组间,随着血糖水平升高,肝脏结构与功能的损伤程度有加重趋势,表明血糖控制水平不同,对脓毒症肝损伤的保护效果不同,其中A 组的保护作用明显优于B、C组,差异具有统计学意义,B组又优于C 组,差异具有统计学意义,说明血糖控制在4.4~6.1 mmol/L 保护作用最强。其机制可能为胰岛素抑制了内毒素和炎性因子的释放,改善了脓毒症肝脏的结构及功能损伤,加速了FFA 的转运,促进了PPAR-α和L-CPT-1的表达,从而促进了脂肪酸的β氧化。
综上所述,我们可以认为:强化胰岛素治疗可能通过上调PPAR-α和CPT-1的表达,减轻脓毒症的肝损伤,而血糖控制在4.4~6.1 mmol/L 对脓毒症大鼠肝脏损伤保护作用最明显,CPT-1和PPAR-α可能成为临床上防治脓毒症肝损伤的一个新的、重要的靶点。
[1]Kallinen O,Maisniemi K,Böhling T,et al.Multiple organ failure as a cause of death in patients with severe burns[J].J Burn Care Res,2012,33(2):206-211.
[2]Schoonjans K,Staels B,Auwerx J.Role of the peroxisome proliferator-activated receptor(PPAR)in mediating the effects of fibrates and fatty acids on gene expression[J].J Lipid Res,1996,37(5):907-925.
[3]Leonidou L,Michalaki M,Leonardou A,et al.Stressinduced hyperglycemia in patients with severe sepsis:a compromising factor for survival[J].Am J Med Sci,2008,336(6):467-471.
[4]李明龙,赵家军,王明雁,等.长期蛋白饲养对正常大鼠葡萄糖刺激的胰岛素分泌的影响[J].山东大学学报(医学版),2007,45(10):977-980.
[5]盛志勇,胡森.多器官功能障碍综合征[M].北京,科学出版社,1999:18-63.
[6]Xie K,Yu Y,Zhang Z,et al.Hydrogen gas improves survival rate and organ damage in zymosan-induced generalized inflammation model[J].Shock,2010,34(5):495-501.
[7]陈淼,戴李华,盛颖.脓毒症的三大物质代谢变化和营养支持原则[J].中华急诊医学杂志,2007,16(6):668-669.
[8]Rakhshandehroo M,Knoch B,Müller M,et al.Peroxisome proliferator-activated receptor alpha target genes[J].PPAR Res,2010:612089.
[9]Kota BP,Huang TH,Roufogalis BD.An overview on biological mechanisms of PPARs[J].Pharmacol Res,2005,51(2):85-94.
[10]Contreras AV,Torres N,Tovar AR.PPAR-αas a key nutritional and environmental sensor for metabolic adaptation[J].Adv Nutr,2013,4(4):439-452.
[11]Roberts RA,Chevalier S,Hasmall SC,et al.PPARαand the regulation of cell division and apoptosis[J].Toxicology,2002,181-182:167-170.
[12]Crisafulli C,Cuzzocrea S.The role of endogenous and exogenous ligands for the peroxisome proliferator-activated receptor alpha(PPAR-α)in the regulation of inflammation in macrophages[J].Shock,2009,32(1):62-73.
[13]Song S,Attia RR,Connaughton S,et al.Peroxisome proliferator activated receptor alpha(PPAR alpha)and PPAR gamma coactivator(PGC-1 alpha)induce carnitine palmitoyltransferase IA(CPT-1A)via independent gene elements[J].Mol Cell Endocrinol,2010,325(1-2):54-63.
[14]Seo YS,Kim JH,Jo NY,et al.PPAR agonists treatment is effective in a nonalcoholic fatty liver disease animal model by modulating fatty-acid metabolic enzymes[J].J Gastroenterol Hepatol,2008,23(1):102-109.
[15]Kneiseler G,Bachmann HS,Bechmann LP,et al.A rare case of propofol-induced acute liver failure and literature review[J].Case Rep Gastroenterol,2010,4(1):57-65.
[16]Musso G,Gambino R,Cassader M.Recent insights into hepatic lipid metabolism in non-alcoholic fatty liver disease(NAFLD)[J].Prog Lipid Res,2009,48(1):1-26.
[17]Gordon BS,Kelleher AR,Kimball SR.Regulation of muscle protein synthesis and the effects of catabolic states[J].Int J Biochemi Cell Biol,2013,45(10):2147-2157.
[18]闫柏刚,任小宝,赵晓东,等.胰岛素强化治疗对严重烧创伤患者伤后蛋白质代谢的影响[J].烧伤外科杂志,2013,29(2):181-184.
[19]刘汉成,周岩冰,陈栋,等.胰岛素强化治疗对胃癌根治术患者静息能量代谢的影响[J].中华外 科杂志,2011,49(9):789-794.

