2014年CHINET 中国细菌耐药性监测
胡付品,朱德妹,汪 复,蒋晓飞,徐英春,张小江,张朝霞,季 萍,谢 轶,康 梅,王传清,王爱敏,徐元宏,沈继录,孙自镛,陈中举,倪语星,孙景勇,褚云卓,田素飞,胡志东0,李 金0,俞云松,林 洁,单 斌,杜 艳,韩艳秋,郭素芳,魏莲花,吴 玲,张 泓,孔 菁,胡云建,艾效曼,卓 超,苏丹虹
多重耐药(multidrug-resistant,MDR)、广泛耐药(extensively-drug resistant,XDR)和全耐药(pan-drug resistant,PDR)菌株的出现和日益增多[1],其所致感染为抗感染治疗带来了挑战,目前已成为公共卫生领域中的严重问题。现将2014 年CHINET 中国细菌耐药性监测结果报道如下。
1 材料与方法
1.1 材料
1.1.1 细菌 收集CHINET 中国细菌耐药性监测网成员单位2014年1月1日—12月31日临床分离株,剔除同一患者分离的重复菌株,按统一方案进行细菌对抗菌药物的敏感性试验。
1.1.2 培养基药敏试验用Mueller-Hinton(MH)琼脂,肺炎链球菌和各组链球菌用含5%脱纤维羊血MH 琼脂,流感嗜血杆菌用嗜血杆菌属培养基(HTM)加SR158营养补充剂。上述试剂均为英国OXOID 公司商品。
1.1.3 抗菌药物纸片和E 试验条 抗菌药物纸片为美国BBL 公司或英国OXOID 公司商品。青霉素、万古霉素和替考拉宁E 试验条为法国生物梅里埃公司商品。
1.2 方法
1.2.1 药敏试验 参照2014年美国临床和实验室标准化协会(CLSI)推荐的药敏试验方法进行[2],采用纸片扩散法或自动化仪器法。质控菌为:金黄色葡萄球菌(金萄菌)ATCC 25923、大肠埃希菌ATCC25922、铜绿假单胞菌ATCC27853、肺炎链球菌ATCC49619和流感嗜血杆菌ATCC49247。
1.2.2 判断标准参照2014年CLSI 文件标准[2]。其中磷霉素的判断标准仅针对尿标本分离的大肠埃希菌和粪肠球菌。替加环素的判断标准按美国食品和药品监督管理局(FDA)文件标准。
1.2.3 β内酰胺酶检测 采用头孢硝噻吩试验定性检测流感嗜血杆菌中的β内酰胺酶。按CLSI推荐的纸片法筛选和酶抑制剂增强确证试验检测大肠埃希菌、肺炎克雷伯菌、产酸克雷伯菌和奇异变形杆菌中产超广谱β内酰胺酶(ESBL)菌株。
1.2.4 青霉素不敏感肺炎链球菌的检测 经苯唑西林纸片法测定抑菌圈直径≤19 mm 的肺炎链球菌菌株,采用青霉素E 试验条测定其最低抑菌浓度(MIC),脑膜炎株和非脑膜炎株分别按CLSI 2014年标准判定为青霉素敏感、中介或耐药株。
1.2.5 耐万古霉素肠球菌检测 经万古霉素纸片法测定结果为非敏感株者,用万古霉素和替考拉宁E试验条测定MIC值,部分菌株采用聚合酶链反应(PCR)法确认万古霉素耐药的基因型。
1.2.6 XDR 菌株和碳青霉烯类耐药肠杆菌科细菌(carbapenem-resistant Enterobacteriaceae,CRE) XDR 为对除黏菌素和替加环素外的其他抗菌药物全耐药者[1]。CRE定义为对亚胺培南、美罗培南或厄他培南中任一种药物耐药者。
1.2.7 数据统计分析 数据统计分析采用WHONET5.6软件。
2 结果
2.1 细菌分布
2014年共收集临床分离株78 955株,其中革兰阳性菌21 635 株,占27.4%,革兰阴性菌57 320株,占72.6%。住院患者和门急诊患者分离的菌株分别占84.9%和15.1%。标本分布中痰液等呼吸道标本占41.6%、尿液22.4%、血液13.3%、伤口脓液4.8%、脑脊液1.0%、其他无菌体液4.7%、生殖道分泌物2.2%、粪便1.2%和其他标本8.7%。肠杆菌科细菌占所有分离菌株的45.3%(35 788/78 955),其中最多见者依次为大肠埃希菌、克雷伯菌属、肠杆菌属、变形杆菌属;不发酵糖革兰阴性杆菌占所有分离菌株的25.3%(19 967/78 955),其中最多见者依次为不动杆菌属、铜绿假单胞菌和嗜麦芽窄食单胞菌。革兰阳性菌中最多见者依次为金葡菌、肠球菌属和凝固酶阴性葡萄球菌(只包括血液、脑脊液等无菌体液分离菌)。主要细菌菌种分布见表1。
where xmis the motor natural frequency of the EHA system.

表1 CHINET 中国细菌耐药监测菌种分布Table 1 Distribution of bacterial species in 2014 CHINET

continued table 1
2.2 革兰阳性球菌对抗菌药物的敏感率和耐药率
2.2.1 葡萄球菌属 17所医院金葡菌中甲氧西林耐药株(MRSA)的平均检出率为44.6%(29.1%~74.2%),其中2所儿童医院MRSA 的检出率分别为32.5%和34.3%。凝固酶阴性葡萄球菌甲氧西林耐药株(MRCNS)的检出率平均为83.0%(70.6%~96.1%)。MRSA 和MRCNS对β内酰胺类、大环内酯类、氨基糖苷类和喹诺酮类等抗菌药物的耐药率均显著高于甲氧西林敏感株(MSSA 和MSCNS)。但MRSA 对甲氧苄胺-磺胺甲口恶唑的耐药率低于MSSA(7.0%对12.6%)。MRCNS对甲氧苄胺-磺胺甲口恶唑的耐药率明显高于MRSA(60.7%比7.0%);但对利福平的耐药率则显著低于MRSA(13.3%对47.2%)。92%MRSA 对甲氧苄胺-磺胺甲口恶 唑敏感,85.6% MRCNS 对利福平敏感。葡萄球菌属中均未检出万古霉素、替考拉宁、利奈唑胺耐药的菌株,见表2。
2.2.2 肠球菌属 6 891株肠球菌属中粪肠球菌3 129 株,屎肠球 菌3 312 株,分别占肠球菌 属45.4%和48.1%;其他肠球菌450 株,占6.5%。粪肠球菌对绝大多数所测试抗菌药物的耐药率均显著低于屎肠球菌,但对氯霉素的耐药率高于屎肠球菌(31.0%对5.7%)。粪肠球菌对呋喃妥因、磷霉素和氨苄西林的耐药率较低,分别为3.5%、4.3%和6.8%。屎肠球菌对所测试药的耐药率均较高。粪肠球菌和屎肠球菌对高浓度庆大霉素的耐药率分别为31.2%和49.5%。粪肠球菌和屎肠球菌中均有少数对万古霉素和替考拉宁耐药株,见表3。根据万古霉素和替考拉宁耐药表型推测或经PCR检测万古霉素耐药相关基因,可分型的101株万古霉素耐药肠球菌(VRE)中,产VanA、VanB 或VanM 型基因的菌株分别为38株(全部为屎肠球菌)、40株(粪肠球菌10株和屎肠球菌30株)和23株(全部为屎肠球菌)。
2.2.3 链球菌属 分离到A、B、C、G 各组β溶血链球菌分别为456、913、94和57株,分离自血液或脑脊液等无菌体液标本的草绿色链球菌563株。除C组链球菌外,各组β溶血链球菌对青霉素均极敏感,敏感率>90%。少数草绿色链球菌对之耐药(10.1%)。各组链球菌属对红霉素和克林霉素的耐药率均在57%以上;其中A 组链球菌对该两药的耐药率可达84%以上。各组β溶血链球菌中均有少数菌株对头孢噻肟或头孢曲松耐药。除B 组溶血链球菌外,其他β溶血链球菌对左氧氟沙星均较敏感。未检出万古霉素、利奈唑胺耐药株,表4。
2.2.4 肺炎链球菌 1 422 株肺炎链球菌中,9株脑膜炎株(儿童组4 株,成人组5 株)和1 413株非脑膜炎株(儿童组956 株,成人组457 株)。儿童株中青霉素敏感、中介和耐药肺炎链球菌(PSSP、PISP和PRSP)的检出率分别为79.8%、10.6%、9.6%,成人株中分别为95.0%、3.7%和1.3%,见表5。药敏试验结果显示:儿童株和成人株对红霉素、克林霉素和甲氧苄啶-磺胺甲口恶唑耐药率均较高。儿童组中已出现少数左氧氟沙星耐药株,但较成人组为少。未检出万古霉素和利奈唑胺耐药株,见表6。

表2 葡萄球菌属对抗菌药物的耐药率和敏感率Table 2 Susceptibility of Staphylococcus spp.to antimicrobial agents in 2014 CHINET (%)
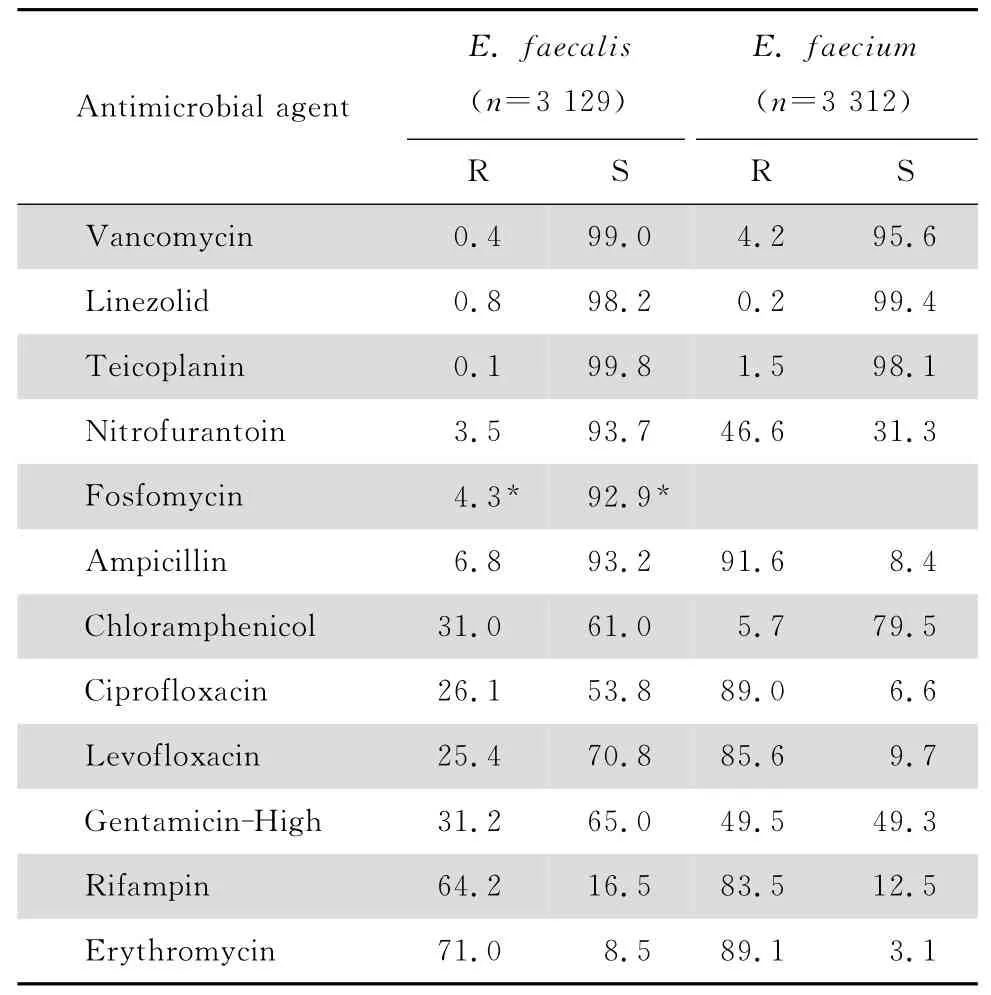
表3 粪肠球菌和屎肠球菌对抗菌药物的耐药率和敏感率Table 3 Susceptibility of Enterococcus spp.to antimicrobial agents in 2014 CHINET (%)

表4 链球菌属对抗菌药物的耐药率Table 4 Resistance rates of Streptococcus spp.to antimicrobial agents in 2014 CHINET (%)
2.3 革兰阴性杆菌对抗菌药物的敏感率和耐药率
2.3.1 肠杆菌科细菌 大肠埃希菌、肺炎克雷伯菌和产酸克雷伯菌以及奇异变形杆菌中产ESBL菌株的检出率分别为55.8%、29.9%和24.0%。上述产ESBL株对青霉素类、头孢菌素类、氨基糖苷类、喹诺酮类、甲氧苄啶-磺胺甲口恶唑的耐药率均显著高于非产ESBL株。大肠埃希菌对环丙沙星、庆大霉素、哌拉西林和甲氧苄啶-磺胺甲口恶唑的耐药率均接近或高于50%。肠杆菌科细菌对3种碳青霉烯类的耐药率仍然较低,不同菌种的耐药率大多在10%以下,见表7。伤寒和副伤寒沙门菌对阿莫西林酶抑制剂复方和氯霉素(除肠炎沙门菌外)的耐药率(<15%)低于其他沙门菌属细菌,沙门菌属细菌对环丙沙星的耐药率均较低(<5%),见表8。志贺菌属20株,其中福氏志贺菌11 株、宋内志贺菌4 株,其他志贺菌5株。福氏志贺菌对氨苄西林、头孢噻肟、氯霉素和甲氧苄啶-磺胺甲口恶唑的耐药率超过50%,对环丙沙星和氨苄西林-舒巴坦的耐药率分别为33.3%和40.0%。35 788株肠杆菌科细菌对11种常用抗菌药物的总耐药率和敏感率见表9。其中细菌对替加环素、3种碳青霉烯类和阿米卡星的耐药率最低,为3.7%~5.5%,其次为2种酶抑制剂复方合剂(头孢哌酮-舒巴坦和哌拉西林-他唑巴坦)。

表5 儿童和成人中肺炎链球菌的分布Table 5 The distribution of S.pneumoniaeisolates in children and adults

表6 儿童和成人患者肺炎链球菌非脑膜炎株对抗菌药物的耐药率Table 6 Resistance rates of nonmeningitis S.pneumoniae strains isolated from children or adults in 2014 CHINET (%)

表7 肠杆菌科细菌对抗菌药物的耐药率和敏感率Table 7 Susceptibility of Enterobacteriaceae to antimicrobial agents in 2014 CHINET (%)

continued table 7

表8 沙门菌属和志贺菌属细菌对抗菌药物的耐药率和敏感率Table 8 Susceptibility of Salmonellaspp.and Shigellaspp.to antimicrobial agents in 2014 CHINET (%)
2.3.2 不发酵糖革兰阴性杆菌 7 471 株铜绿假单胞菌对亚胺培南和美罗培南的耐药率分别为26.6%和24.3%;对多黏菌素B 和阿米卡星的耐药率分别为2.4%和9.4%,对2 种酶抑制剂复方、庆大霉素、环丙沙星、头孢他啶、头孢吡肟和哌拉西林的耐药率<20%。8 769株不动杆菌属中93%为鲍曼不动杆菌,该菌对亚胺培南和美罗培南的耐药率分别为62.4%和66.7%;对头孢哌酮-舒巴坦、阿米卡星和米诺环素的耐药率分别为37.7%、47.4%和49.7%,部分菌株对多黏菌素B的耐药率<2%,对其他测试药的耐药率多在50%以上。嗜麦芽窄食单胞菌对甲氧苄啶-磺胺甲口恶唑、米诺环素、左氧氟沙星敏感率均在88%以上。除氯霉素外,伯克霍尔德菌对CLSI推荐的抗菌药物的敏感率均在70%以上,见表10。19 967 株不发酵糖革兰阴性杆菌对9种常用抗菌药物的总耐药率与2013 年结果大致相仿,见表9。

表9 肠杆菌科细菌和不发酵糖革兰阴性杆菌对抗菌药物的敏感率和耐药率Table 9 Susceptibility of Enterobacteriaceae and non-fermentative gram-negative bacilli to antimicrobial agents in2014 CHINET (%)
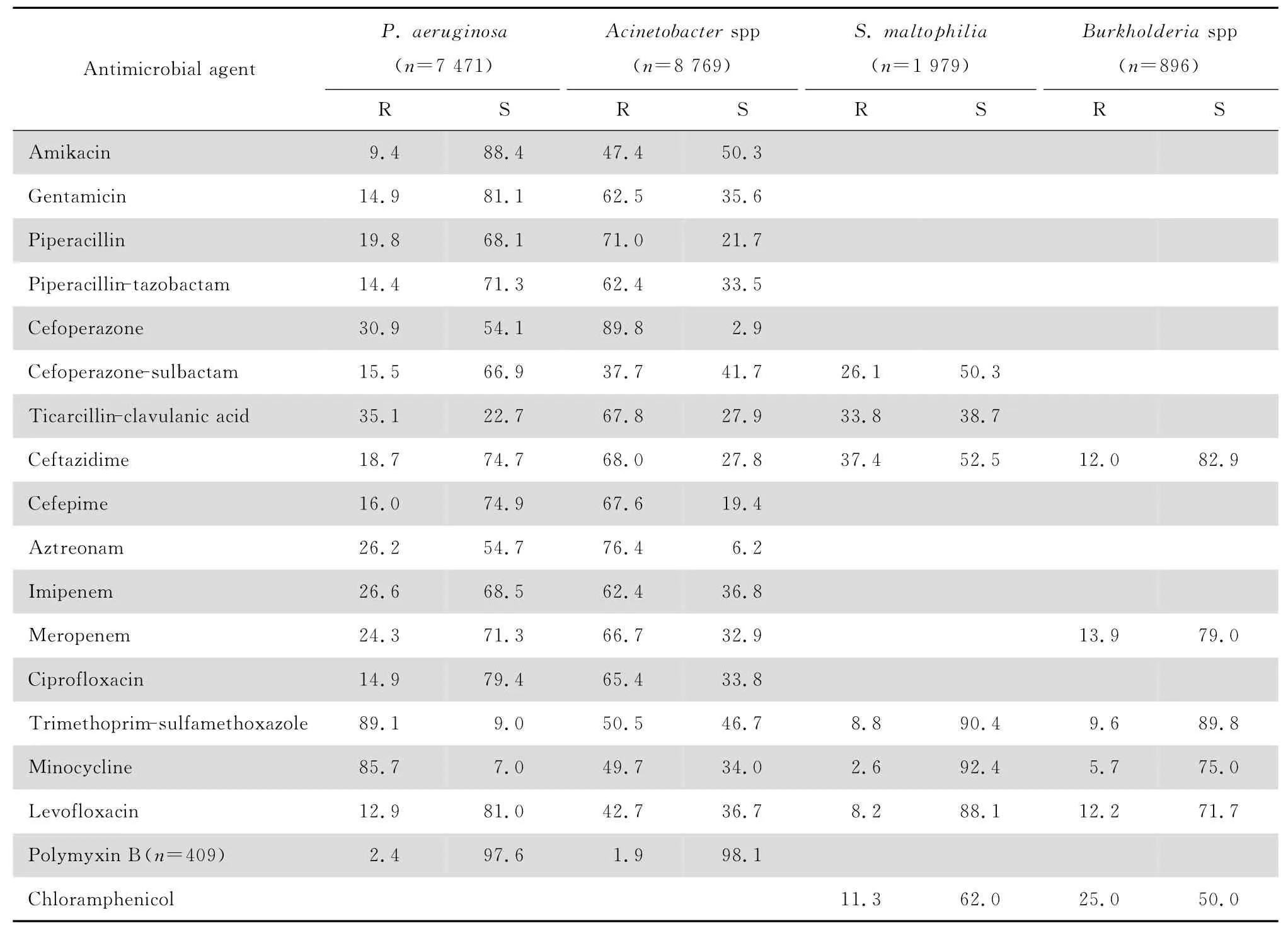
表10 不发酵糖革兰阴性杆菌对抗菌药物的耐药率和敏感率Table 10 Susceptibility of non-fermentative gram-negative bacilli to antimicrobial agents in 2014 CHINET (%)

表11 广泛耐药革兰阴性杆菌的检出率Table 11 Prevalence of extensively drug-resistant gram-negative bacilli by year
2.3.4 流感嗜血杆菌 1 247株流感嗜血杆菌中,儿童分离株745株,成人分离株502株。产β内酰胺酶株总检出率为33.2%,其中儿童株和成人株的产酶率分别为35.2%和29.8%。除氯霉素和环丙沙星外,儿童株对其他测试抗菌药物的耐药率均较成人株高,见表12。
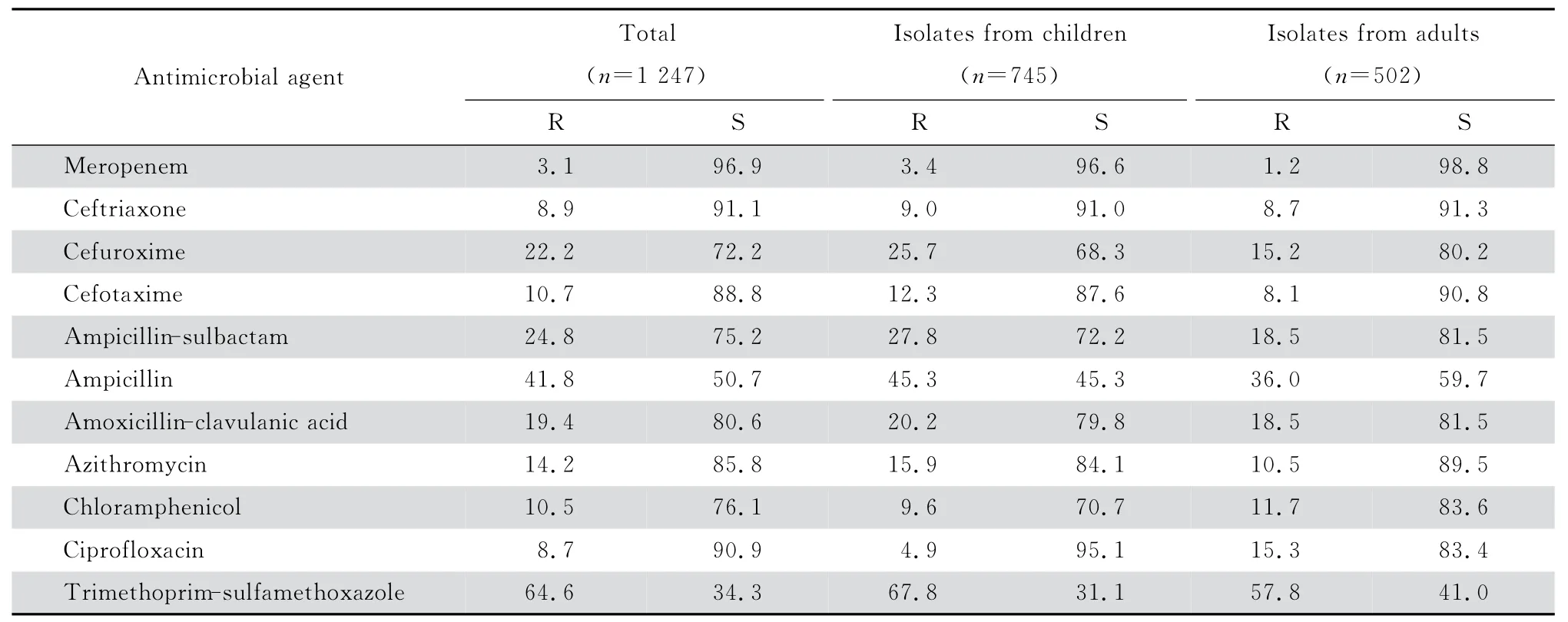
表12 流感嗜血杆菌对抗菌药物的耐药率和敏感率Table 12 Susceptibility of H.influenzae to antimicrobial agents in 2014 CHINET (%)
3 讨论
2014年CHINET中国细菌耐药性监测结果:①参加本次细菌耐药性监测的医院与2013年相比[3],新增1所,参加单位为17所。2014年收集的总菌株数为78 955株,较2013年的84 572株减少6.6%。在肠杆菌科细菌中大肠埃希菌和变形杆菌属有所增多,肠杆菌属和沙门菌属减少。不发酵糖革兰阴性杆菌中不动杆菌属和铜绿假单胞菌有所减少。在革兰阳性球菌中肠球菌属、β溶血链球菌和肺炎链球菌增多,金葡菌和凝固酶阴性葡萄球菌减少;流感嗜血杆菌增多。②金葡菌中甲氧西林耐药株检出率由2013年的45.2%继续下降至44.6%。MRSA 对甲氧苄啶-磺胺甲口恶唑的耐药率保持稳定(分别为7.1%和7.0%)。凝固酶阴性葡萄球菌中甲氧西林耐药株检出率由2013年的73.5%上升至83.0%;MRCNS对利福平的耐药率略有上升(由11.7%升至13.3%)。③肠球菌属中万古霉素耐药粪肠球菌12株(2013年为5株),其中VanB 型10株;万古霉素耐药屎肠球菌120株,其中VanA 型38株,VanB 型30株,VanM 型23株。发现少数利奈唑胺耐药粪肠球菌和屎肠球菌。此外,自2011年开始,肠球菌属中屎肠球菌的分离株数首次超过粪肠球菌[4]。④大肠埃希菌和奇异变形杆菌中产ESBL 株增多(分别为55.8%对54.0%、24.0%对16.5%),但克雷伯菌属中产ESBL株略有减少(29.9%对31.8%)。⑤肠杆菌科细菌中均出现少数碳青霉烯类耐药株,以肺炎克雷伯菌为最多,其对亚胺培南和美罗培南的耐药率均>10%。
历年耐药监测结果显示,变形杆菌属和摩根菌属细菌采用不同药敏试验方法所取得亚胺培南的耐药率相差较大。本研究中,变形杆菌属菌株对亚胺培南的耐药率纸片扩散法为1.5%,自动化仪器法为29.1%;摩根菌属细菌对亚胺培南的耐药率纸片扩散法和自动化仪器法分别为14.7%和40.5%。而变形杆菌属和摩根菌属细菌对美罗培南的耐药率分别为2.1%和2.9%。以上结果显示,在测定变形杆菌属和摩根菌属细菌对亚胺培南的药敏试验时,2种不同药敏试验方法的测定结果存在很大差异。CLSI指出,上述2类细菌对亚胺培南的耐药率较美罗培南显著为高,可能尚存在其他耐药机制[1],有待进一步研究。同时,部分自动化仪器使用说明书中亦提示,奇异变形杆菌对亚胺培南的药敏试验结果可能不可靠。因此,临床实验室在遇到仪器法药敏试验结果显示奇异变形杆菌对亚胺培南耐药时,应采用纸片扩散法进行复核。
碳青霉烯类是治疗MDR 肠杆菌科细菌引起感染的最有效的药物,但近年来CRE菌株的检出率呈逐年上升趋势[5]。由于CRE 菌株往往呈XDR 或PDR的特征,导致感染患者可能陷入无药可用的困境[6]。本组资料结果显示,绝大多数肠杆菌科细菌中均存在CRE菌株,以克雷伯菌属为最多,该菌对亚胺培南和美罗培南的耐药率均超过10%。标本种类和科室分布仍分别以呼吸道标本和重症监护病房为主。对17所医院分离的克雷伯菌属对亚胺培南和美罗培南的耐药率分析发现,不同医院分离的菌株对上述2种药物的耐药率相差很大(0.4%~34.5%),可能与不同医院医师用药习惯不同有关。本组资料显示,CRE菌株对多数临床常用抗菌药物高度耐药,但对替加环素的耐药率为11.9%,对阿米卡星、甲氧苄啶-磺胺甲口恶唑和庆大霉素的耐药率分别为37.1%、52.2%和57.9%外,对其他抗菌药物的耐药率均近70%或以上。目前多黏菌素类被认为是治疗CRE所致感染最有效的抗菌药物,但有报道临床上已发现对多黏菌素类耐药的菌株,应引起临床重视。
为应对CRE菌株所致感染带来的严重挑战,不少学者针对CRE菌株所致感染的治疗进行了探索。体外药敏试验结果显示,多黏菌素类、替加环素、磷霉素和氨基糖苷类对CRE 菌株有良好抗菌活性。现有的临床研究结果显示,上述抗菌药物联合应用(如多黏菌素类或阿米卡星联合碳青霉烯类、多黏菌素类联合替加环素或利福平、氨基糖苷类联合磷霉素等)的疗效均优于单药治疗,尤其含有碳青霉烯类的联合治疗组的病死率最低[7-8]。在上述药物中,需注意药敏试验条件的改变对替加环素的药敏试验结果有很大的影响,包括避光、培养基中离子浓度的高低、pH 值、药物的有效期等[9]。临床研究发现,与对照组相比,替加环素组全因病死率较高,呼吸机相关肺炎患者的治愈率较低和病死率较高,因此需慎用本品。
XDR 革兰阴性杆菌的出现和不断增多已成为临床面临的另一重大挑战[10]。本次细菌耐药性监测结果与2013年相比,XDR 肺炎克雷伯菌和鲍曼不动杆菌的检出率有上升趋势。上述信息应引起医院高度重视并对重点科室进行流行病学调查,查明感染源和传播途径,并采取有效的感染控制措施防止耐药菌感染在病房中流行或引起大范围播散。
[1]Falagas ME,Karageorgopoulos DE.Pandrug resistance(PDR),extensive drug resistance(XDR),and multidrug resistance(MDR)among Gram-negative bacilli:need for international harmonization in terminology[J].Clin Infect Dis,2008,46(7):1121-1122.
[2]Clinical and Laboratory Standards Institute.Performance standards for antimicrobial susceptibility testing[S].Twentyfourth informational supplement,2014,M100-S24.
[3]胡付品,朱德妹,汪复,等.2013年中国CHINET 细菌耐药性监测[J].中国感染与化疗杂志,2014,14(5):369-378.
[4]胡付品,朱德妹,汪复,等.2011年中国CHINET 细菌耐药性监测[J].中国感染与化疗杂志,2012,12(5):321-329.
[5]Hu F,Chen S,Xu X,et al.Emergence of carbapenemresistant Enterobacteriaceae clinical isolates from a teaching hospital in Shanghai,China[J].J Med Microbiol,2012,61(Pt 1):132-136.
[6]Van Duin D,Kaye KS,Neuner EA,et al.Carbapenem-resistant Enterobacteriaceae:a review of treatment and outcomes[J].Diagn Microbiol Infect Dis,2013,75(2):115-120.
[7]Daikos GL,Tsaousi S,Tzouvelekis LS,et al.Carbapenemaseproducing Klebsiella pneumoniae bloodstream infections:lowering mortality by antibiotic combination schemes and the role of carbapenems[J].Antimicrob Agents Chemother,2014,58(4):2322-2328.
[8]Tascini C,Jagliaferri E,Giani T,et al.Synergistic activity of colistin plus rifampin against colistin-resistant KPCproducing Klebsiella pneumoniae[J].Antimicrob Agents Chemother,2013,57(8):3990-3993.
[9]王辉,倪语星,陈民钧,等.新型甘氨酰环素类抗菌药物替加环素的体外药敏试验操作规程[J].中华检验医学杂志,2009,32(11):1208-1213.
[10]Tzouvelekis LS,Markogiannakis A,Psichogiou M,et al.Carbapenemases in Klebsiella pneumoniae and other Enterobacteriaceae:an evolving crisis of global dimensions[J].Clin Microbiol Rev,2012,25(4):682-707.

