万古霉素治疗药物浓度监测队列研究
梁晓宇,吴菊芳,杨敏婕,范亚新,郁继诚,曹国英,黄 俊,周颖杰,张 菁
万古霉素是治疗耐甲氧西林金黄色葡萄球菌(金葡菌)(MRSA)感染的首选药物[1],其疗效与药时曲线 下面积(area under concentration-time curve,AUC24h)/MIC≥400 高度相关,而万古霉素稳态时血药谷浓度可作为AUC24h的替代指标[2]。出于对耐万古霉素金葡菌(VRSA)以及MRSA 最低抑菌浓度(MIC)漂移的担忧[3-4],美国传染病协会(IDSA)在2009 年万古 霉素应 用指南 和2011 年MRSA 治疗指南中提出,万古霉素应维持治疗药物谷浓度大于10 mg/L,严重感染时谷浓度可维持在15~20 mg/L[5-6];2011年国内专家共识也对此予以认可[7]。但由于多个临床研究显示谷浓度大于15 mg/L 时可能 引起急 性肾功 能损害[2,8-9],且IDSA 倡导的万古霉素谷浓度范围缺乏本品在中国患者中的疗效和安全性证据,因此国内临床实践中是否应按照治疗药物浓度监测(TDM)谷浓度目标值大于10 mg/L 进行给药方案调整,仍缺乏定论。本研究综合复旦大学附属华山医院对采用万古霉素治疗的前瞻性和回顾性数据进行队列研究,旨在进一步明确万古霉素TDM 对临床治疗的指导意义,为万古霉素的临床合理用药提供依据。
1 材料与方法
1.1 病例选择
本院应用万古霉素治疗的住院患者共128例纳入研究,收集患者人口学信息、临床和实验室检查以及TDM 数据。
暴露队列为2012年9月—2014年9月前瞻性收集本院住院患者中应用万古霉素、进行TDM 并据此调整给药方案的患者(调整组)共64例。比较队列为采用简单随机抽样方法并回顾性收集2005年1月—2009年8 月本院住院患者中使用万古霉素并进行TDM 但未调整给药方案的64例患者(未调整组)。
入选标准为:①性别、年龄、体重不限;②经临床症状、体征、实验室检查诊断或疑为革兰阳性菌感染有应用万古霉素治疗指征者;③万古霉素疗程在3 d以上,并因临床需要进行万古霉素TDM 者。
排除标准为:①入选前72 h内曾接受有效的全身抗菌药物治疗超过24 h 者;②革兰阳性菌定植者;③妊娠或哺乳期妇女;④缺乏临床感染及实验室评价指标,不能进行疗效和安全性评价者。
1.2 TDM 方 法
肾功能正常患者,在不早于第5剂给药前采集谷浓度标本,给药结束后0.5~1 h 采集峰浓度标本。肾功能中、重度减退者,即肾小球滤过率(GFR)<30 mL/min者(包括血透、腹透者),在第2剂给药前后即可采集谷、峰浓度标本。调整给药方案者在调整3~4个剂量后,再次监测血药浓度。
采用化学发光免疫方法快速检测患者血标本中万古霉素浓度,用Abbott Architect I 2000自动免疫分析仪进行快速检测临床标本,可检测范围为3.00~100 mg/L,每批样本同时进行BioRad TDM Control 450质控,质控通过后方可采用检测结果。
1.3 给药方案调整
调整组患者,依据万古霉素TDM 结果及病情需要对给药方案进行调整。使一般感染患者万古霉素谷浓度调整范围为10 mg/L;血流感染、感染性心内膜炎、骨髓炎、脑膜炎患者谷浓度调整范围在15~20 mg/L。
未调整组患者,未根据TDM 结果对给药方案进行相应调整。
1.4 疗效和安全性评价
临床疗效分为治愈和失败。临床治愈为感染患者的临床症状、体征、实验室检查(细菌学检查除外)结果恢复至正常或感染前状态,并且停药7 d内不再需要应用万古霉素。临床失败为应用万古霉素治疗后的症状、体征或实验室检查结果无好转或恶化。
基线病原菌阳性者作细菌学疗效评价,分为细菌清除、假定清除和细菌未清除、假定未清除。经万古霉素治疗后培养转阴者为细菌清除,临床治愈患者无法再次获得病原学检查标本者为细菌假定清除。经万古霉素治疗后病原菌持续存在者为细菌未清除,治疗后临床无效而无法获得标本再次培养者作为假定未清除。细菌清除和假定清除为细菌学有效,细菌未清除和假定未清除为细菌学无效
对于临床疗效和细菌学疗效可以评价者,进行综合疗效评价,分为治愈和失败。综合疗效治愈为临床治愈同时细菌学有效。临床无效或细菌学无效者,综合疗效为失败。
安全性评价是指研究过程中出现的临床不良事件和实验室检查异常。临床不良事件与实验室检查异常具有临床意义与治疗药物相关者,判断为药物相关不良事件。
万古霉素相关性急性肾功能损伤:应用万古霉素患者48 h内血肌酐上升≥26.4μmol/L),或血肌酐较基线上升50%,或尿量减少(<0.5 mL·kg-1·h-1超过6 h)而不能用其他原因解释者[10]。
1.5 统计学方法
统计分析采用STATA12 软件。对数值变量采用t检验或Wilcoxom 秩和检验,对分类变量采用卡方检验或Fisher精确概率检验。队列研究分析使用Log-rank检验、Cox比例风险模型、Kaplan-Meier生存曲线和Fleming-Harrington 检验,计算RR 值和95%可信区间。检验水准P=0.05。
2 结果
2.1 一般资料
调整组患者平均年龄(57.4±16.0)岁、体重指数(BMI)(22.7±4.4)、用药前内生肌酐清除率(Ccr)(114.6±65.6)mL/min。未调整组患者平均年龄(61.6±21.2)岁、BMI(23.3±3.9)、用药前Ccr(94.6±56.7)mL/min,两组差异均无统计学意义。而调整组患者用药后Ccr(124.4±72.7)mL/min较未调整组用药后Ccr(97.4±65.4)mL/min高(P=0.034 5),见表1。
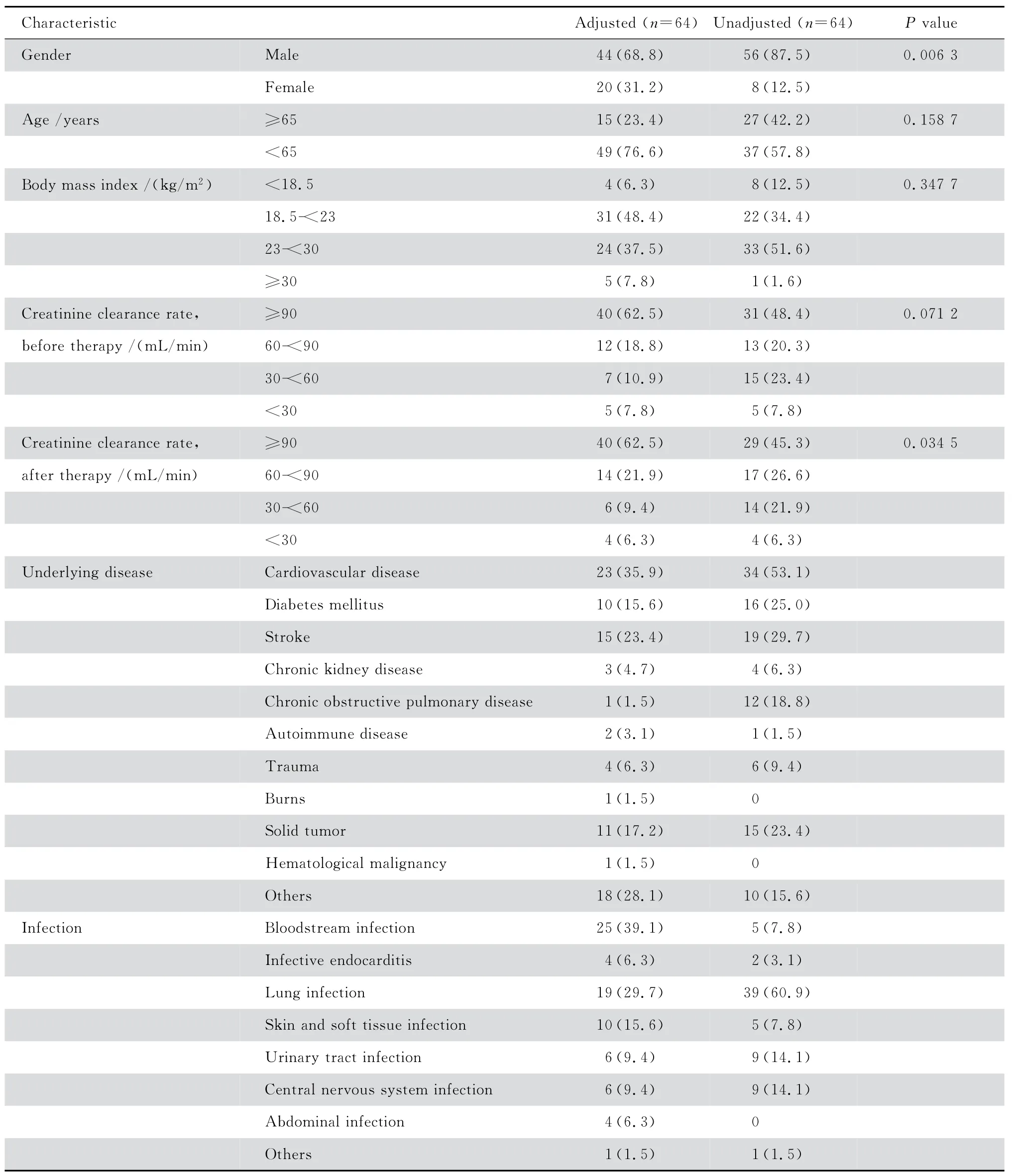
表1 患者人口学与一般临床资料Table 1 Patient demographic and baseline characteristics [n(%)]
调整组64例患者分离病原菌71株,无经验用药病例;未调整组42 例患者分离病原菌48 株,22例为经验用药。具体情况见表2。
调整组疗程(15.4±6.5)d,未调整组疗程(14.8±8.8)d。调整组初始日剂量(1.86±0.50)g,调整后日剂量(1.73±0.66)g,未调整组日剂量(1.03±0.65)g。
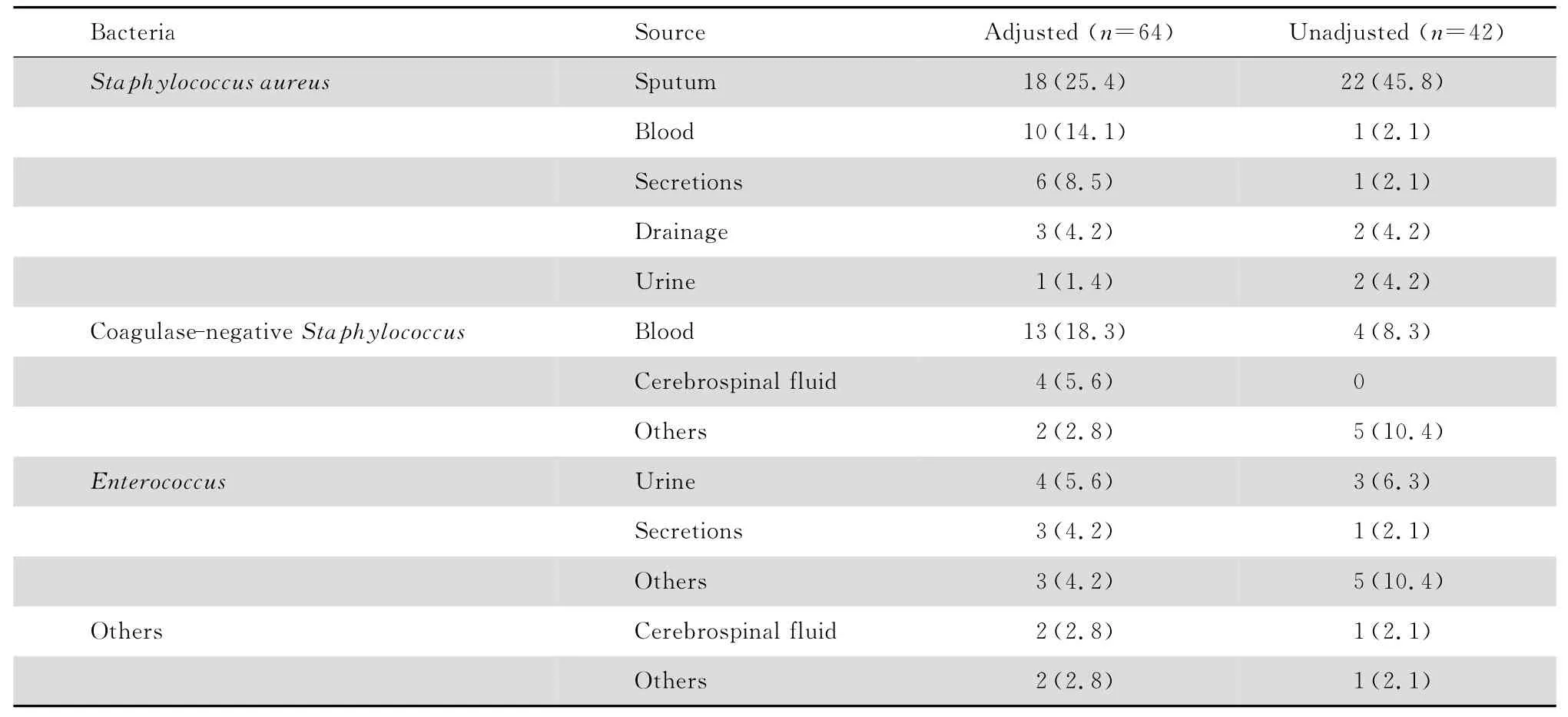
表2 病原菌菌种和来源情况Table 2 Source of pathogenic bacteria [n(%)]
2.2 万古霉素TDM 结果
本研究共获得万古霉素TDM 谷浓度数据191 例次,其中调整组初始谷浓度64 例次,调整后谷浓度64例次,未调整组谷浓度63 例次。如图1所示,调整组初始谷浓度与未调整组无差别(P=0.097 0),但调整组调整后谷浓度较未调整组高(P=0.002 6)。
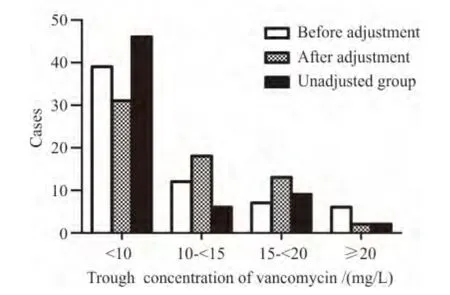
图1 调整组患者调整前后和未调整组患者的万古霉素谷浓度Figure 1 Vancomycin trough concentrations of adjusted group before adjustment and after adjustment and unadjusted group
如图2所示,按给药前Ccr和剂量分层后发现,用药前Ccr相似的患者,调整组万古霉素日剂量不论是初始剂量或是调整后剂量,均高于未调整组(P<0.000 1)。
2.3 疗效分析
如表3,除外细菌学阴性的经验用药患者后,调整组临床治愈率79.7%,未调整组治愈率为75.0%,差异无统计学意义(P=0.531 6)。未调整组的细菌清除率为66.7%,较调整组的细菌清除率85.9%低(P<0.001)。调整组的综合治愈率76.6%,高于未调整组的66.7%(P<0.001)。
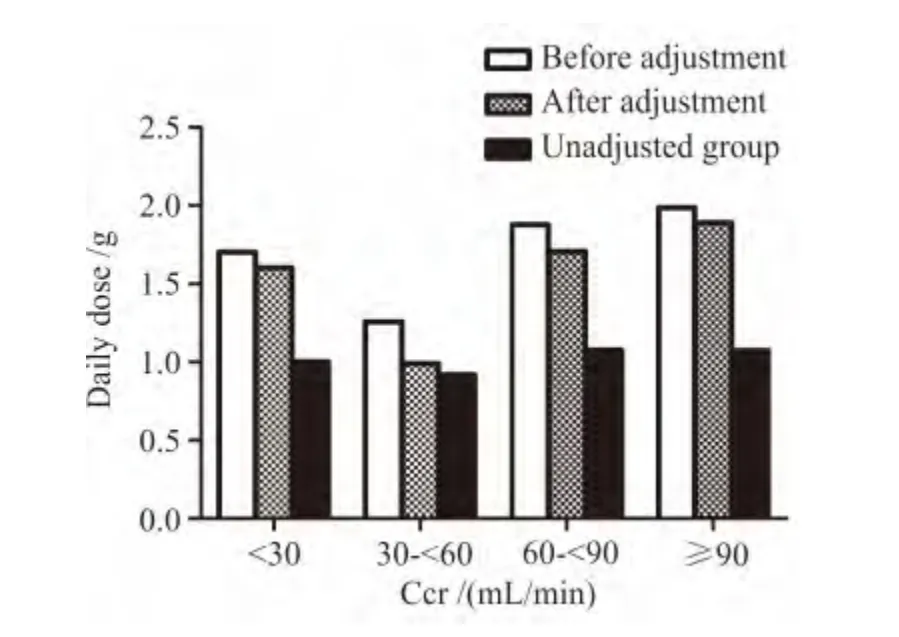
图2 给药前不同Ccr患者的日剂量Figure 2 Daily dose of vancomycin in terms of baseline creatinine clearance
如图3,调整组和未调整组在不同谷浓度水平的细菌清除率有差异(P=0.027)。调整组在谷浓度<10 mg/L、10~<15 mg/L、15~<20 mg/L、≥20 mg/L 区间的细菌清 除率分别 为83.9%、88.9%、84.6%、100%,未调整组则 为66.7%、80.0%、42.9%、100%。但调整组和未调整组在不同谷浓度水平的临床疗效无明显差异。
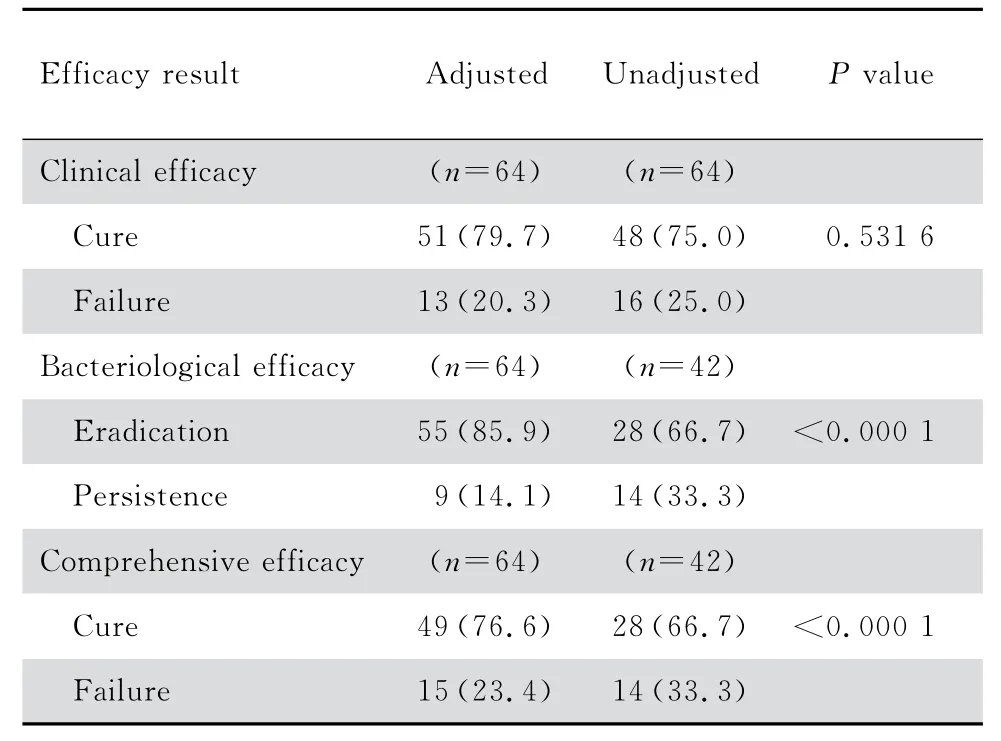
表3 临床疗效、细菌学疗效和综合疗效评价表Table 3 Clinical efficacy,bacteriological efficacy and comprehensive efficacy [n(%)]

图3 万古霉素不同谷浓度的细菌学疗效Figure 3 Bacteriological efficacy in terms of vancomycin trough concentration
2.4 安全性分析
本研究共记录不良事件53 例次,其中调整组33例次,包括10例次临床不良事件和23例次实验室异常;未调整组20例次,包括12例次临床不良事件和8例次实验室异常。判断与药物相关的不良事件18例次,其中调整组11例次,未调整组7例次,见表4。
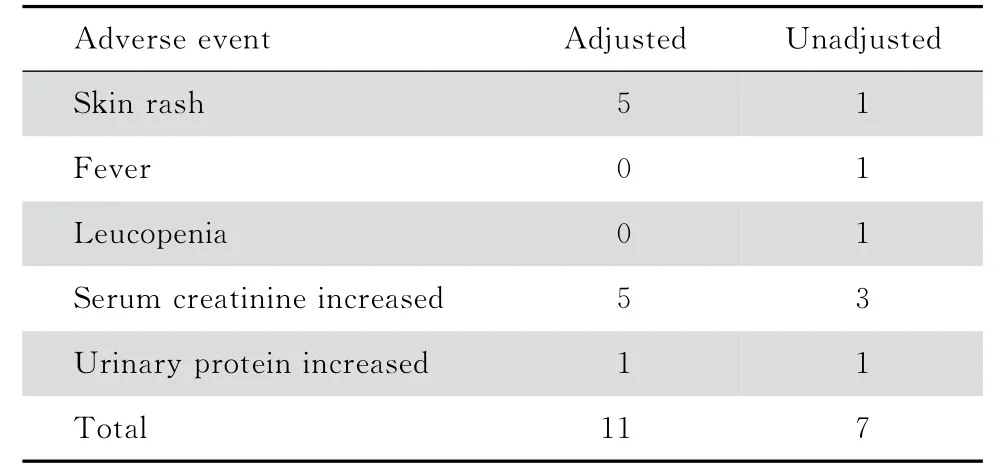
表4 与药物相关的不良事件Table 4 Drug-related adverse events(n)
本研究未观察到患者听力损害相关事件。研究记录的与药物相关血肌酐上升患者,在调整剂量或停药后血肌酐水平均可下降及恢复,未观察到进行性或不可逆血肌酐升高患者。
2.5 Cox比例风险模型
将患者的性别、年龄、BMI、用药前Ccr、用药后Ccr、疗程、日剂量、万古霉素谷浓度、峰浓度以及各个基础疾病、感染部位、病原菌、不良事件分别进行Log-Rank单因素分析,发现相关因素有年龄(P=0.034 6)、疗程(P=0.010 0)、万古霉素谷浓度(P=0.006 1)、峰浓度(P<0.001)、尿路感染(P<0.001)、中枢神经系统感染(P=0.000 4)、心血管疾病(P<0.001)、糖尿病(P=0.004 0)、脑卒中(P=0.002 4)、慢性肾病(P=0.040 4)和粪肠球菌感染(P=0.029 4)。
构建以疗程为时间变量包括是否进行给药方案调整、年龄、万古霉素谷浓度、万古霉素峰浓度、尿路感染、中枢神经系统感染、心血管基础疾病、糖尿病、脑卒中、慢性肾病、粪肠球菌感染等自变量的Cox比例风险模型。从表5可发现,以临床疗效为终点,进行给药方案调整者较不调整者临床失败的相对危险比率(relative risk ratio,RR 值)为0.369(0.218-0.624,P<0.001),即给药方案调整为临床治愈的保护性因素。表6显示,以细菌学疗效作为终点,给药方案 调整的RR 值 为0.418(0.223-0.783,P=0.006 0),仍为患者的保护性因素;而心血管疾病则是细菌未清除的危险因素,RR 值为1.981(1.114-3.525,P=0.020 0)。表7,以综合疗效为终点,给药方案调整的RR 值为0.408(0.215-0.773),P=0.006 0),是总体治愈的保护性因素;总体治疗失败的危险因素则有尿路感染[RR2.252(1.074-4.722),P =0.032 0]和心血 管疾病[RR 1.836(1.010-3.337),P=0.046 0]。从图4可看出,分别以临床疗效、细菌学疗效和综合疗效进行生存分析,调整组患者细菌学疗效优于未调整组(P=0.007 7),综合疗效也优于未调整组(P=0.027 4),临床疗效调整组患者长期预后也优于未调整组但差异无统计学意义(P=0.246 7)。

表5 以临床疗效为终点的Cox比例风险模型Table 5 Cox proportional hazards model for analysis of clinical efficacy
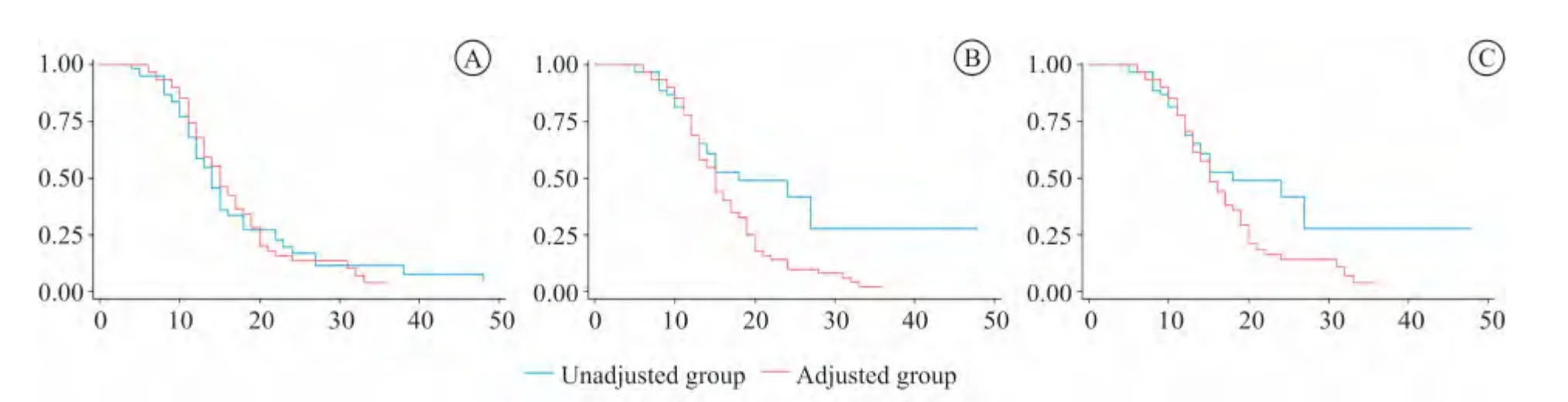
图4 两组患者的Kaplan-Meier生存曲线Figure 4 Kaplan-Meier survival curves for patients with dose adjustment and those without dose adjustment
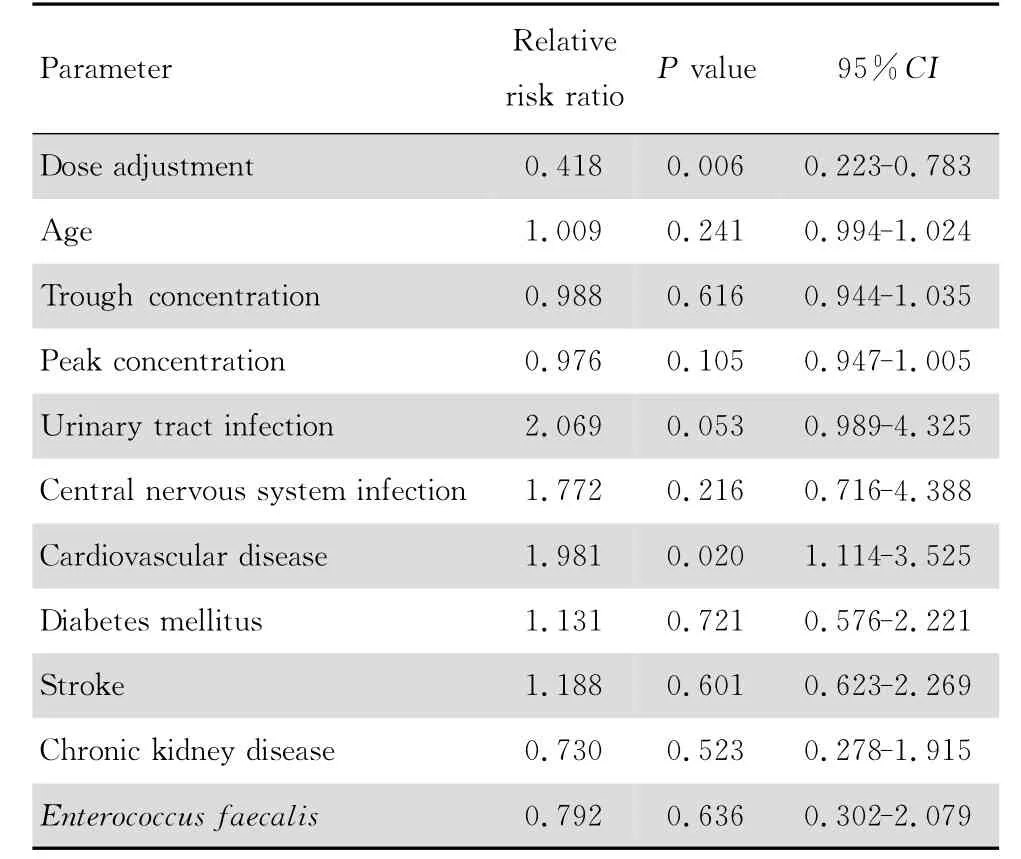
表6 以细菌学疗效为终点的Cox比例风险模型Table 6 Cox proportional hazards model for analysis of bacteriological efficacy
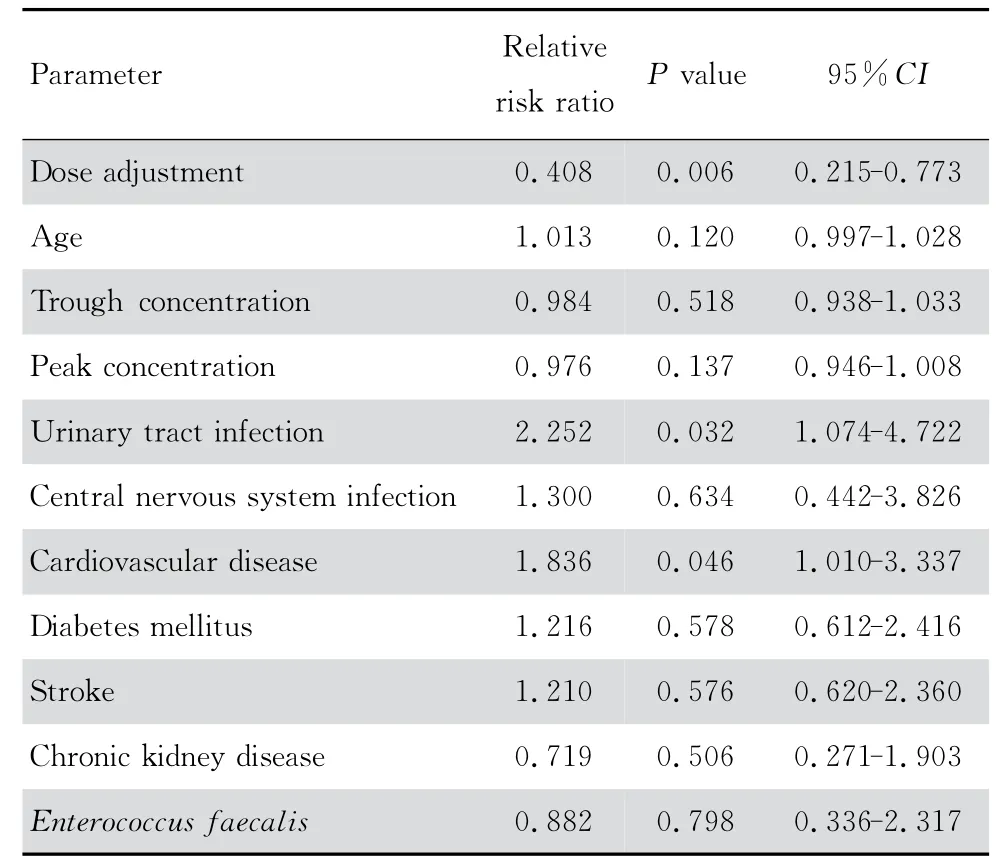
表7 以综合疗效为终点的Cox比例风险模型Table 7 Cox proportional hazards model for analysis of comprehensive efficacy
3 讨论
随着2009年万古霉素应用指南的发布,万古霉素TDM 有了新的谷浓度目标范围>10 mg/L[5],而在此之前国内谷浓度的参考区间大多为5~10 mg/L[7],故本研究的比较队列选择了2005—2009年回顾性数据。根据调整组和未调整组的人口学和一般项目对比统计发现,其基线情况吻合良好,具有较高的一致性。
万古霉素的TDM 结果提示,调整组患者不但调整后谷浓度明显提高(P=0.002 6),而且细菌清除率(P<0.001)和总体治愈率(P<0.001)都优于未调整组的患者,初步显示,根据TDM 结果调整给药方案对提高患者疗效有作用。但值得注意的是调整组和未调整组的临床疗效没有明显差异,其原因可能与暴露队列与比较队列的相关影响因素有关。
因此,进一步构建考虑年龄、血药浓度、感染部位、基础疾病等相关因素的Cox比例风险模型,发现不论以临床疗效、细菌学疗效或综合疗效为终点,调整给药方案都是提示预后较好的保护性因素。而且,基于细菌学疗效和综合疗效的生存曲线也得出了同样的结论,即调整组患者的长期预后优于未调整组患者。所以,在临床实践中根据TDM 结果积极调整患者的万古霉素给药方案,对于患者的预后、病原菌的清除都有重要意义。
由于样本数量有限,安全性分析未发现与药物相关不良事件的发生与患者预后有统计学相关,但调整组记录的不良事件和药物相关不良事件数均高于未调整组。由于本研究未控制患者的合并用药,也只对发生不良事件的患者进行了治疗后随访,并且考虑到前瞻性资料中临床不良事件一般较回顾资料中多,故而尚不能明确万古霉素谷浓度的提高是否会使与药物相关的不良事件增加。中国人群应用万古霉素的安全区间,仍缺乏大样本量临床数据支持,需要进一步的前瞻性临床试验。
[1]Arimura Y,Yano T,Hirano M,et al.Mitochondrial superoxide production contributes to vancomycin-induced renal tubular cell apoptosis[J].Free Radic Biol Med,2012,52(9):1865-1873.
[2]Sakoulas G,Moise-Broder PA,Schentag J,et al.Relationship of MIC and bactericidal activity to efficacy of vancomycin for treatment of methicillin-resistant Staphylococcus aureus bacteremia[J].J Clin Microbiol,2004,42(6):2398-2402.
[3]Bosso J A,Nappi J,Rudisill C,et al.Relationship between vancomycin trough concentrations and nephrotoxicity:a prospective multicenter trial [J].Antimicrob Agents Chemother,2011,55(12):5475-5479.
[4]Elyasi S,Khalili H,Dashti-Khavidaki S,et al.Vancomycin-induced nephrotoxicity:mechanism,incidence,risk factors and special populations.A literature review[J].Eur J Clin Pharmacol,2012,68(9):1243-1255.
[5]Rybak M,Lomaestro B,Rotschafer J C,et al.Therapeutic monitoring of vancomycin in adult patients:a consensus review of the American Society of Health-System Pharmacists,the Infectious Diseases Society of America,and the Society of Infectious Diseases Pharmacists[J].Ame J Health Syst Pharm,2009,66(1):82-98.
[6]Liu C,Bayer A,Cosgrove S E,et al.Clinical practice guidelines by the Infectious Diseases Society of America for the treatment of methicillin-resistant Staphylococcus aureus infections in adults and children[J].Clin Infect Dis,2011,52(3):e18-e55.
[7]陈佰义,管向东,何礼贤,等.万古霉素临床应用中国专家共识(2011 版)[J].中国新药与临床杂志,2011,30(8):561-573.
[8]Hall RG,Giuliano CA,Haase KK,et al.Empiric guidelinerecommended weight-based vancomycin dosing and mortality in methicillin-resistant Staphylococcus aureus bacteremia:a retrospective cohort study[J].BMC Infecti Dis,2012,12:104.
[9]Bailie GR,Neal D.Vancomycin ototoxicity and nephrotoxicity[J].Med Toxicol Adverse Drug Exp,1988,3(5):376-386.
[10]Minejima E,Choi J,Beringer P,et al.Applying new diagnostic criteria for acute kidney injury to facilitate early identification of nephrotoxicity in vancomycin-treated patients[J].Antimicrob Agents Chemother,2011,55(7):3278-3283.

