miR-18b增强乳腺癌MDA-MB-231细胞对顺铂化疗敏感性的作用及其机制
陈竟男,王 杨,金东辉,卢晓梅
(1.吉林大学中日联谊医院特需病房,吉林 长春 130033;2.武警吉林省总队医院内一科,吉林 长春 130052)
RNA干扰是在动植物中普遍存在的机制,RNA干扰在不同水平对基因的表达进行调控。在这些 RNA中,小非编码RNA (microRNA,miRNA),参与基因的表达调控,其基因的改变不仅在肿瘤的起始和发展中扮演重要的角色,而且还参与调控肿瘤的放化疗敏感性[1-2]。最新研究[3]表明:miR-18b在乳腺癌细胞系中表达水平升高,是调节乳腺癌侵袭与转移的相关基因。而miR-18b在乳腺癌的化疗过程中的生物学作用及其机制尚不清楚。本研究旨在阐明miR-18b调节乳腺癌细胞MDA-MB-231的化疗敏感性的可能的作用机制。
1 材料与方法
1.1 细胞、主要试剂与仪器 人乳腺癌细胞MDA-MB-231购自上海复祥生物有限公司。RPMI1640培养基及新生胎儿牛血清购自杭州四季青公司,miR-18bmimics及其抑制剂购自苏州吉玛公司,Lipofectamine 2000转染试剂盒购自美国Invitrogen公司,Dual-Luciferase Report Assay购自美国Promega公司,miScript SYBR Green PCR Kit试剂盒购自中国大连Takara公司,兔抗人Anti-ATM抗体购自英国Abcam公司,GAPDH购自美国Santa公司,羊抗兔购自北京中杉金桥生物技术有限公司,顺铂 (DDP)购自北京中杉金桥生物技术有限公司。用DMEM培养液将DDP配成20mg·L-1溶液储存于4℃恒温,用时稀释到需要的浓度。低温高速离心机MTX-150型购自日本TOMY公司,CO2孵箱购自日本SANYO公司,Mini Trans-Blot电泳转移仪购自美国Bio-Rad公司,JA1203电子天平购自上海精科公司。
1.2 细胞培养 人乳腺癌细胞 MDA-MB-231于含10%胎牛血清的RPMI1640培养基中,在37℃、5%CO2和100%饱和湿度的细胞培养箱中培养,细胞融合达到70%以上,胰酶消化传代培养。
1.3 细胞转染 将处于对数生长期的 MDA-MB-231细胞以每孔2×105种于6孔板中,使之第2天达到60%密度。转染前吸走旧培养液,每孔加双阴 性 培 养 液 1mL。混 合 A 液:5μL(20μmol·L-1)mimc/NC (阴性对照)+200μL RPMI1640 (-/- )。 混 合 B 液:5 μL Lipofectamine 2000+200μL RPMI1640(-/-)。将A和B液混匀,室温放置20min。将混合液滴入6孔板,3h后补液1mL。转染后4h给予0.1、1.0和10.0mg·L-1DDP处理。分别为 MDAMB-231组、MDA-MB-231+DDP组、MDA-MB-231-NC组、MDA-MB-231-NC+DDP 组、MDAMB-231mimic组和 MDA-MB-231mimic+DDP组转染后48h提取细胞的RNA。
1.4 miRNA靶基因生物信息学预测 使用PicTar、DIANA LAB 和 TargetScanHuman 5.1的3个靶基因预测网站,对miRNA-18b的靶基因进行预测,预测结果汇总后,以2或3个网站均预测出的靶基因视为有效靶基因。
1.5 荧光素酶载体构建 ATM 3′UTR上游引物:5′-GCCTCTAGACTCCTGTTCTGTTCAAGTAT-3′;下游引物:5′-GGCCCTCTAGAGCTTTTAGAATTATTTATTC-3′;PCR 法 调 取 目 的片段,酶切回收ATM片段,3′UTR片段与目的载体连接。转化感受态DH5α,挑取单菌落,扩增,提取质粒。送公司测序,确定质粒序列正确。
1.6 荧光素酶报告基因分析 细胞接种于24孔板,每孔转染30ng pMIR-ATM 3′UTR和4ng pRL-SV40,并同时共转染100nmol·L-1miR-18b mimic或NC,每孔转染3复孔。转染后48h应用Dual-Luciferase Report Assay检测试剂盒检测萤烛荧光素酶 (firely luciferase activity)和海肾荧光素酶 (Renilla luciferase activity)的值。以两者的比值为荧光素值。
1.7 qRT-PCR 法 检 测 MDA-MB-231 细 胞 中miR-18b的表达水平 按照Trizol reagent说明书进行MDA-MB-231细胞的RNA抽提。纯度、浓度和完整性均合格的RNA进行逆转录。按照miScript SYBR Green PCR Kit说明书,反应条件:95℃、30s,1个循环;95℃、20s,60℃、30s,45个循环。结果采用比较阈值法2-△△CT计算,△△CT= (实验组目的基因Ct-实验组管家基因Ct)- (对照组目的基因Ct-对照组管家基因Ct)。
1.8 Western blotting法检测 MDA-MB-231细胞中ATM蛋白的表达水平 分装蛋白样品105℃变性5min。电泳条件:80V、2~3h,100V、90min,湿转至醋酸纤维素膜。5%脱脂奶粉封闭1h,一抗过夜,1×TBS洗3次,一次洗10min。二抗作用1h,1×TBS洗3次,一次洗10min。化学发光液作用1min,曝光。采用Quantity one软件进行灰度分析,ATM蛋白表达水平=目的条带灰度值/GAPDH灰度值。
1.9 CCK-8法检测细胞生长抑制率 将转染后24h的活细胞制备成单细胞悬液,计数活细胞后,接种于96孔板 后,将 MDA-MB-231NC 组 和MDA-MB-231mimic组细胞分别给予不同剂量(0.1、1.0 和 10.0mg·L-1)DDP 处理,调整终体积为100μL,置于37℃、5%CO2培养继续培养72h,每孔加入10μL CCK-8试剂,37℃、5%CO2条件下孵育1~3h,用酶标仪测定450nm波长处吸光度 (A)值,计算细胞生长抑制率。细胞生长抑制率= (1-实验组A值/对照组 A值)×100%。
1.10 统计学分析 采用SPSS 17.0统计软件进行统计学处理。荧光素酶活性、细胞生长抑制率、各组 MDA-MB-231细胞中 miR-18b表达水平和ATM蛋白表达水平结果均以表示,组间比较采用单因素方差分析。
2 结 果
2.1 miR-18b靶基因的预测 通过miRNA预测靶基因的生物信息学方法初步预测miR-18b的靶基因。见图1。
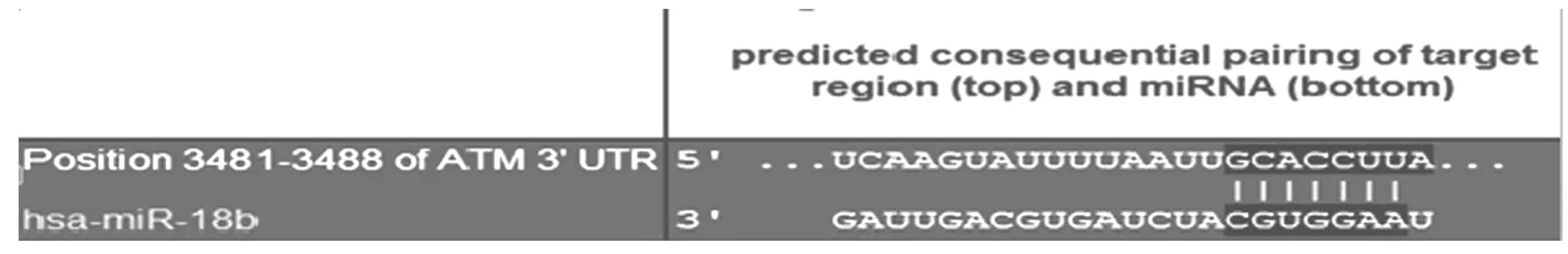
图1 生物信息学法预测miR-18b靶基因示意图Fig.1 Schematic diagram of target genes of miR-18bpredicted by bioinformatics method
2.2 MDA-MB-231细胞中 ATM 3′UTR 载体荧光素 酶 活 性 与 MDA-MB-231-NC 组 (1.00±0.04) 比 较,MDA-MB-231+ mimic 组 pMIRATM荧光素酶活性的相对值 (0.64±0.08)明显降低 (P<0.05)。
2.3 MDA-MB-231细胞中 miR-18b的表达水平实时定量PCR法检测乳腺癌MDA-MB-231细胞中miR-18b的相对表达水平,与 MDA-MB-231组比较, MDA-MB-231 + DDP 组、 MDA-MB-231 mimic组和 MDA-MB-231mimic+DDP组细胞中miR-18b的表达水平明显升高 (P<0.05)。与MDA-MB-231-NC 组 比 较,MDA-MB-231mimic组细胞中 miR-18b表达水平升高20倍以上,MDA-MB-231mimic+DDP组细胞中 miR-18b表达水平升高60倍以上 (P<0.05)。见表1。
表1 各组 MDA-MB-231细胞中miR-18b表达水平Tab.1 Expression levels of miR-18bin MDA-MB-231cells in various groups ()

表1 各组 MDA-MB-231细胞中miR-18b表达水平Tab.1 Expression levels of miR-18bin MDA-MB-231cells in various groups ()
* P<0.05compared with MDA-MB-231group;△ P<0.05 compared with MDA-MB-231-NC group.
Group Expression level of miR-18b MDA-MB-231 1.00±0.00 MDA-MB-231+DDP 4.32±0.41*MDA-MB-231-NC 1.83±0.03 MDA-MB-231mimic 40.21±0.15*△MDA-MB-231mimic+DDP 112.32±0.13*△
2.4 MDA-MB-231细胞中ATM蛋白的表达 与MDA-MB-231组 比 较,MDA-MB-231 + DDP 组细胞中ATM蛋白表达水平明显增加 (P<0.05);与 MDA-MB-231-NC 组 比 较, MDA-MB-231 mimic组细胞中ATM蛋白表达水平明显降低(P<0.05);与 MDA-MB-231-NC+DDP组比较,MDA-MB-231mimic+DDP组细胞中 ATM 蛋白表达水平进一步降低 (P<0.05)。见图2和表2。

图2 各组MDA-MB-231细胞中ATM蛋白表达电泳图Fig.2 Electrophoregram of expressions of ATM protein protein in MDA-MB-231cells in various groups
表2 各组MDA-MB-231细胞中ATM蛋白表达水平Tab.2 Expression levels of ATM protein in MDA-MB-231 cells in various groups ()

表2 各组MDA-MB-231细胞中ATM蛋白表达水平Tab.2 Expression levels of ATM protein in MDA-MB-231 cells in various groups ()
* P<0.05compared with MDA-MB-231group;△ P<0.05 compared with MDA-MB-231-NC group;#P<0.05compared with MDA-MB-231-NC+DDP group.
Group Expression level of ATM protein MDA-MB-231 1.00±0.08 MDA-MB-231+DDP 2.20±0.06*MDA-MB-231-NC 1.00±0.12 MDA-MB-231mimic 0.63±0.11△MDA-MB-231-NC+DDP 1.00±0.16 MDA-MB-231mimic+DDP 0.49±0.09#
2.5 各组 MDA-MB-231细胞生长抑制率 经不同 浓 度 DDP 处 理 后, 与 MDA-MB-231-NC 组(33.0% ±12.0%、40.0% ±9.0%、65.0% ±11.0%)比较,MDA-MB-231mimic组 MDA-MB-231细胞生长的抑制率 (38.0%±9.0%、52.0%±8.0%、71.0%±10.0%)均增高,说明转染miR-18amimic后,MDA-MB-231细胞对 DDP化疗敏感性升高。
3 讨 论
乳腺癌是严重危害女性健康的恶性肿瘤之一,同时也是全世界女性发病率最高的癌症,根据美国最新的癌症统计资料[4]显示:美国2013年的乳腺癌发病率仍占女性恶性肿瘤发病率的第1位,死亡率第2位,在我国乳腺癌发病率也有逐年上升的趋势。目前认为在乳腺癌治疗中,雌激素受体(ER)、孕激素受体 (PR)和生长因子受体(HRE2)的表达是预后的重要指标,而三者均呈阴性表达的乳腺癌是一种特殊亚型,与其他乳腺癌亚型比较,采用内分泌治疗及针对HER2的分子靶向药物治疗方法均无效[5-6],目前针对该亚型的治疗手段仍为全身化疗。Sirohi等[7]报道三阴性乳腺癌对以铂类为基础的化疗方式敏感,病理完全缓解率为88%。Garber等[8]进行的临床试验观察铂类在三阴性乳腺癌中的疗效,也发现DDP治疗乳腺癌的临床有效率和病理缓解率高,毒副作用少。以铂类为基础的新辅助化疗与非铂类方案治疗局部晚期三阴性乳腺癌患者,含铂类方案的疗效优于非铂类方案,以上研究均表明DDP在三阴性乳腺癌化疗中有效。因此在保证患者生命质量前提下,提高DDP对三阴性乳腺癌的化疗敏感性、增强DDP对三阴性乳腺癌细胞的杀伤作用、改善患者预后和延长生存期成为目前医学界研究的热点。
miRNA作为一种重要的转录后调节因子,参与了相关基因调控的一系列过程,扮演着重要角色。石永国等[9]研究表明:miR-206能显著抑制三阴性乳腺癌MDA-231细胞的增殖能力,其深层机制可能和细胞周期蛋白cyclin D2表达下调有关联。Zhao等[10]研究证实:靶向抑制肿瘤抑制基因miR-450b-3p能有效地抑制乳腺癌细胞的增殖。Bischoff等[11]发现:下调miR-149能通过激活Rac来促进肿瘤细胞远处转移,而增加miR-149的表达水平则抑制了乳腺癌细胞转移。项丹等[12]发现:DDP联合西达本胺能显著降低三阴性乳腺癌MDA-MB-231细胞中切除修复交叉互补基因1(ERCC1)的表达水平,从而在体外发挥抑制其增殖分裂的作用。而张梦怡等[12]研究显示:DDP联合多肽P161能增加乳腺癌细胞株的化疗敏感性,其机制可能与细胞早期凋亡有密切关联。
miR-18b是一种参与基因调控的转录后调节因子[14-17],调节转录的机制尚未明确。本研究显示:转 染 miR-18bmimic 后,MDA-MB-231 细 胞 中miR-18b的表达水平显著高于对照组,且上调程度呈剂量依赖性。而过表达miR-18b可以增强MDAMB-231细胞的化疗敏感性。本研究采用生物信息学方法预测靶基因,双荧光素酶基因报告验证靶基因,Western blotting方法检测 MDA-MB-231细胞中miR-18b和ATM蛋白的表达,初步验证了ATM可能是miR-18b的靶基因。本实验的意义在于首次证实过表达miR-18b可以显著提高乳腺癌细胞对DDP的化疗敏感性,其机制可能通过调控ATM来发挥作用。
[1]Dar A,Ma S,Rittsteuer C,et al.The role of miR-18bin MDM2-p53pathway signaling and melanoma progression [J].Natl Cancer Inst,2013,105 (6):433-442.
[2]Cookson VJ,Bentley MA,Hogan BV,et al.Circulating microRNA profiles reflect the presence of breast tumours but not the profiles of microRNAs within the tumours [J].Cell Oncol,2012,35 (4):301-308.
[3]Fonseca-Sanchez MA,Perez-Plasencia C,Fernandez-Retana J,et al.microRNA-18bis upregulated in breast cancer and modulates genes involved in cell migration [J].Oncol Rep,2013,30 (5):2399-2410.
[4]Siegel R, Naishadham D, Jemal A, et al. Cancer statistics[J].CA Cancer Clin,2013,63 (1):11-30.
[5]Yadav BS,Sharma SC, Chanana P,et al. Systemic treatment strategies for triple-negative breast cancer [J].Clin Oncol,2014,5 (2):125-133.
[6]Hoeferlin LA,E Chalfant C,Park MA.Challenges in the treatment of triple negative and HER2-overexpressing breast cancer[J].Surg Sci,2013,1 (1):3-7.
[7]Sirohi B.Amedos M,Popat S,et al.Platinum based chemotherapy in triple negative breast carcer [J].Ann Oncol,2008,19 (11):1847-1852.
[8]Bouchalova K,Kharaishvili G,Bouchal J,et al.Triple negative breast cancer-BCL2in prognosis and prediction [J].Review,2014,15 (12):1166-1175.
[9]石永国,卞卫和,何 烨,等.miR-206对三阴性乳腺癌细胞的增殖抑制作用及初步机制研究 [J].临床肿瘤学杂志,2013,18 (12):1062-1065.
[10]Zhao Z,Li R,Sha S,et al.Targeting HER3with miR-450b-3p suppresses breast cancer cells proliferation [J].Cancer Biol Ther,2014,15 (10):1404-1412.
[11]Bischoff A,Huck B,Keller B,et al.miR-149functions as a tumor suppressor by controlling breast epithelial cell migration and invasion [J].Cancer Res,2014,74 (18):5256-5265.
[12]项 丹,姜 藻,顾晓怡.西达本胺联合顺铂对三阴性乳腺癌细胞株 MDA-MB-231的体外抗增殖作用及其机制的研究 [J].东南大学学报:医学版,2013,32 (3):283-288.
[13]张梦怡,陈 鹰,陈建华,等.多肽P161联合顺铂对乳腺癌 MA-782细胞株增殖和凋亡的影响 [J].中国药师,2013,16 (12):1768-1771.
[14]Bennett PE,Bemis L,Norris DA,et al.miR in melanoma development:miRNAs and acquired hallmarks of cancer melanoma [J].Physiol Genomics,2013,45 (22):1049-1059.
[15]Murakami Y,Tamori A,Itami S.The expression level of miR-18bin hepatocellular carcinoma is associated with the grade of malignancy and prognosis[J].BMC Cancer,2013,99 (13):1471-1482.
[16]章国晶,郭 放,谢晓东.2012版美国国立综合癌症网络乳腺癌指南更新要点及研究进展荟萃 [J].中国实用内科杂志,2013,33 (2):127-130.
[17]史中平,周建荣.乳腺化疗相关症状随疗程的变化趋势 [J].中国老年学杂志,2013,33 (10):2346-2348.

