PPARγ配体-吡格列酮在放射治疗中对小鼠结肠癌细胞的作用
潘 洁 毕 怡 任玉欣 曹峰林 张大昕
长期以来,恶性肿瘤居我国居民死亡原因之首。放射治疗是治疗恶性肿瘤的重要手段之一,但腹部和盆腔肿瘤的放疗往往受腹腔正常组织和器官的耐受量限制而不能达到肿瘤的根治剂量,影响了肿瘤的局部控制率;既使控制局部放疗剂量在正常组织放射耐受量范围内,也必然造成正常组织的放射损伤。因此,如何降低正常组织的损伤,提高肿瘤的局部控制率,成为肿瘤治疗的难题。PPARγ具有抑制炎症反应,抗纤维化,诱导肿瘤细胞分化和凋亡,抑制肿瘤血管生成及侵袭转移等作用,理论上为解决正常组织放射性损伤,提高局部肿瘤治愈率,抑制肿瘤发展进程提供了可能,已成为抗肿瘤治疗的新靶点,但是PPARγ活化后对肿瘤细胞在放射损伤中相关因子的变化的影响还鲜有报道。本研究中,我们通过观察PPARγ配体对放疗诱导的小鼠结肠癌细胞相关因子COX-2和PAI-1的影响,探讨PPARγ配体在肿瘤放射治疗中对肿瘤细胞的作用,为开发新的可以联合放疗抗肿瘤的药物提供临床前资料。
1 材料与方法
1.1 主要试剂
吡格列酮购自江苏豪森药业,DMSO购自Sigma公司,10%灭活胎牛血清和1640培养液购自GIBCO/BRL公司,TRIZOL购自美国Invitrogen,MTT购自Amresco公司,兔抗鼠PAI-1多克隆抗体、山羊抗鼠COX-2多克隆抗体购于Santa Cruz公司,兔抗鼠β-actin单克隆抗体购于Cell Signaling公司,兔抗山羊、山羊抗兔二抗购于北京中山公司。BCA蛋白浓度测定试剂盒及BeyoECL Plus购于碧云天公司。
1.2 细胞培养
小鼠结肠癌细胞(CT-26 cell)、细胞系购于美国ATCC公司(American Type Culture Collection),培养液成分为:10%胎牛血清(1640)、2‰双抗、L-谷氨酰胺300 mg/L、丙酮酸钠110 mg/L、碳酸氢钠 30 mg/L、50%葡萄糖5 ml/L、HEPES Buffer 10 ml/L。细胞于37℃、5%CO2条件下培养,每2~3天换液1次,细胞至70%~90%融合时按一定比例传代,传代时用胰酶消化适当时间加入其培养液停止消化,放入离心机1 500 rpm,离心5 min,取出弃上清,加适量培养液轻轻吹打成细胞悬液,移至培养瓶,放入CO2孵箱中培养,使用对数生长期细胞完成实验。
1.3 细胞照射及药物处理
细胞照射采用X线,室温下照射。细胞生长到70%融合状态时更换无血清培养基饥饿培养22 h,给药处理9 h后照射,如无药物处理则无血清培养基孵育22 h后照射。Pioglatazone浓度为20 μmol/L,DMSO终浓度<0.4‰。照射结束后不更换培养基,将细胞送回CO2孵箱,按实验设计时间分别于照射后2 h、7 h、24 h、48 h 收取样品。
1.4 细胞总RNA提取
细胞处理后去除细胞培养基,用PBS洗2次,然后在T25培养瓶中加入1ml Trizol(美国Invitrogen)轻摇培养瓶,室温5 min,将液体转移至离心管中,加入200 μl氯仿,剧烈震动 15 s,室温放置 3 min,12 000 rpm,4℃。离心15 min,吸出上层水相移至离心管,再加入0.5 ml异丙醇,充分混匀后室温放置10 min,12 000 rpm,4℃。离心10 min,弃上清,RNA沉于管底,用1 ml 75%乙醇轻轻冲洗,8 000 rpm,4℃。离心5 min,尽量弃上清,加入 DEPC水溶解 RNA,酶标仪A260、A280检测RNA纯度和浓度,-80℃冰箱长期保存。
1.5 RT-PCR
逆转录:取500 μg的RNA样品反转录成cDNA,按逆转录试剂盒(TaKaRa:DRR037A)总反应体积10 μl加入反转录酶和引物,37℃15 min,85℃5 s,得到cDNA。PCR扩增:用扩增试剂盒(TaKaRa:DRR003A)中 PremixTaq12.5 μl,得到的 cDNA2 μl,上下游引物(20 μM)各 0.5 μl,补足灭菌蒸馏水至 25 μl。引物序列分别为 PPARγ(Mouse):顺式为 5'-TTTTCAAGGGTGCCAGTTTC-3 ';反 式 为 5 '-AATCCTTGGCCCTCTGAGAT-3',扩增片断长 198 bp。GAPDH(Mouse)顺式为 5'-AACTTTGGCATTGTGGAAGG-3';反式为 5'-GGACACATTGGGGGTAGGAACA-3',扩增片断长 225 bp。反应条件为95℃、5 s 1个循环,95℃、5 s;58℃、30 s;72℃、30 s,30个循环。PCR完成后反应产物用3%的琼脂糖凝胶电泳显示PCR产物。用凝胶成像系统(美国BIO-RAD公司)分析结果。
1.6 MTT 法
将CT-26细胞培养于1640完全培养基中,取对数生长期细胞制成单细胞悬液,调整细胞密度为2×104/ml,按每孔200 μl接种于96孔板中,在含10%胎牛血清的1640培养液中孵育24 h,然后换0.1%血清1640培养液继续孵育24 h使细胞同步,按预先的实验设计向相应孔内加入不同浓度的吡格列酮(3,30,300,3000,30 000 μmol/L),孵育 24 h 后每孔内加入20 μl MTT溶液(5 g/L),孵育4 h,吸尽各孔内溶液,加入 DMSO150 μl,充分振荡10 min,酶联免疫仪上选用490 nm波长测定每孔的吸光度值(A)。每组设6个重复孔。
1.7 细胞总蛋白提取
倾去细胞培养基,用0.5%NaCl冲洗2次,吸去残余液体,用细胞刮将细胞刮至培养皿一侧,然后加入200 μl细胞裂解液 (碧云天P0013),吹打均匀,冰浴30 min,将液体转移至Eeppendorff管中,放入离心机中12 000 rpm,4℃,离心5 min.,吸取上清分装于 Eeppendorff管中,-80℃冰箱长期保存。
1.8 蛋白浓度的测定
使用BCA蛋白浓度测定试剂盒(碧云天P0012)测蛋白浓度,按A∶B=50∶1配制BCA工作液,用PBS稀释蛋白标准品,使其终浓度为0.5 mg/ml,将标准品按 0、1、2、4、8、12、16、20 μl加入到 96 孔板中,用PBS 补足到20 μl,加2 μl样品于96 孔板中,用PBS 补足到20 μl,每个孔重复2次,各孔加入200 μl BCA 工作液,室温放置2 h,酶标仪测定562 nm吸光值,制作标准曲线,计算样品的浓度。
1.9 Western Blot检测
各组取总蛋白30 μg经SDS-PAGE电泳,然后转至NC膜。NC膜以5%脱脂奶封闭,而后加入特异性的一抗和二抗。以BeyoECL Plus发光检测信号强度。以β-actin作为上样量的参照。
1.10 统计分析
应用SPSS 13.0软件进行统计分析,所有实验数据均以s表示。两组间比较采用t检验,P<0.05具有统计学意义。
2 结果
2.1 小鼠结肠癌细胞中PPARγmRNA的表达
PPARγ扩增片断长198bp,GAPDH扩增片断长225 bp,Marker:200 bp,见图1。
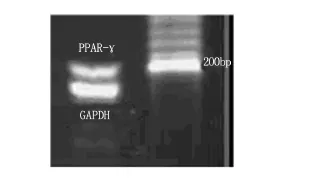
图1 小鼠结肠癌细胞的PPARγmRNA表达
2.2 10 Gy照射与吡格列酮联合对小鼠结肠癌细胞生长的影响
10 Gy照射﹑吡格列酮可以降低CT-26细胞存活率,10 Gy照射+吡格列酮处理时CT-26细胞存活率降低更为明显,见图2。
2.3 PPARγ联合放疗对CT-26细胞中COX-2蛋白的影响
10 Gy X射线照射后COX-2蛋白表达水平升高,照射后24 h的COX-2蛋白表达水平最高(图3),吡格列酮对照射诱导的COX-2蛋白水平升高无明显影响(图4)。
2.4 PPARγ联合放疗对CT-26细胞中PAI-1蛋白表达的影响
照射后24 h PAI-1表达水平明显增高,吡格列酮对照射诱导的PAI-1表达水平升高起抑制作用,见图5。
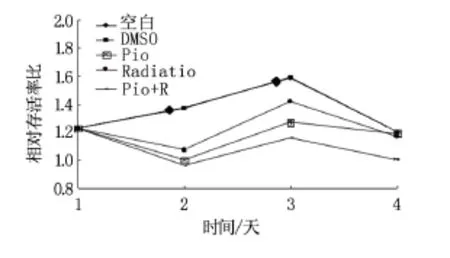
图2 10 Gy照射与吡格列酮联合对小鼠结肠癌细胞生长的影响

图3 10 Gy照射后COX-2蛋白表达Western结果

图4 10 Gy照射后24 h组COX-2蛋白表达Western结果

图5 10 Gy照射后24 h组PAI-1蛋白表达Western结果
3 讨论
在肿瘤放射治疗时,如何使肿瘤细胞快速死亡,同时又不使正常组织细胞受到影响,或将影响减少到最低程度,一直是人们考虑的焦点问题。随着对PPARγ的深入研究,其抑制炎症因子生成及炎症形成、抑制肿瘤生长、增殖与转移,抑制肿瘤血管生长,并促进肿瘤细胞的分化和凋亡等多方面的作用,给人们一个新的研究视野。
COX-2作为花生四烯酸合成各种内源性前列腺素过程中的限速酶,在肿瘤发生发展中的作用机制尚不清楚,但在肿瘤组织中高表达,表达强度与肿瘤组织类型和分化程度相关,且在细胞周期调控、免疫抑制、细胞凋亡前致癌物活化、促进肿瘤新生血管生成以及促进肿瘤浸润转移等方面与肿瘤相关。在很多组织中,紫外线﹑放射线可引起COX-2的表达和前列腺素的增加。在离体实验中,Raju等[1]运用SC-236(一种特异性COX-2抑制剂)处理小鼠肉瘤细胞3天,该细胞对射线的敏感性明显升高。且许多研究表明COX-2抑制剂在提高肿瘤放射敏感性的同时不增加对正常组织的放射损伤,甚至对正常组织有放射保护作用[2]。PPARγ通过NF-KappaB和AP-1途径对放疗诱导的小神经胶质细胞COX-2表达升高起抑制作用[3]。对人类及小鼠的模型研究显示了COX-2和PPARγ途径的相关性[4],例如:活化的 PPARγ 可以抑制 COX-2[5],而抑制COX-2可激活PPARγ[6],COX-2抑制剂发挥类似PPARγ 激活剂的作用[7],PPARγ 激动剂部分抑制COX-2的表达和PGE2的合成[8];但PPARγ配体是否直接抑制COX-2 mRNA及蛋白的表达还存在争议。在本实验中,X射线照射可引起小鼠结肠癌细胞COX-2蛋白表达水平升高,在24 h达到高峰后逐渐回落,这与有关实验的报道是一致的。但是在24 h组,吡格列酮处理后对放疗引起的COX-2水平升高无明显作用,考虑可能是由于肿瘤细胞的表达的特异性,及对药物的敏感性不同所致,体外实验毕竟脱离生物体的内环境调控,其实验结果能否在动物体内实验相吻合,也需要进一步验证。
放疗后引起的氧化还原反应加强PAI-1的转录。在小鼠放射性肠炎模型中,放疗能够诱导上皮细胞表达 PAI-1[9]。有学者的实验结果显示,PPARγ 配体(Pioglitazone 10mmol/L)不仅在mRNA水平,而且在蛋白水平降低137 Cs照射诱导的肾小球膜细胞纤溶酶原激活剂抑制因子1(PAI-1)基因的过度表达,也证实了照射可以诱导肾小球膜细胞PAI-1过度表达,并且呈剂量依赖性[9]。在头颈部鳞状细胞癌细胞BHY和FaD 中,给予0,2,5,10 Gy放疗,放疗后45 h 可以观察到与0 Gy组相比,PAI-1的表达呈剂量依赖性增高,10 Gy组可高达6.5 倍[10]。uPA、uPAR、RA I-1 表达增强是恶性肿瘤的特征之一。研究表明,PAI-1在多种肿瘤组织中大量表达,且是预后差的指标。Kohler等[11]报道,子宫内膜癌中的PAI-1组织浓度较未受浸润的内膜明显升高,且分化愈差,PAI-1浓度愈高。此后,Tecimer等[12]也发现子宫内膜癌的PAI-1表达与肿瘤的分期、分级呈明显正相关,分期越晚,分级越差的病例,PAI-1的组织浓度越高。有复发的患者其PAI-1显著升高。在卵巢肿瘤的研究中,有报道认为PAI-1可作为提示浸润性卵巢癌不良预后的独立指标。目前的研究表明,PAI-1可能通过抑制肿瘤细胞凋亡而促进肿瘤细胞生长,因此是肿瘤发生时的一个不祥预兆因子。Kwaan等[13]发现,在培养的人前列腺癌PC-3细胞株及人的白血病HL-6细胞株中增加一个稳定剂量的PAI-1,就抑制了由喜树碱等诱导的肿瘤细胞凋亡,如果在培养液中加入PAI-1特异性单克隆抗体后,PAI-1就不能抑制肿胞细胞的凋亡。因此抑制体内PAI-1的活性,以促进肿瘤细胞的凋亡可能是治疗肿瘤的一条新途径。在成心肌细胞中,15-脱氧前列腺素J2和环格列酮能够通过激活PPAR-γ受体,降低PAI-水平[14],在胰腺癌细胞中,15-脱氧前列腺素J2和环格列酮能够通过激活PPAR-γ受体,提高PAI-1表达水平,降低uPA表达水平,这种作用在PPAR-γ基因敲除小鼠或使用PPAR-γ药理抑制剂时消失[15]。X射线放射治疗后24h可引起小鼠结肠癌细胞PAI-1蛋白表达水平显著升高,吡格列酮可以明显降低放疗引起的PAI-1蛋白表达水平升高,说明吡格列酮在肿瘤放疗中可能通过促进肿瘤细胞凋亡改善肿瘤的预后而发挥潜在的协同作用。进一步实验继续研究PAI-1表达变化的机理及吡格列酮作用机制。
[1]Raju U,Nakata E,Yang P,et al.In vitro enhancement of tumor cell radiosensitivity by a selective inhibitor of cyclooxygenase-2 enzyme:mechanistic consideration〔J〕.Int J Radiation Oncology Biol Phys,2002,54(3):886-894.
[2]Kohno H,Suzuki R,Sugie S,et al.Suppression of colitis-related mouse colon carcinogenesis by a COX-2 inhibitor and PPAR ligands〔J〕.BMC Cancer,2005,5:46.
[3]Ramanan S,Kooshki I,Zhao WP,et al.PPAR-alpha ligands inhibit radiation-induced microglial inflammatory responses by negatively regulating NF-kappaB and AP-1 pathways〔J〕.Free Radic Biol Med,2008,45(12):1695-1704.
[4]Yang WL,Frucht H.Activation of the PPAR pathway induces apoptosis and COX-2 inhibition in HT-29 human colon cancer cells〔J〕.Carcinogenesis,2001,22(4):1379-1383.
[5]Clay CE,Namen AM,Atsumi G,et al.Influence of J series prostaglandins on apoptosis and tumorigenesis of breast cancer cells〔J〕.Carcinogenesis,1999,20(6):1905-1911.
[6]Davis CD,Johnson WT.Dietary copper affects azoxymethane-induced intestinal tumor formation and protein kinase C isozyme protein and mRNA expression in colon of rats〔J〕.J Nutr,2002,132(7):1018-1025.
[7]Subbaramaiah K,Lin DT,Hart JC,et al.Peroxisome proliferator-activated receptor gamma ligands suppress the transcriptional activation of cyclooxygenase-2.Evidence for involvement of activator protein-1 and CREB-binding protein/p300〔J〕.J Biol Chem,2001,276(8):12440-12448.
[8]Scharpfenecker M,Kruse JJ,Sprong D,et al.Essential role of plasminogen activator inhibitor type-1 in radiation enteropathy〔J〕.Am J Pathol,2008,172(3):691-701.
[9]张大昕,赵蔚玲.PPARγ配体降低137Cs照射诱导的PAI-1高表达〔J〕.中华放射肿瘤学杂志,2005,14(4):357-361.
[10]Schilling D,Bayer C,Geurts-Moespot A,et al.Induction of plasminogen activator inhibitor type-1(PAI-1)by hypoxia and irradiation in human head and neck carcinoma cell lines〔J〕.BMC Cancer,2007,7(11):143-154
[11]Kohler U,Hiller K,Martin R.Tumor associated proteolytic factors u-PA and PAI-1 in endometrial carcinoma〔J〕.Gynecol Oncol,1999,66(2):268-274.
[12]Tecimer C,Doering D,Goldsmith L.Clinical relevance of urokinase type plasminogen activator,its receptor,and its inhibitor type 1 in endometrial cancer〔J〕.Gynecol Oncol,2001,80(1):48-55.
[13]Kwaan HC,Wang J,Svoboda K,et al.Plasminogen activator inhibitor 1 may promote tumour growth through inhibition of apoptosis〔J〕.Br J Cancer,2000,82(10):1702-1708.
[14]Hao GH,Niu XL,Gao DF,et al.Agonists at PPAR-γ suppress angiotensin II-induced production of plasminogen activator inhibitor-1 and extracellular matrix in rat cardiac fibroblasts〔J〕.Br J Pharmacol,2008,153(7):1409-1419.
[15]Sawai H,Liu J,Reber HA,et al.Activation of peroxisome proliferator-activated receptor-γ decreases pancreatic cancer cell Invasion through modulation of the plasminogen activator system〔J〕.Mol Cancer Res,2006,4(3):159-167.

