耐受乙醇乳酸菌诱变的研究
王晓雯,蒋彩虹,卢士玲,芦文娟,杜紫萱,黎 旭,李宝坤*
(石河子大学食品学院,新疆石河子832000)
耐受乙醇乳酸菌诱变的研究
王晓雯,蒋彩虹,卢士玲,芦文娟,杜紫萱,黎旭,李宝坤*
(石河子大学食品学院,新疆石河子832000)
以面包乳杆菌(Lactobacillus crustorumD2-5)和植物乳杆菌(Lactobacillus plantarumD5-5)为研究对象,分别选取不同浓度乙醇胁迫处理后,进行诱变育种,探究经乙醇胁迫后乳酸菌诱变育种的耐受性;根据最佳诱变剂量的条件,确定最佳诱变方法;以乙醇胁迫处理后乳酸杆菌的生长曲线,验证乙醇胁迫后乳酸菌诱变菌株的耐受性。结果表明:添加与乳酸菌悬浮液等体积的1%硫酸二乙酯(DES)化学诱变效果最佳,最适诱变时间为40 min,乙醇胁迫过程中诱变菌株的生长速率有所提高,以体积分数8%乙醇胁迫为例,24 h时,D2-5菌落总数的对数值由6.2提高至7.3,D5-5菌落总数的对数值由6.9提高至7.1。说明诱变育种有助于乳酸杆菌乙醇胁迫耐受性的提高,并获得乙醇耐受特性较好的菌株D2-5。
乳酸菌;乙醇胁迫;诱变育种;耐受性
乳酸菌是革兰氏染色阳性的杆菌或球菌,对葡萄糖发酵能产生50%以上乳酸的一类微生物的总称[1]。这些微生物类群有着一些共同的特征,如不产孢子、厌氧或兼性厌氧、接触酶为阴性、没有细胞色素、革兰氏阳性杆菌或球菌等。人类自古就利用乳酸菌来保存食物,提高食品的风味和改善食品的品质[2]。由于这些细菌可以耐受较低的pH值,直到19世纪中叶,才在食品微生物发酵的过程中被发现[3]。许多乳酸菌被公认为安全的食品成分[4]。优良乳酸菌应该具有良好的发酵性能和较强的耐受性,从而确保发酵制品被食用后能在胃肠道中定植,这是益生乳酸菌发挥作用的关键[5]。
由于外界各种不良环境的胁迫及不利因素的影响,严重地限制了乳酸杆菌的生长及代谢能力,进而影响了益生功能的发挥,抑制了高效活性的利用[6]。发酵制品通常都由乳酸菌与酵母菌共同发酵而成[7],其发酵过程中所产生的代谢产物,造成生存环境不断改变,菌体不可避免的受到各种胁迫条件的影响,如温度、pH值、乙醇、渗透压等,其中乙醇是最常见的胁迫因子之一[8]。乙醇浓度过高就会影响菌体的新陈代谢、生理活性等[9]。利用物理或化学诱变剂对均匀分散的微生物细胞群进行处理的育种方式被称为诱变育种,它可以促进菌株的遗传特性产生突变,突变频率比其自发突变高出几百甚至上千倍,突变几率一般在10-6~10-9范围内[10]。当前发酵工业和其他微生物生产部门所使用的高产菌株,几乎毫无例外地都是通过诱变育种来明显提高其生产性能,且具有变异范围广泛、类型多样等优秀特点,所以仍是目前广泛使用的一种育种手段[11]。
本试验以面包乳杆菌(Lactobacillus crustorumD2-5)和植物乳杆菌(Lactobacillus plantarumD5-5)为研究对象,分别选取不同浓度乙醇胁迫处理后,进行诱变育种,探究经乙醇胁迫后乳酸菌诱变育种的耐受性;根据最佳诱变剂量的条件,确定最佳诱变方法,以期获得耐受特性较好的菌株,为乳酸菌选育技术的应用提供了理论依据。
1 材料与方法
1.1材料与试剂
1.1.1菌种
面包乳杆菌(Lactobacillus crustorumD2-5)和植物乳杆菌(Lactobacillus plantarumD5-5)均来自石河子大学食品学院实验室。
1.1.2培养基及其制备
MRS液体培养基[12]:蛋白胨10.0 g,牛肉膏5.0 g,酵母粉5.0 g,葡萄糖20.0 g,吐温80 1.0 mL,磷酸氢二钾2.0 g,乙酸钠5.0 g,柠檬酸三铵2.0 g,硫酸镁0.58 g,硫酸锰0.25 g,蒸馏水1 000 mL,调pH 6.2~6.4,115℃灭菌20 min。
MRS固体培养基:MRS液体培养基中加琼脂粉20 g,调pH 6.2~6.4,115℃灭菌20 min。
1.1.3化学试剂
硫酸二乙酯(diethyl sulfate,DES)、无水乙醇:天津市致远化学试剂有限公司;氯化钠:天津市永晟精细化工有限公司;硫代硫酸钠(Na2S2O3):天津市盛奥化学试剂有限公司;所有试验试剂均为分析纯。
1.2仪器及设备
Neofuge型高速冷冻离心机:力康发展(香港)有限公司;SW-CJ型无菌操作台:苏州安泰空气技术有限公司;LDZX-40型灭菌锅:上海申安医疗器械厂;HI8424NEW型酸度计:北京哈纳科仪科技有限公司;DNP-9272型电热恒温培养箱:上海精宏实验设备有限公司;BS2000S型电子天平:北京赛多利斯天平有限公司。
1.3实验方法
1.3.1细胞悬浮液制备
将二次活化的菌种分别接种于含体积分数分别为0、5%、6%和8%乙醇的MRS液体培养基中培养,培养至对数生长末期,4℃离心(4 000 r/min、5 min)收集沉淀得菌体。用0.85%无菌生理盐水将菌体洗涤2次,配制成乳酸菌悬浮液,备用[13]。
1.3.2诱变
(1)紫外(ultra violet,UV)诱变
将配制好的乳酸菌悬浮液以10倍稀释法稀释得到10-5、10-6、10-7三个梯度。分别从这三个梯度中吸取菌液置于MRS固体培养基平板上,打开平板盖,用紫外灯照射0.5~3.5 min(按每1 min递增),照射后立即盖上平板盖,均匀涂布后用黑色塑料袋包好,每个稀释度涂布2个平板,于37℃恒温培养24 h[14]。致死率计算公式如下:

以紫外照射时间为横坐标,乳酸菌的致死率为纵坐标,绘制乳酸菌的致死率曲线。
(2)DES诱变
将配制好的乳酸菌悬浮液,加入等体积1%硫酸二乙酯,37℃水浴振荡锅中诱变培养10~50 min(按每10 min递增),加入l mL 2%Na2S2O3终止反应。各取诱变后的菌液涂布MRS固体培养基上,37℃培养24 h。计算不同诱变时间的致死率,以诱变时间为横坐标,致死率为纵坐标,绘制两种乳酸菌的致死率曲线[14]。
(3)复合诱变
仍然用原始出发菌株,先用紫外诱变得到的最佳诱变剂量(方法同上),筛选得到两种优良突变株,挑取优良突变株,在MRS固体培养基上划线,37℃培养24 h,挑取单菌落,配制成乳酸菌悬浮液,加入等体积1%硫酸二乙酯,37℃水浴振荡锅中诱变培养10~50 min(按每10 min递增),加入l mL 2%Na2S2O3终止反应。各取诱变后的菌液涂布MRS固体培养基上,37℃培养24 h,计算不同诱变时间的致死率。
1.3.3乙醇胁迫乳酸杆菌生长曲线的测定
研究表明,一般体积分数5%的乙醇溶液就可抑制菌体的生长速率[15],秦伟帅等[16]研究发现乙醇浓度过高就会影响菌体的新陈代谢、生理活性等。DA SILVEIRA M G等[17]研究认为,在乙醇体积分数为8%~10%的条件下,细菌的生长会受到明显抑制,体积分数为12.5%以上的乙醇不仅抑制细菌的生长,甚至会造成菌体的大量死亡[18]。因此选择体积分数分别为0、5%、8%的乙醇测定其生长曲线。将活化后的种子液接入含0、5%、8%的乙醇的MRS培养基中,静置培养至对数末期每隔2 h取样进行平板计数,分别做3个平行,以培养时间为横坐标,菌落总数为纵坐标,绘制菌株生长曲线。
2 结果与分析
2.1不同紫外照射时间对致死率的影响
由图1可知,两株菌种致死率变化规律基本一致,随着紫外照射时间的延长,菌株的致死率逐渐上升;紫外照射时间为0.5 min时菌种致死率达到50%以上;当照射1.5 min时两菌株致死率达到70%以上;当照射2.5 min时两菌种致死率均达到80%~90%,当照射3.5min时致死率接近100%。
据文献报道[19],近年来一般认为,诱变后菌株的致死率在80%~90%时诱变效果较好,更容易筛选到变异幅度大的突变菌株,以下试验均以此为依据确定最佳诱变剂量。
因此,选择紫外线照射2.5 min为菌株D2-5和D5-5的紫外诱变的剂量最佳照射时间。
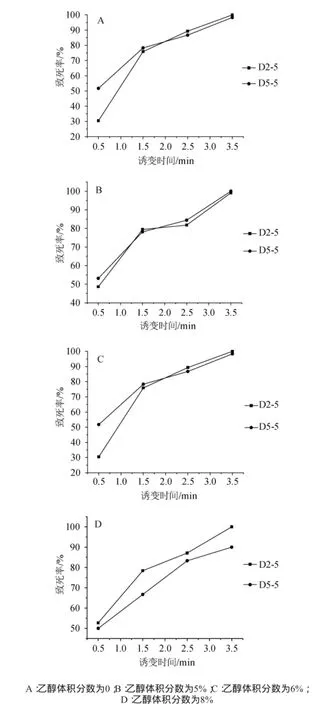
图1 不同紫外线(UV)照射时间对致死率的影响Fig.1 Effect of different irradiated time by UV mutation on fatality rate
2.2不同DES化学诱变时间对致死率的影响
由图2可知,接入乙醇体积分数越高,致死率相对较高。随着DES化学诱变时间的延长,乳酸菌的致死率增加;当DES化学诱变时间为20min时,两菌株致死率均基本达到60%以上;当诱变时间为40min时两株菌致死率达到80%~90%,当诱变时间为50 min时致死率接近100%。
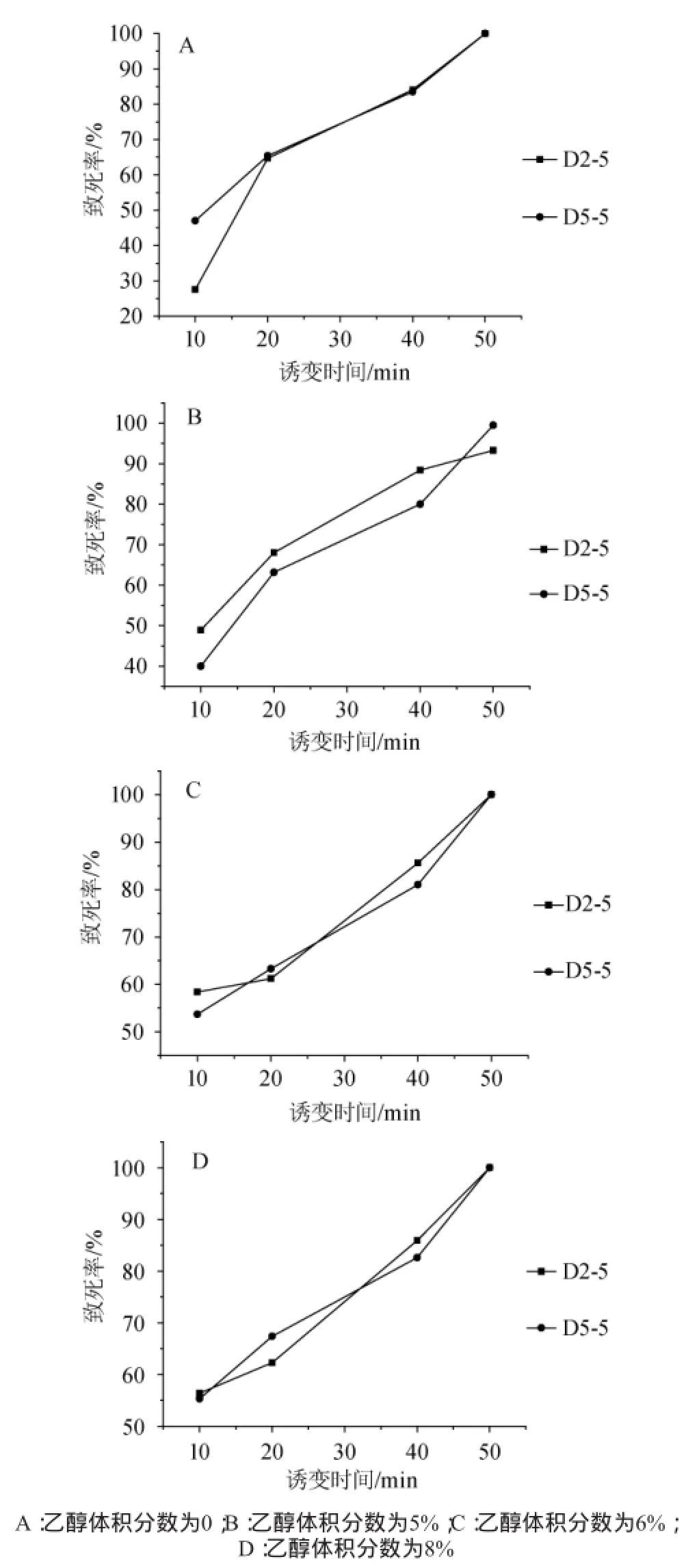
图2 不同DES化学诱变时间对乳酸菌致死率的影响Fig.2 Effect of chemical mutagenesis time by DES mutation on fatality rate
结果表明,两菌株在不同乙醇体积分数下硫酸二乙酯化学诱变的致死率在诱变时间为40 min时都达到了80%~90%,故硫酸二乙酯化学诱变40 min的效果最佳。
2.3复合诱变试验结果
由表1可知,复合诱变的诱变条件为紫外照射2.5 min+硫酸二乙酯诱变20 min时两株菌致死率达到80%~90%,故在此条件下复合诱变的效果最佳。
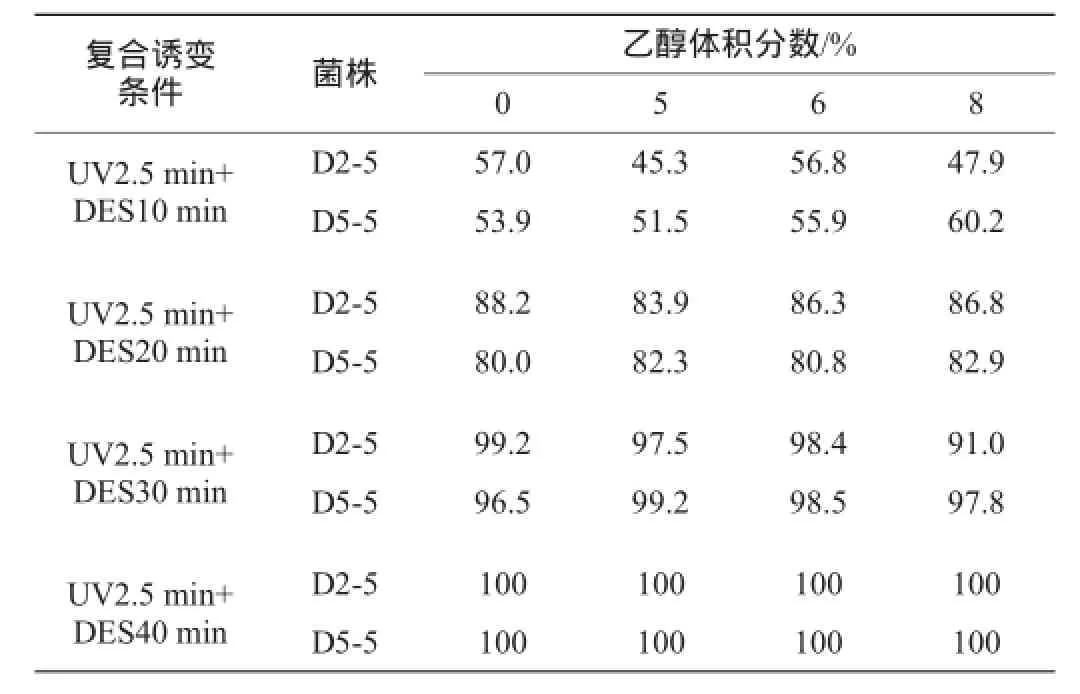
表1 接种不同体积分数乙醇的复合诱变对致死率的影响Table 1 Effect of compound mutation with different ethanol concentration on fatality rate%
2.4不同乙醇体积分数对乳酸菌诱变pH值的变化
不同体积分数乙醇对菌株D2-5和D5-5不同诱变过程中的pH值变化,结果见图3。

图3 不同体积分数乙醇条件下对菌株D2-5(A)及D5-5(B)诱变pH值的变化曲线Fig.3 The curve of pH for strains D2-5(A)and D5-5(B)by different mutation under different ethanol concentration
由图3可知,原菌、紫外诱变、硫酸二乙酯化学诱变和复合诱变过程中乙醇胁迫浓度越大,pH值越高,菌株酸性越弱;通过不同的诱变处理,菌种D2-5和D5-5的pH变化趋势基本一致,在硫酸二乙酯化学诱变过程中pH达到最低,分别为3.15和3.11;由于pH值越低产酸能力越强,所以硫酸二乙酯化学诱变的效果最佳。
2.5乙醇胁迫处理乳酸杆菌的生长曲线
硫酸二乙酯化学诱变,诱变时间40 min,在此条件下测定乙醇胁迫处理后乳酸杆菌的生长曲线,结果见图4。
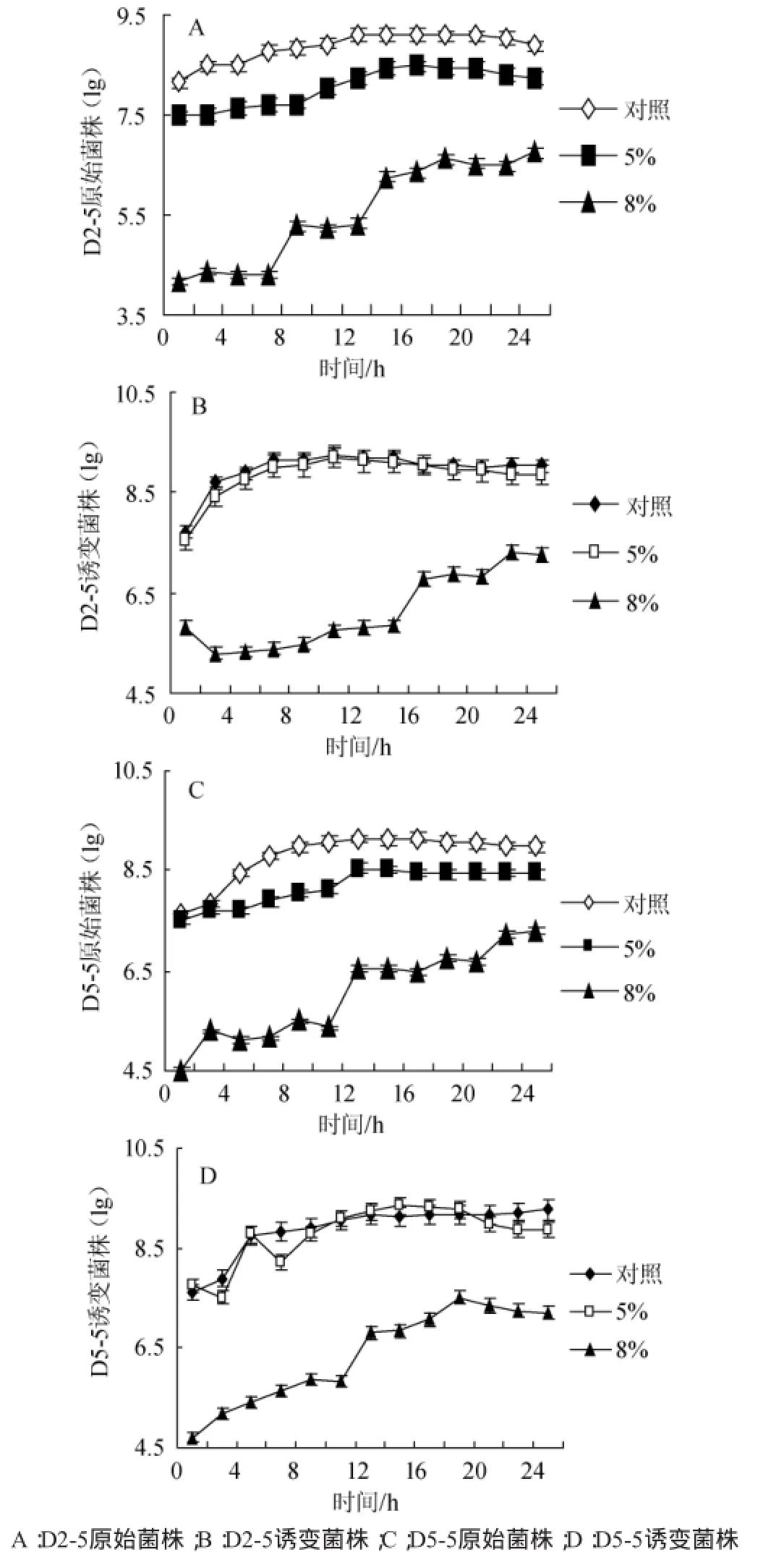
图4 不同乙醇浓度胁迫后原始菌株与DES化学诱变菌株的生长曲线Fig.4 The growth curve of the original and DES mutation strains after different ethanol concentrations stress
相对于原始菌株来说,乙醇胁迫过程中诱变菌株的生长速率有所提高,随着乙醇体积分数的逐步增加,生长速率有所下降。以未经乙醇胁迫处理的菌体为对照,经过体积分数5%乙醇胁迫处理的诱变菌株生长曲线与对照菌株部分重合,而体积分数8%乙醇胁迫菌体生长速率有所提高。在经体积分数8%乙醇胁迫24 h时,D2-5原始菌株菌落总数的对数值为6.2,诱变菌株菌落总数的对数值为7.3,D5-5原始菌株菌落总数的对数值为6.9,诱变菌株菌落总数的对数值为7.1,这一结果说明诱变有助于乳酸杆菌乙醇胁迫耐受性的提高,且D2-5比D5-5效果显著。不同菌体同一乙醇浓度胁迫耐受性不同,D5-5原始菌株生长速率高于D2-5,虽然D5-5诱变菌株在受到体积分数8%乙醇胁迫初期生长速率明显高于D2-5,呈上升趋势,但24 h后两菌菌落总数的对数值基本相同,分别为7.1和7.3;同一菌体不同乙醇浓度胁迫耐受性也有所不同,两株菌不同时间受体积分数为5%乙醇胁迫生长速率较高。
3 结论
本研究以面包乳杆菌(Lactobacillus crustorumD2-5)和植物乳杆菌(Latobacillus plantarumD5-5)为研究对象,经乙醇胁迫处理后进行诱变育种,探究乳酸菌诱变育种乙醇耐受菌株,确定最佳诱变方法。结果表明,硫酸二乙酯化学诱变的效果最佳,且两株菌诱变后产酸能力相差不大。乙醇胁迫过程中诱变菌株的生长速率有所提高,随着乙醇体积分数的逐步增加,生长速率有所下降,在经体积分数8%乙醇胁迫24 h时,D2-5原始菌株菌落总数的对数值为6.2,诱变菌株菌落总数的对数值为7.3,D5-5原始菌株菌落总数的对数值为6.9,诱变菌株菌落总数的对数值为7.1,说明诱变育种有助于乳酸杆菌乙醇胁迫耐受性的提高,且D2-5比D5-5效果显著,因此获得乙醇耐受特性较好的菌株D2-5,本研究结果扩大了能够耐受乙醇的微生物资源,为利用高耐受菌株提高乙醇产量奠定基础。
[1]乌日娜,岳喜庆,张和平.干酪乳杆菌对数生长期与稳定期蛋白质组比较分析[J].自然科学,2012,33(13):148-151.
[2]SHORTT C.The probiotic century:historical and current perspectives[J]. Trends Food Sci Tech,1999,10(12):411-417.
[3]何亮,熊礼宽,曾忠铭.乳杆菌的分类与分子鉴定方法研究进展[J].中国微生态学杂志,2007,19(3):312-313.
[4]LIONG M T.Safety of probiotics:translocation and infection[J].Nutr Rev,2008,66(4):192-202.
[5]任大勇,李昌.乳酸菌益生功能及作用机制研究进展[J].中国兽药杂志,2011(2):47-50.
[6]吴重德.干酪乳杆菌抵御酸胁迫的生理机制解析[D].无锡:江南大学博士论文,2012.
[7]闫彬.酸马奶中乳酸菌与酵母菌的共生发酵性[J].食品科学,2012,33(7):131-137.
[8]张敏,毛健,黄桂东,等.清酒酿酒酵母酒精耐受机理的研究进展[J].食品工业科技,2012,33(20):342-350.
[9]李爱霞,王盼雪,樊明涛,等.植物乳杆菌对pH、酒精浓度和SO2浓度耐受性的研究[J].中国酿造,2013,32(9):42-46.
[10]朱曜.微生物诱变育种中的几个问题[J].四川食品与发酵,1993,20(4):5-8.
[11]车黎猛,任发政,陈尚武.抗后酸化保加利亚乳杆菌的紫外诱变选育[J].食品科学,2006,27(6):109-112.
[12]闵华.发酵蔬菜乳酸菌的分离及培养基的筛选[J].江西农业学报,2002,14(2):62-64.
[13]施巧琴,吴松刚.工业微生物育种学[M].科学出版社,2003.
[14]刘娴.凝固型蜂蜜一脱脂乳酸奶高还原糖转化率乳酸菌的诱变育种[D].合肥:合肥工业大学硕士论文,2007.
[15]屈慧鸽,程显好,邓军哲,等.葡萄酒生境对乳酸菌代谢的影响[J].微生物学通报,2008,35(11):1797-1801.
[16]秦伟帅,王玉峰,赵新节,等.葡萄酒苹果酸-乳酸发酵工艺控制研究进展[J].中外葡萄与葡萄酒,2008(5):64-67.
[17]DA SILVEIRA M G,ABEE T.Activity of ethanol-stressedOenococcus oenicells:a flow cytometric approach[J].J Appl Microbiol,2009,106(5):1690-1696.
[18]赵文英,李华,王爱莲,等.不同培养基对酒酒球菌SD-2a存活率及膜脂肪酸组分的影响[J].微生物学报,2008(10):1319-1323.
[19]诸葛健.工业微生物实验技术手册[M].北京:中国轻工出版社,1994.
Research on mutagenesis of ethanol tolerance lactic acid bacteria
WANG Xiaowen,JIANG Caihong,LU Shiling,LU Wenjuan,DU Zixuan,LI Xu,LI Baokun*
(Food College,Shihezi University,Shihezi 832003,China)
UsingLactobacillus crustorumD2-5 andLactobacillus plantarumD5-5 as the research object,they were selected by mutation after different concentrations of ethanol stress processing.The tolerance of lactic acid bacteria mutation breeding after ethanol stress processing was investigated. According to the optimum mutation dose,the optimum mutation method was determined.The tolerance of lactic acid bacteria mutant strain was verified by growth curve of lactic acid bacteria after different ethanol concentrations stress processing.The results shown that the optimum chemical mutagenesis was 1%diethyl sulfate added equal volume with lactic acid bacteria suspensions,the optimal mutagenesis time was 40 min,the growth rate of mutant strain was increased during ethanol stress processing.Taking 8%ethanol for an example,the Log value of strain D2-5 total bacterial count increased from 6.2 to 7.3,the value of strain D5-5 increased from 6.9 to 7.1 after 24 h.The study indicated that mutation breeding could improve the ethanol stress tolerance of lactic acid bacteria,and the strain D2-5 with high ethanol tolerance was obtained.
Lactobacillus;ethanol stress;mutagenesis breeding;tolerance
TQ923
A
0254-5071(2015)10-0032-05
10.11882/j.issn.0254-5071.2015.10.008
2015-09-17
国家自然基金地区项目(31560444);国家自然基金青年项目(31201395);兵团博士基金专项(2014BB005);石河子大学重大科技攻关项目(gxjs2014-zdgg07);石河子大学高层次人才启动项目(RCZX201223);国家自然基金地区项目(31460007);国家自然基金青年项目(31301523)
王晓雯(1992-),女,硕士研究生,研究方向为畜产品加工与安全。
李宝坤(1979-),男,副教授,博士,研究方向为畜产品加工与质量安全。

