产胞外多糖乳酸菌的筛选及抗氧化特性研究
张玉龙,胡 萍*,王金龙,廖乾伟
(贵州大学酿酒与食品工程学院,贵州贵阳550025)
产胞外多糖乳酸菌的筛选及抗氧化特性研究
张玉龙,胡萍*,王金龙,廖乾伟
(贵州大学酿酒与食品工程学院,贵州贵阳550025)
以分离自贵州侗族、苗族传统发酵食品的36株乳酸菌为受试菌,筛选出8株高产胞外多糖(膜截留分子质量为8 000~14 000 u)的乳酸菌,分别为SR2-1(Pediococcussp.F3S1)、SR2-2(Pediococcus pentosaceusNGRI 0304)、SR3-2(Pediococcus pentosaceusLB-WC)、SR8(Lactobacillus kimchi)、SR10-2(Pediococcussp.22-4)、SR12-1(Lactobacillus graminis)、H1(Staphylococcussp.3034O2)和XS2(Pediococcus pentosaceusGS17),并对其胞外多糖进行体外抗氧化特性研究。结果显示,8株乳酸菌的胞外多糖均具有抗氧化活性,其中胞外多糖质量浓度为30 μg/mL时,乳酸菌SR2-2、SR8和SR12-1的胞外多糖对Fe2+的清除率分别为15.55%、12.41%、53.21%;胞外多糖质量浓度为40 μg/mL时,乳酸菌SR2-2、SR8和SR12-1的胞外多糖对1,1-二苯基-2-三硝基苯肼(DPPH·)和NO2-的清除率分别达9.69%、11.93%、8.93%及5.73%、7.82%、3.82%。这三株乳酸菌显示出一定的抗氧化活性。
乳酸菌;胞外多糖;抗氧化
乳酸菌是普遍公认的食品安全(generally regarded as safe,GRAS)微生物,在自然界广泛分布,其具有调节人体肠道微生态[1-2]、调节免疫力[3-4]、抗氧化[5-6]、降胆固醇[7-8]、抗肿瘤[9-10]、抗过敏[11-12]、降血压[13]、降血脂[14]等功能。乳酸菌胞外多糖(exopolysaccharides,EPS)是乳酸菌在生长代谢过程中分泌到细胞外的糖类化合物,其中粘合在细胞壁形成荚膜的多糖称为荚膜多糖(capsular polysaccharides,CPS),而进入培养基媒介形成粘液的多糖称为粘液多糖(slime polysaccharides,SPS),是乳酸菌的次级代谢产物。这两类多糖都是微生物适应环境的产物。研究发现,乳酸菌胞外多糖也具有细胞保护[15-17]、免疫调节[18-19]、肠道黏附[20]、抗氧化[21]、抗肿瘤[22-23]等功能。此外,乳酸菌胞外多糖特殊的生物高分子特性,能够改善产品的流变学特性,增加产品的持水能力和产品稳定性,赋予产品良好的感官品质。
由于乳酸菌胞外多糖重要的生理活性和食品工业应用价值,近年来产胞外多糖乳酸菌受到极大的关注,功能性产胞外多糖乳酸菌的开发及其在发酵食品中的应用成为国内外学者研究的热点。
1 材料与方法
1.1材料与试剂
36株乳酸菌:分离自贵州侗族、苗族族传统自制酸肉、酸鱼、酸菜、酸汤的。脱脂乳:恒天然集团;MRS肉汤培养基:北京陆桥技术股份有限责任公司;1,1-二苯基-2-苦肼基自由基(1,1-diphenyl-2-picrylhydrazyl,DPPH·)(含10%~20%苯):东京化成工业株式会社;磷酸一氢钠、磷酸二氢钠、铁氰化钾、三氯化铁、抗坏血酸、亚硝酸钠:成都金山化学试剂有限公司;硫酸亚铁、氢氧化钠:天津市永大化学试剂有限公司;三氯乙酸:国药集团化学试剂有限公司;1,10-菲咯啉、无水对氨基苯磺酸、盐酸萘乙二胺、溴甲酚紫:天津市科密欧化学试剂有限公司;邻苯三酚:遵义林源医药化工有限责任公司;无水乙醇:天津市富宇精细化工有限公司。
1.2仪器与设备
LDZX-50KBS立式压力蒸汽灭菌器:上海申安医疗器械厂;HZQ-X100恒温振荡培养箱:太仓市实验设备厂;HPX-9082MBE数显电热培养箱:上海博迅实业有限公司医疗设备厂;DK-98-II电热恒温水浴锅:天津市泰斯特仪器有限公司;Thermo Fisher Scientific Sorvall LEGEND MICRO 17R离心机:赛默飞世尔科技(中国)有限公司;T6新世纪紫外可见分光光度计:北京普析通用仪器有限责任公司。
1.3方法
1.3.1产胞外多糖乳酸菌的初筛
选取不同稀释度的稀释液,以MRS-溴甲酚紫(MRS-bromocresolpurple)固体培养基为分离培养基,采用稀释平板法进行菌种分离,筛选出使MRS-Bromocresol purple固体培养基变黄且黏稠的菌落待用。
1.3.2高产胞外多糖乳酸菌的复筛
(1)标准曲线的绘制
取9支10 mL试管,分别吸取100 μg/mL葡萄糖标准液0、0.1 mL、0.3 mL、0.5 mL、0.7 mL、0.9 mL于每支试管中,然后每支试管再用蒸馏水补足至1 mL。各试管分别加6%苯酚溶液1 mL,摇匀,然后迅速加入浓硫酸5.0 mL,立即摇匀,室温条件下静置30 min,于波长490 nm处测定各溶液的吸光度值,以葡萄糖稀释液的质量浓度为横坐标,吸光度值为纵坐标,绘制葡萄糖标准曲线。
(2)胞外多糖的提取及测定
取10 mL于37℃培养24 h的乳酸菌发酵液,8 000 r/min离心20 min,去菌体,在上清液中加入5 mL 10%三氯乙酸,4℃静置过夜,10 000 r/min离心20 min,脱除蛋白质。离心后的上清液移至透析袋中用蒸馏水4℃透析24 h,加入3倍体积的95%vol乙醇,4℃冷藏过夜,多糖呈絮状沉淀析出,于4℃、10 000 r/min离心20 min,除去上清液,即得沉淀后的胞外多糖,将其溶于5 mL蒸馏水中,得到EPS的水溶液。采用苯酚-硫酸法测得EPS水溶液的吸光度值,并在标准曲线上查找对应的糖含量,即得乳酸菌的胞外多糖产量。将乳酸菌胞外多糖含量调至60.19 μg/mL备用。
1.3.3总还原力测定
取0.5 mL乳酸菌胞外多糖溶液,加入0.5 mL 0.2 mol/L pH值为6.6的磷酸盐缓冲液(phosphate buffered saline,PBS)及0.5 mL 1%铁氰化钾,于50℃水浴20 min,急速冷却,再加入0.5 mL 10%三氯乙酸,4℃、3 000 r/min离心5 min,取上清液0.5 mL,加入1 mL蒸馏水及1 mL 0.1%三氯化铁,混合均匀,10 min后,于波长700 nm处测定其吸光度值,以蒸馏水为空白,吸光度值越大表示还原能力越强。
1.3.4DPPH·清除能力测定
参考王曦等[24]的方法略有改动。取0.2 mL乳酸菌胞外多糖溶液,用无水乙醇补至1 mL,再加入1 mL 0.2 mmol/L DPPH·,立即混匀,暗反应30 min后,以未加样品为对照,无水乙醇作为空白,于波长517 nm处测定其吸光度值。DPPH·清除率计算公式如下:
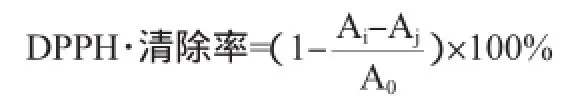
式中:Ai为1 mL的DPPH+1 mL样品的吸光度值;Aj为1 mL溶剂+1 mL样品的吸光度值;A0为1 mL DPPH+1 mL溶剂的吸光度值。
1.3.5螯合Fe2+能力测定
0.1mL 1%抗坏血酸、0.1 mL 0.4%FeSO4和0.1 mL 0.2 mol/L NaOH混合液中加入0.1 mL乳酸菌胞外多糖溶液,混合液于37℃水浴20min,0.5mL10%三氯乙酸(trichloracetic acid,TAC)沉淀蛋白,4 500 r/min、4℃离心10 min,取0.2 mL上清液,加入2 mL质量分数为0.1%的1,10-菲咯啉反应10 min后,于波长510 nm处测吸光度值。实验中以pH 7.4 PBS作为对照。
1.3.6NO2-清除能力测定
(1)标准曲线的绘制
分别取5 μg/mL亚硝酸钠标准溶液0、0.1 mL、0.2 mL、0.3 mL、0.4 mL、0.5 mL、0.6 mL,加入2 mL 0.4%对氨基苯磺酸溶液,混匀后静置3min,加1mL0.2%盐酸萘乙二胺溶液,蒸馏水补至10mL,混匀后,避光静置20min。以零管为空白调零,于538 nm波长处测定吸光度值,并绘制标准曲线。
(2)NO2-的清除能力
分别取4支试管,均加入2 mL 5 μg/mL亚硝酸钠标准溶液,3支试管加0.5 mL乳酸菌胞外多糖溶液,另一支试管加0.5mL蒸馏水,混匀后加入2mL0.4%对氨基苯磺酸溶液,静置3 min,再加入1 mL 0.2%盐酸萘乙二胺溶液,加蒸馏水补至10 mL,摇匀后,避光静置20 min。以零管为空白调零,于538 nm波长处测定吸光度值。
2 结果与分析
2.1产胞外多糖乳酸菌的初筛
以MRS-Bromocresol purple培养基为初筛培养基,筛选结果如表1所示。除SR13-2外,其余35株乳酸菌均能够使得MRS-Bromocresolpurple培养基变黄且黏稠,即均为变黄阳性、黏稠阳性。

表1 产胞外多糖乳酸菌的初筛结果Table 1 Preliminary screening result of exopolysaccharidesproducing lactic acid bacteria
2.2高产胞外多糖乳酸菌的复筛
2.2.1标准曲线的绘制
以葡萄糖稀释液的质量浓度为横坐标,吸光度值为纵坐标,绘制葡萄糖标准曲线(如图1)。葡萄糖标准曲线为y=0.749 5x-0.006 2,R2=0.994 4。这表明葡萄糖质量浓度在0.1~1.0(×10-2mg/L)范围内,葡萄糖质量浓度与吸光度值之间的线性关系良好。
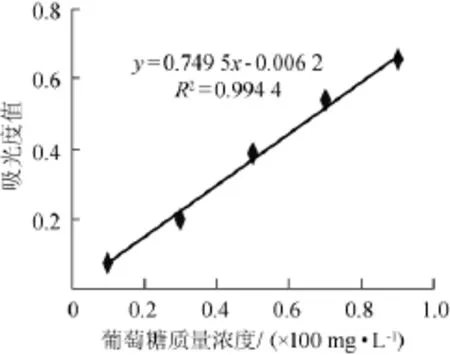
图1 葡萄糖标准曲线Fig.1 Standard curve of glucose
2.2.2高产胞外多糖乳酸菌
本研究采用透析-醇沉法提取高分子质量(膜截留分子质量为8 000~14 000 u)的乳酸菌胞外多糖,并用苯酚-硫酸法测定其产量,结果如表2所示。从上述35株乳酸菌中筛选出的胞外多糖(膜截留分子质量为8 000~14 000 u)产量>30 mg/L的乳酸菌有8株,其中XS2的胞外多糖产量达(44.86±0.71)mg/L。

表28 株乳酸菌胞外多糖产量结果Table 2 Results of 8 lactic acid bacteria producing EPS
2.3胞外多糖的总还原力
总还原力作为测定抗氧化能力的一个重要指标,与抗氧化能力有直接联系。研究显示,具有还原力的化学物质通过提供氢原子来阻断过氧化物的形成,破坏自由基反应链,进而发挥抗氧化作用。如图2所示,8株乳酸菌所产胞外多糖在质量浓度30 μg/mL时,除SR2-1外,其余乳酸菌胞外多糖的总还原力均>0.090,其中SR8、SR10-2、SR12-1和XS2的吸光度值接近0.100,而H1的总还原力为最高,其吸光度值为0.179±0.002,高于阳性对照的抗坏血酸[VC(1.5 μg/mL)]的总还原力(0.171±0.004)。
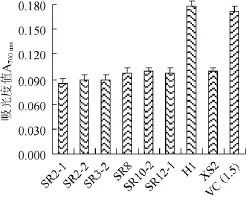
图2 乳酸菌源胞外多糖的总还原力Fig.2 Total reducing abilities of exopolysaccharides produced by different lactic acid bacteria
2.4DPPH·清除能力
DPPH·是一类较为稳定的合成自由基,其稳定性主要源于共振稳定作用及苯环的空间障碍作用。若能将DPPH·清除,则表明受试化学物质具有较强的自由基清除能力,能清除其他自由基如烷自由基、过氧阴离子自由基和过脂质自由基,终断其连锁反应。因而对DPPH·清除能力的大小常作为评价某物质抗氧化性的有效方法。WEI L等[25]研究显示,胞外多糖对DPPH·清除能力随着其质量浓度的增加而增加,3种纯化的胞外多糖质量浓度为0.125 mg/mL时,DPPH·清除率为18.42%~22.95%;胞外多糖质量浓度达4mg/mL时,其对DPPH·清除能力为33.53%~41.92%。ABDHUL K等[26]研究表明,来自粪肠球菌BDU7的胞外多糖质量浓度为8 mg/mL时对DPPH·清除率为63.5%。

图3 不同乳酸菌胞外多糖对DPPH·的清除作用Fig.3 The exopolysaccharides produced by different lactic acid bacteria on DPPH·clearance ability
由图3可知,8株乳酸菌所产胞外多糖质量浓度为40 μg/mL时对DPPH·清除能力强的为SR8、SR2-2、SR3-2和SR12-1所对应的胞外多糖。H1所产多糖对DPPH·清除能力最低,仅为(3.84±0.16)%。与阳性对照(10 μg/mL维生素C(vitamin C,VC))相比,除H1外,其余胞外多糖均比VC的DPPH·清除能力强,其中SR8对胞外多糖的清除能力高于VC的2倍,达(11.93±0.01)%。
2.5螯合Fe2+能力
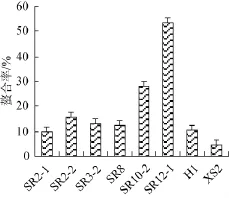
图4 不同乳酸菌源胞外多糖对Fe2+的螯合能力Fig.4 The exopolysaccharides of produced by differnet lactic acid bacteria on Fe2+chelating ability
铜、铁等金属离子参与机体内许多氧化反应,导致机体氧化损伤。当金属离子被螯合后,它就不能启动多不饱和脂肪酸发生脂质过氧化,从而减缓了脂类化合物氧化的速度,阻止其对机体生物膜和核酸的伤害。因此,研究对Fe2+的螯合能力大小对抑制氧化具有重要意义。LI W等[27]研究显示,胞外多糖质量浓度在4 mg/mL时其对Fe2+的螯合率达59.11%。
由图4可知,8株乳酸菌的胞外多糖在质量浓度30 μg/mL时均对Fe2+具有螯合作用,且不同菌源胞外多糖的螯合能力有所差异。其中,SR12-1的胞外多糖表现出最高的螯合能力(为53.21±2.69)%,其次为SR10-2、SR2-2、SR3-2和SR8,螯合能力最弱的为XS2的胞外多糖。
2.6NO2-清除能力
2.6.1标准曲线的绘制
以亚硝酸钠稀释液的浓度为横坐标,吸光值为纵坐标,绘制亚硝酸钠标准曲线(如图5)。由图5可知,亚硝酸钠标准曲线回归方程为y=0.376 6x-0.000 8,R2=0.999 7。这表明亚硝酸钠质量浓度在0.1~0.6(×5 μg/mL)范围内,亚硝酸钠质量浓度与吸光度值之间的线性关系良好。

图5 亚硝酸钠标准曲线Fig.5 Standard curve of sodium nitrite
2.6.2NO2-清除能力
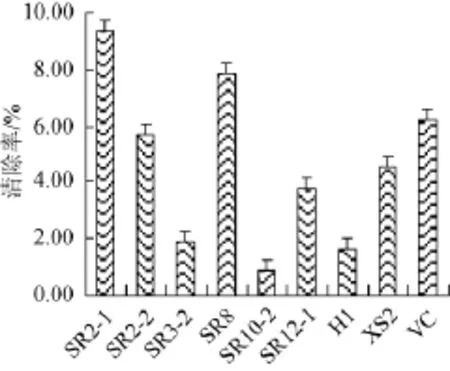
图6 乳酸菌胞外多糖清除NO2-的能力Fig.6 The exopolysaccharides produced by defferent lactic acid bacteria on NO2-clearance ability
亚硝酸盐是一种剧毒物质,也是一种致癌物,其在胃部酸性条件下可转变成的亚硝酸。亚硝酸具有较强的氧化性,可将人体血液中的二价铁离子氧化成三价铁离子,进而使血红蛋白转变成高铁血红蛋白,失去带氧功能,从而导致人体组织缺氧,引起急性中毒现象。此外,亚硝酸可与胺类物质反应,生成具有强致癌作用的亚硝基胺类化合物,诱发人消化道癌等疾病。
由图6可知,8株乳酸菌产胞外多糖对亚硝酸盐均具有清除能力。SR2-1、SR8和SR2-2的胞外多糖显示出良好的清除活性,在质量浓度为40 μg/mL时,依次为(9.35±0.63)%、(7.82±0.63)%和(5.73±1.27)%,其次为SR12-1和XS2。SR3-2、SR10-2和H1的胞外多糖对亚硝酸盐的清除能力低。与40 μg/mL VC相比,仅SR2-1和SR8的清除活性比其强,其余6株乳酸菌的胞外多糖活性相对较低。
3 结论
乳酸菌具有很多生理功能如调解肠微生态平衡、免疫调节、抗氧化、抗肿瘤、降胆固醇、抗过敏等功能,目前的研究主要集中在乳酸菌菌体本身的体内和体外抗氧化实验,部分研究主要探讨无细胞提取物的抗氧化,而对某一类亦或某一种单一组分的抗氧化的报道较少。
分离自贵州少数民族传统自制的酸肉、酸鱼、酸汤、酸菜的36株受试乳酸菌为本土原生态的微生物资源,对其功能特性的研究与开发具有重要的意义。本研究以乳酸菌胞外多糖为指标,采用MRS-Bromocresolpurple培养基为初筛培养基,筛选出35株能够使得培养基变黄且黏稠的乳酸菌;以苯酚-硫酸法进行复筛,从初筛出的35株乳酸菌中筛选出8株高产胞外多糖(膜截留分子质量为8000~14000u)的乳酸菌,分别为SR2-1、SR2-2、SR3-2、SR8、SR10-2、SR12-1、H1和XS2,依次为片球菌属F3S1(Pediococcussp.F3S1)、戊糖片球菌NGRI0304(PediococcuspentosaceusNGRI0304)、戊糖片球菌LB-WC(PediococcuspentosaceusLB-WC)、泡菜乳杆菌(Lactobacillus kimchi)、片球菌属22-4(Pediococcus sp.22-4)、草乳杆菌(Lactobacillus graminis)、葡萄球菌属3034O2(Staphylococcussp.3034O2)、戊糖片球菌菌株GS17(Pediococcus pentosaceusGS17),并对其胞外多糖进行体外抗氧化特性研究。
结果显示,8株乳酸菌的胞外多糖均具有抗氧化活性,其中胞外多糖质量浓度为30 μg/mL时,乳酸菌SR2-2、SR8和SR12-1的胞外多糖对Fe2+的清除率达15.55%、12.41%、53.21%;胞外多糖质量浓度在40 μg/mL时,乳酸菌SR2-2、SR8和SR12-1的胞外多糖对DPPH·和NO2-的清除率分别达(9.69%、11.93%、8.93%)和(5.73%、7.82%、3.82%)。这3株乳酸菌显示一定的抗氧化活性。此研究为进一步开发抗氧化乳酸菌资源、研究乳酸菌抗氧化机理提供支撑。
[1]吴楚璇.复合乳酸菌胶囊在小儿肠道菌群失调性腹泻中的应用[J].医学理论与实践,2014,27(1):60-61.
[2]SALMINEN S,SALMINEN E.Lactulose,lactic acid bacteria,intestinal microecologyandmucosalprotection[J].Scand J Gastroen Suppl,1997,222:45-48.
[3]刘少敏,满朝新,李理,等.乳酸菌免疫调节作用的研究进展[J].中国食物与营养,2013,19(4):60-63.
[4]LI C Y,LIN H C,LAI C H,et al.Immunomodulatory effects oflactobacillusandbifidobacteriumon both murine and human mitogen-activated t cells[J].Int Arch Allergy Imm,2011,156(2):128-136.
[5]LI S Y,ZHAO Y J,ZHANG L,et al.Antioxidant activity of Lactobacillus plantarum strains isolated from traditional Chinese fermented foods[J].Food Chem,2012,135(3):1914-1919.
[6]TAKASHI K,MIHO K,MAKI N,et al.In vitroantioxidant and anti-inflammation properties of lactic acid bacteria isolated from fish intestines and fermented fish from the Sanriku Satoumi region in Japan[J].Food Res Int,2014,64:248-255.
[7]SONG M,PARK S,LEE H,et al.Effect ofLactobacillus acidophilus NS1 on plasma cholesterol levels in diet-induced obese mice[J].J Dairy Sci,2015,98(3):1492-1501.
[8]NEVENA I,RAJNA M,LJILJANA D,et al.Lactobacillus rhamnosus LA68 andLactobacillusplantarumWCFS1 differentlyinfluence metabolic and immunological parameters in high fat diet-induced hypercholesterolemia and hepatic steatosis[J].Food Funct,2015,6(2):558-565.
[9]FASSEAS M K,FASSEAS C,MOUNTZOURIS K C,et al.Effects of Lactobacillus salivarius,Lactobacillus reuteri,andPediococcus acidilacticion the nematodeCaenorhabditis elegansinclude possible antitumor activity[J].Appl Microbiol Biot,2013,97(5):2109-2118.
[10]KELKAR S M,SHENOY M A,KAKLIJ G S.Antitumor activity of lactic acid bacteria on a solid fibrosarcoma,sarcoma-180 and Ehrlich ascites carcinoma[J].Cancer Lett,1988,42(1-2):73-77.
[11]CHOI K O,NGUYEN H H,KWAK H S.Review:The role of the immune system in the use of probiotic lactic acid bacteria in preventing and treating allergic diseases[J].Korean J Food Sci Animal Resour,2010,30(1):1-12.
[12]PESCUMA M,HÉBERT E M,HAERTLÉ T,et al.Lactobacillus delbrueckiisubsp.bulgaricus CRL 454 cleaves allergenic peptides of beta-lactoglobulin[J].Food Chem,2015,170:407-414.
[13]徐丽丹,邹积宏,文姝,等.降血压乳酸菌发酵乳对原发性高血压大鼠的降压效果[J].中国微生态学杂志,2010,22(10):880-883.
[14]BANJOKO I O,ADEYANJU M M,OLADIPO A,et al.Hypolipidemic effects of lactic acid bacteria fermented cereal in rats[J].Lipid Health Dis,2012,11:1-11.
[15]MOZZI F,GERBINO E,FONT DE VALDEZ G,et al.Functionality of exopolysaccharides produced by lactic acid bacteria in anin vitrogastric system[J].J Appl Microbiol,2009,107(1):56-64.
[16]BUIJSSEN K,HARMSEN H,VAN DER MEI H C,et al.Lactobacilli: important in biofilm formation on voice prostheses[J].Otolaryng Head Neck,2007,137(3):505-507.
[17]LEBERT I,LEROY S,TALON R.Effect of industrial and natural biocides on spoilage,pathogenic and technological strains grown in biofilm[J].Food Microbiol,2007,24:281-287.
[18]LI L,JIANG Y J,YANG X Y,et al.Immunoregulatory effects on Ca-co-2 cells and mice of exopolysaccharides isolated fromLactobacillus acidophilusNCFM[J].Food Funct,2014,5(12):3261-3268.
[19]李超,王春凤,杨桂连.乳酸菌胞外多糖肠道黏附及免疫调节作用研究进展[J].食品科学,2014,35(11):314-318.
[20]霍思序,唐彦君,刘宁.乳酸菌胞外多糖生理功能的研究进展[J].食品科技,2013,28(9):153-157.
[21]LI S J,HUANG R H,SHAH NAGENDRA P,et al.Antioxidant and antibacterial activities of exopolysaccharides fromBifidobacterium bifidumWBINO3 andLactobacillus plantarumR315[J].Dairy Sci,2014,97(12):7334-7343.
[22]GHANY K A E,ELHAFEZ E A,HAMOUDA R A,et al.Evaluation of antioxidant and antitumor activities of lactobacillus acidophilus bacteria isolated from egyptian infants[J].Int J Pharmacol,2014,10(5):282-288.
[23]WANG K,LI W,RUI X,et al.Characterization of a novel exopolysaccharide with antitumor activity fromLactobacillus plantarum70810[J]. Int J Biol Macromol,2014,63:133-139.
[24]王曦,罗霞,许晓燕,等.不同乳酸菌菌株抗氧化能力的比较研究[J].食品科学,2010,31(9):197-201.
[25]LI W,JI J,CHEN X H,et al.Structure elucidation and antioxidant activities of exopolysaccharides fromLactobacillus helveticusMB2-1[J]. Carbohyd Polym,2014,102(15):351-359.
[26]ABDHUL K,GANESH M,SHANMUGHAPRIYA S,et al.Antioxidant activity of exopolysaccharide from probiotic strainEnterococcus faecium(BDU7)from Ngari[J].Int J Biol Macromol,2014,70:450-454.
[27]LI W,JI J,RUI X,et al.Production of exopolysaccharides by Lactobacillus helveticus MB2-1 and its functional characteristicsin vitro[J]. LWT-Food Sci Technol,2014,59(2):732-739.
Isolation of exopolysaccharides-producing lactic acid bacteria and its antioxidant properties
ZHANG Yulong,HU Ping*,WANG Jinlong,LIAO Qianwei
(School of Liquor and Food Engineering,Guizhou University,Guiyang 550025,China)
Using 36 strains of lactic acid bacteria(LAB)isolated from fermented food of Dong and Miao nationality in Guizhou as tested bacteria,eight LAB strains with high yield exopolysaccharides(EPSs)(membrane molecular weight(MW)cut off:8 000-14 000 u)were preliminarily screened,including R2-1(Pediococcussp.F3S1),SR2-2(Pediococcus pentosaceusNGRI 0304),SR3-2(Pediococcus pentosaceusLB-WC),SR8(Lactobacillus kimchi),SR10-2(Pediococcussp.22-4),SR12-1(Lactobacillus graminis),H1(Staphylococcussp.3034O2)and XS2(Pediococcus pentosaceus strain GS17).in vitroantioxidant properties of exopolysaccharides were investigated.The results indicated that the exopolysaccharides of eight LAB strains all had antioxidant activity.At the EPS content of 30 μg/ml,the clearance rates of Fe2+of SR2-2,SR8 and SR12-1 were 15.55%,12.41%,53.21%,respectively.At the EPS content of 40 μg/ml,the clearance rates of DPPH·and NO2-of SR2-2,SR8 and SR12-1 were 9.69%,11.93%,8.93% and5.73%,7.82%,3.82%,respectively.Thethreestrainsoflacticacidbacteriashowedcertainantioxidantactivity.
lactic acid bacteria;exopolysaccharides;antioxidant
TS201.3
A
0254-5071(2015)10-0037-06
10.11882/j.issn.0254-5071.2015.10.009
2015-09-05
国家自然科学基金项目(31260379);贵州大学研究生创新基金(基金编号2015040)
张玉龙(1990-),男,硕士研究生,研究方向为食品微生物与生物技术。
胡萍(1970-),女,教授,博士,研究方向为食品微生物与生物技术。

