分步酶解法制备黄浆水活性肽
刘丽莎,彭义交,任 丽,田 旭,白 洁,吕晓莲,陶国琴,郭 宏*
(1.北京食品科学研究院,北京100162;2.北京二商集团有限责任公司,北京100053)
分步酶解法制备黄浆水活性肽
刘丽莎1,彭义交1,任丽1,田旭1,白洁1,吕晓莲2,陶国琴1,郭宏1*
(1.北京食品科学研究院,北京100162;2.北京二商集团有限责任公司,北京100053)
黄浆水是传统豆制品点脑成型过程压榨出的废弃物,富含低聚糖、蛋白质等营养成分。该研究通过比较酶种类及用量、酶解温度、酶解时间对黄浆水蛋白质水解度的影响,采用正交试验优化获得黄浆水短肽最佳分步酶解工艺:(1)酸性蛋白酶加酶量2 000 U/g,pH 4.0,温度55℃,水解2 h;(2)中性蛋白酶8 000 U/g,pH 6.0,温度50℃,水解6 h。在此条件下进行验证,水解度可达25.95%,血管紧张素转化酶体外抑制活性达92.0%。采用酸性蛋白酶和中性蛋白酶分步酶解黄浆水制备短肽,制备条件温和,水解度高,可为豆制品加工废弃物的高值化利用奠定基础。
黄浆水;分步酶解;短肽;血管紧张素转化酶抑制活性
豆腐、腐乳、豆干等是我国传统豆制品,距今已有千余年历史。传统豆制品在压榨过程中每加工1 t大豆需排放2~5 t黄浆水(乳清废水)[1],含0.4%~0.5%乳清蛋白,1%~2%总糖,生物耗氧量(biochemical oxygen demand,BOD)达10 000 mg/L[2],由于目前大部分豆制品加工企业规模小、设备水平低,对黄浆水的功能成分回收及环境污染问题不够重视,仅作为废弃物排放,给企业和环境造成极大负担。研究人员针对黄浆水综合利用开展了一些工作,利用超滤、生物发酵技术生产低聚糖、细菌纤维素[3]、γ-氨基丁酸[4]、L-乳酸[5]和维生素B12[6]等活性成分,但仍处于初步摸索阶段,对于利用黄浆水蛋白质生产活性肽的研究鲜见报道。
研究证实,大豆肽具有降血压[7-8]、抗氧化[9-10]、免疫调节[11]等生理活性,利用大豆分离蛋白制备大豆肽已成功应用于食品加工领域。黄浆水蛋白质较大豆分离蛋白而言分子质量较小、水溶性高,更易制备小分子肽。现有大豆肽生产工艺多采用碱性蛋白酶或中性蛋白酶制备,由于黄浆水pH较低(pH 4.5~4.7),碱性蛋白酶酶解工艺会引入大量离子,增加脱盐工序难度,不适宜用于黄浆水蛋白质酶解。本研究从适合黄浆水水解的蛋白酶种类出发,采用分步酶解工艺制备黄浆水活性肽,为豆制品加工过程中废弃物的综合利用提供新的途径。
1 材料与方法
1.1材料与试剂
黄浆水(经超滤、反渗透浓缩,蛋白含量5%):北京二商希杰食品有限责任公司。
酸性蛋白酶(55 000 U/g):南京奥多福尼生物科技有限公司;中性蛋白酶:泰安信得利生物工程有限公司(150000U/g)、南宁庞博生物工程有限公司(203 000 U/g)、合肥博美生物科技有限责任公司(121 000 U/g);木瓜蛋白酶(papain)(208 000 U/g):合肥博美生物科技有限责任公司;碱性蛋白酶(alcalase)(202000U/g)、复合蛋白酶(pro-tamex)(225000U/g)、风味酶(24000U/g):诺维信(中国)生物技术有限公司。
N-[3-(2-呋喃基)丙烯酰]-L-苯丙氨酰-甘氨酰-甘氨酸(N-[3-(2-furylacryloyl)]-L-phenyalanyl-glycyl-glycine,FAPGG)、血管紧张素转换酶(angiotensin converting enzyme,ACE):美国Sigma-Aldrich公司;甲醛、氢氧化钠等(分析纯):国药集团化学试剂有限公司。
1.2仪器与设备
PHS-25型酸度计:上海精密科学仪器有限公司;AL104电子天平:瑞士梅特勒-托利多公司;H1多功能酶标仪:美国伯腾仪器有限公司。
1.3方法
1.3.1蛋白酶筛选
在浓缩黄浆水中分别添加3 000 U/g的蛋白酶,在其各自适宜的温度、pH值条件下水解1 h,分别测定酶解液水解度(degree of hydrolysis,DH)。
1.3.2黄浆水蛋白质酶解工艺研究
酸性蛋白酶单因素酶解试验:推荐的酸性蛋白酶作用条件为酶用量3 000 U/g底物,反应温度45℃,酶解时间2 h。改变其中单一因素,分别考察酶用量、反应温度、pH值及酶解时间对DH的影响,各因素水平分别为酶用量(1 000 U/g、2 000 U/g、3 000 U/g、4 000 U/g、5 000 U/g);pH值(4.0、4.5、5.0、5.5、6.0);温度(40℃、45℃、50℃、55℃、60℃);酶解时间(1 h、2 h、4 h、6 h、8 h)。
中性蛋白酶单因素酶解试验:以推荐的中性蛋白酶(酶用量5 000 U/g,反应温度55℃,pH 7.0,反应时间4 h)为基础,分别考察酶用量、反应温度、pH值及酶解时间对DH的影响,各因素水平分别为酶用量(3 000 U/g底物、5 000 U/g底物、7 000 U/g底物、9 000 U/g底物、11 000 U/g底物);pH值(5、6、7、8);温度(40℃、45℃、50℃、55℃、60℃);酶解时间(1 h、2 h、4 h、6 h、8 h)。
分步酶解正交试验:黄浆水经酸性蛋白酶在最适条件下水解2 h,在单因素试验的基础上,确定影响黄浆水酶解的主要因素,以中性蛋白酶的酶解时间、加酶量、pH值、酶解温度进行正交试验L9(34),以DH为指标确定最佳酶解工艺参数。

表1 黄浆水蛋白酶解条件优化正交试验因素与水平Table 1 Factors and levels of orthogonal experiments for soybean whey protein hydrolysis condition optimization
1.3.3水解度测定[12-13]
采用甲醛滴定法测定水解液中氨基酸含量,计算水解度,水解度计算公式如下:
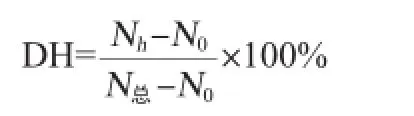
式中:N0为底物游离氨基酸含量,%;Nh为水解液中氨基酸含量,%;N总为底物中的总蛋白质含量,%。
1.3.4十二烷基硫酸钠-聚丙烯酰胺凝胶(SDS-PAGE)电泳[14]
分别配制5%浓缩胶和12%分离胶,样品按1∶4与上样缓冲液混合,上样量20 μL,电泳完毕后经考马斯亮蓝R-250染色,脱色后于凝胶成像系统进行成像处理。
1.3.5ACE抑制活性[15]
在比色杯中加入1 mL 0.5 mmol/L的FAPGG(溶解于50mmol/LTris-HCl缓冲液,含0.3mol/LNaCl,pH7.5),20μL ACE(1 U/mL),200 μL样品,室温条件下混匀,于2 min内在波长345 nm处测定吸光度值的降低速率。样品为黄浆水酶解液经5 000 μ超滤膜滤出液,空白以Tris-HCl缓冲液代替样品。根据下列公式计算ACE抑制活性:
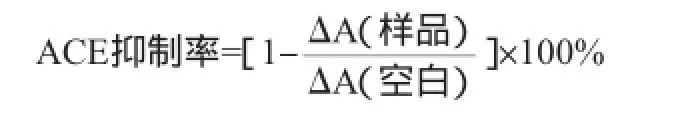
式中:ΔA为1 min内吸光度值的变化。
2 结果与分析
2.1蛋白酶筛选
8种不同蛋白酶在推荐使用条件下水解能力如图1所示。

图1 不同蛋白酶对水解度的影响Fig.1 Effect of different protease on hydrolysis degree
由图1可知,中性蛋白酶(信得利)酶解效果最佳,水解1 h后水解度达6.56%。研究表明,相对分子质量较小(<1 500 u)的ACE抑制肽效果较佳。在酶解过程中,利用不同种类蛋白酶酶切位点不同,采用分步酶解,可提高酶解液水解度,更易制备分子质量较小的活性肽。由于黄浆水在制作、储运过程中常会污染乳酸乳球菌[16]、嗜酸乳杆菌[17]等产酸菌,导致黄浆水pH值为4.3~4.5,且其中含有大量的钙、镁离子,在碱性条件下易产生沉淀,因此,选用水解效果较佳的酸性蛋白酶和中性蛋白酶(倍得利)复合酶解黄浆水蛋白质,尽可能减少后期脱盐难度。
2.2酸性蛋白酶酶解条件优化
酸性蛋白酶酶解黄浆水蛋白的单因素试验结果见图2。

图2 酸性蛋白酶酶解时间(A)、温度(B)、pH值(C)、加酶量(D)对水解度的影响Fig.2 Effect of acid protease hydrolysis time(A),temperature(B),pH(C)and addition(D)on hydrolysis degree
由图2A可知,酸性蛋白酶在前2 h内,水解速度较快,随后DH上升缓慢。随着酶解时间延长,大分子蛋白质在水解成小分子肽的过程中,酶切位点逐渐减少,使得DH增长趋势趋于平缓。因此选择酶解时间2 h为宜;由图2B可知,水解度随酶解温度升高而缓慢上升,55℃时水解度最高,温度较高时,分子运动加快,酶与底物碰撞机率变大从而提高酶的催化效率[18],因此选择酶解温度55℃为宜;由图2C可知,水解度随酶解pH值上升呈先上升后下降的趋势,在酶解pH值为4.0时水解度最高,因此酸性蛋白酶最适水解pH值为4.0为宜。由图2D可知,加酶量达2000U/g底物后,加酶量增加对水解度的影响趋于平稳,因此选择加酶量2 000 U/g为宜。综上确定酸性蛋白酶水解条件为加酶量2 000 U/g,pH 4.0,温度55℃,酶解时间2 h。
2.3中性蛋白酶酶解条件优化
2.3.1单因素试验
中性蛋白酶酶解单因素试验结果见图3。

图3 中性蛋白酶酶解时间(A)、温度(B)、pH值(C)、加酶量(D)对水解度的影响Fig.3 Effect of neutral protease hydrolysis time(A),temperature(B),pH(C)and addition(D)on hydrolysis degree
由图3A可知,中性蛋白酶水解度随酶解时间延长逐渐增大,到4 h增长速率变缓,到6 h后趋于稳定,因此选择酶解时间4~6 h进行正交试验。由图3B可知,中性蛋白酶在45~60℃条件下水解活性较强,其中50℃时DH最高,在40℃时酶的水解能力较差,可能与体系内分子运动激烈程度有关,蛋白酶与底物碰撞机率较小所致,温度超过50℃时,酶分子构象可能受影响,丧失部分催化能力,因此选择酶解温度45~55℃进行正交试验。由图3C可知,中性蛋白酶水解度随酶解pH值升高呈先缓慢上升后下降的趋势,pH值为6.0时水解度达最大值,因此选择中性蛋白酶酶解pH值5.5~6.5进行正交试验。由图3D可知,中性蛋白酶水解度随加酶量的增加呈现先上升后变化趋于平缓的趋势,加酶量>7 000 U/g底物后,加酶量继续增加对水解度的影响较小,因此选择加酶量为6 000~8 000 U/g底物进行正交试验。
2.3.2正交试验优化
黄浆水中性蛋白酶解条件优化正交试验结果与分析见表2。

表2 黄浆水蛋白酶解条件优化正交试验结果与分析Table 2 Factors and levels of orthogonal experiments for soybean whey protein hydrolysis condition optimization
由表2可知,各因素影响主次关系为B(加酶量)>D(酶解温度)>A(酶解时间)>C(pH值),最佳酶解组合为A3B3C2D2,即中性蛋白酶加酶量8 000 U/g,pH 6.0,温度50℃,水解6 h。在此条件下进行验证,水解度可达25.95%。
2.4十二烷基硫酸钠-聚丙烯酰胺凝胶(SDS-PAGE)电泳
黄浆水酶解液SDS-PAGE电泳图见图4。
由图4可知,酶解前,蛋白集中于50 ku、30 ku、10 ku,呈弥散态,由于豆腐制作需浸泡10 h以上,大豆处于萌芽早期,内源蛋白酶开始水解蛋白[19],且在豆腐制作及黄浆水储运过程中,微生物的分解也会造成蛋白降解。经酸性蛋白酶酶解后,50 ku、30 ku处蛋白条带消失,仅在10 ku附近有少量条带,说明大分子蛋白被水解成小分子蛋白。经分步酶解后,蛋白条带彻底消失,经酸性蛋白酶和中性蛋白酶共同作用,水解程度增加,小分子肽的分子质量分布将在后续研究中通过层析分离、液相色谱进一步探究。

图4 黄浆水酶解液SDS-PAGE电泳图Fig.4 SDS-PAGE electrophoretogram of soybean whey hydrolysate
2.5酶解液ACE抑制活性
ACE抑制活性能在一定程度上预测降血压活性,通过Holmquist法测得酶解后黄浆水ACE抑制活性变化如表3所示。

表3 酶解液的ACE体外抑制活性Table 3in vitroACE inhibitory activity of hydrolysate
从表3可知,黄浆水酶解前后均对ACE表现出一定活性,酶解前抑制率为22.7%,酶解后抑制率升高为92%(P<0.01)。由于黄浆水采用5 000 ku超滤膜浓缩,浓缩液中可能存在少量小分子肽等活性成分,对ACE活性有一定的抑制作用,当分步酶解后,大分子蛋白进一步降解成小分子肽,大幅提高ACE抑制活性,高达90%以上,较刘佳等[20-21]制备的大豆活性肽高。
3 结论
本研究通过单因素试验确定酸性蛋白酶及中性蛋白酶水解黄浆水蛋白作用条件,通过正交试验优化确定了黄浆水蛋白分步酶解工艺:(1)酸性蛋白酶加酶量2 000 U/g,pH 4.0,温度55℃,酶解时间2 h;(2)中性蛋白酶8 000 U/g,pH 6.0,温度50℃,酶解时间6 h,水解度可达25.95%,ACE体外抑制活性达92.0%。降血压肽是一类具有降血压活性的多肽物质,目前许多研究已表明大豆活性肽具有多种良好的生物活性[22-25],黄浆水作为豆制品加工过程中产生的大量废弃物,含有丰富的蛋白质,且较大豆蛋白而言,其蛋白质分子质量较小,更易获得分子质量较小的多肽。经研究验证,本研究所采用的分步酶解法制备的活性肽具有极强的ACE抑制活性,在后续研究过程中,将对其中的活性多肽组分开展研究,为开发有市场潜力的多肽类降血压药物和营养素提供思路,也为豆制品加工企业解决治污难题开辟一个新的途径。
[1]伍军,艾启俊,于同泉,等.大豆黄浆水处理过程中超滤膜的选择[J].北京农学院学报,2003,18(3):223-225.
[2]佟献俊,孙洋,钱方.大豆黄浆水中乳清蛋白和低聚糖制备研究进展[J].中国酿造,2009,28(12):3-5.
[3]杨凤吾.黄浆水发酵生产细菌纤维素的研究及应用[D].长沙:湖南农业大学硕士论文,2009.
[4]姚子鹏.乳酸菌发酵黄浆水生产GABA的研究[D].哈尔滨:东北农业大学硕士论文,2014.
[5]赵贵丽,罗爱平,邴娅新,等.鼠李糖乳杆菌发酵豆渣、黄浆水产L乳酸初探[J].食品工业科技,2013,34(13):178-180.
[6]刘平,李晓峰,谭新敏.利用大豆黄浆水发酵生产维生素B12的工艺探索[J].陕西科技大学学报,2003,21(4):83-85.
[7]高博.大豆蛋白水解物的两种修饰及其活性变化[D].哈尔滨:东北农业大学硕士论文,2010.
[8]卢静,赵春燕,张学新,等.大豆肽对大鼠血压及血浆血管紧张素的影响[J].营养学报,2008,30(5):508-511.
[9]豆康宁,石晓,王飞.大豆蛋白水解度与大豆肽抗氧化力关系研究[J].中国油脂,2013,38(10):20-22.
[10]陈湘宁,张艳艳,范俊峰,等.大豆多肽的凝胶性及抗氧化性研究[J].食品科学,2005,26(5):71-75.
[11]SINGH B P,VIJ S,HATI S.Functional significance of bioactive peptides derived from soybean[J].Peptides,2014,54:171-179.
[12]程杰顺,肖湘.酶对猪血蛋白水解度影响的研究[J].农产品加工,2011(2):59-62.
[13]姚玉静,崔春,邱礼平,等.测定大豆蛋白水解度准确性比较[J].食品工业科技,2008,29(8):268-270.
[14]翟爱华,杨盛楠.高压均质对大豆蛋白7S和11S组分功能性质的影响[J].食品科技,2015,40(6):208-211.
[15]HOLMQUIST B,BUNNING P,RIORDAN J F.A continuous spectrophotometric assay for angiotensin converting enzyme[J].Anal Biochem,1979,95(2):540-548.
[16]刘丽莎,彭义交,鲍鲁生,等.大豆浸泡过程中腐败微生物对豆浆品质的影响[J].食品科学,2015,36(14):161-164.
[17]胡欣欣.豆腐酸浆中产酸菌的分离及应用研究[D].长沙:湖南农业大学硕士论文,2011.
[18]李宁,刘红芝,刘丽,等.中性蛋白酶分步酶解花生分离蛋白制备花生短肽的研究[J].中国农业科学,2013,46(24):5237-5247.
[19]于立梅,钟惠曾,于新,等.大豆发芽过程中营养成分变化规律的研究[J].中国粮油学报,2010,25(8):19-22.
[20]刘佳.大豆蛋白ACE抑制肽的研究[D].无锡:江南大学硕士论文,2008.
[21]尹波欢.豆粕酶解制备ACE抑制肽及其性质研究[D].无锡:江南大学硕士论文,2012.
[22]孙青.大豆肽对大鼠血脂代谢的影响及其抗动脉粥样硬化机理研究[D].济南:山东大学硕士论文,2013.
[23]LASSISSIT A,HETTIARACHCHYNS,RAYAPROLUSJ,et al.Functional properties and angiotensin-I converting enzyme inhibitory activity ofsoy-wheyproteinsandfractions[J].Food Res Int,2014,64:598-602.
[24]FUNG W Y,LIONG M T.Evaluation of proteolytic and ACE-inhibitory activity ofLactobacillus acidophilusin soy whey growth medium via response surface methodology[J].LWT-Food Sci Tech,2010,43(3):563-567.
[25]KODERA T,NIO N.Identification of an angiotensin I converting enzyme inhibitory peptides from protein hydrolysates by a soybean protease and the antihypertensive effects of hydrolysates in spontaneously hypertensive model rats[J].J Food Sci,2006,71(3):164-173.
Preparation of oligopeptides from soybean whey by stepwise enzymatic hydrolysis
LIU Lisha1,PENG Yijiao1,REN Li1,TIAN Xu1,BAI Jie1,LV Xiaolian2,TAO Guoqin1,GUO Hong1*
(1.Beijing Academy of Food Sciences,Beijing 100162,China;2.Beijing Er Shang Group Co.,Ltd.,Beijing 100053,China)
The soybean whey from tofu processing was the waste water,which contains protein and soy oligosacharides.In this study,the effect of enzyme variety,enzyme addition,hydrolysis temperature,time and pH on the hydrolysis degree of soybean whey protein were studied.The optimum stepwise enzymatic hydrolysis conditions for the preparation of oligopeptides from soybean whey were determined by orthogonal experiment:(1)acid protease addition 2 000 U/g,pH 4.0,55℃for 2 h.(2)Neutral protease addition 8 000 U/g,pH 6.0,50℃for 6 h.Under these conditions,the hydrolysis degree reached 25.95%,in vitroinhibitory activity of angiotensin converting enzyme was 92.0%.Using acid protease and neutral protease to prepare oligopeptide by stepwise enzymatic hydrolysis,the preparing condition was mild,and the hydrolysis degree was high,which could lay a foundation for comprehensive utilization of soybean product processing waste.
soybean whey;stepwise proteinase hydrolysis;oligopeptide;ACE inhibitory activity
TS214.2
A
0254-5071(2015)10-0013-05
10.11882/j.issn.0254-5071.2015.10.004
2015-09-14
国家高技术研究发展计划“863”计划(2013AA102105);北京市优秀人才培养资助(2014754154700G201)
刘丽莎(1989-),女,工程师,硕士,研究方向为食品微生物及天然活性成分研究。
郭宏(1961-),男,教授级高级工程师,硕士,研究方向为豆制品加工及综合利用。

