黏着剑菌CN-02胞外多糖在缓解水稻Cu2+胁迫中的作用
*孙科 沙凤 谭芳美 熊美惠
(苏州科宁多元醇有限公司 江苏 215000)
引言
近年来,随着社会经济的发展,由人类活动引起的土壤重金属污染日趋严重。在我国,生态环境部基于全国土壤污染状况调查结果显示,农田土壤超标率达19.4%,其中主要以镉(Cd)、镍(Ni)、铜(Cu)、汞(Hg)、铅(Pb)等为主。研究人员发现,铜胁迫下,若土壤中的铜含量超过50mg/kg,则会影响柑橘的生长;若土壤中的铜含量超过200mg/kg时,则会严重抑制小麦生长。另一方面,重金属通过食物链进入生物体内,对其造成极大的危害。因此,减少重金属离子在植物体内的富集、增强植物重金属胁迫抗性,对于我国粮食安全至关重要。
胞外多糖是由微生物分泌的胞外聚合物,其由单糖通过糖苷键的形式连接而成。由于单糖种类丰富、糖苷键不同以及侧链修饰差异,使得自然界中的胞外多糖多种多样,其效果也不尽相同。其中,胞外多糖中的羟基、羧基、硫酸基团等官能团,对金属离子的吸收至关重要。山东大学侯万国教授团队[1]研究发现,富含羟基、羧基的深海中温菌Wangia profunda SM-A87胞外多糖对Pb、Cu、Cd有较强的吸附能力。Mukherjee等[2]发现,砷(2mM)增加了Halomonas sp.Exo1胞外多糖的产生,进而又隔离了重金属,缓解了水稻的重金属胁迫,表现出正反馈机制。鉴于胞外多糖较好的阳离子吸附特性,胞外多糖及其分泌菌株已被建议作为重金属修复的辅助剂[3]。
黏着剑菌(Ensifer adhaerens)属于α-变形菌门细菌,其最早由Casida于1982年从土壤中被分离鉴定。随着研究的深入,人们发现黏着剑菌是优异的土壤有机污染物降解和工业化生产维生素B12菌种。也有研究表明,来源于黏着剑菌的胞外多糖是一种良好的食用油生物乳化剂[4]。在本研究中,我们发现黏着剑菌CN-02具备较强的胞外多糖分泌能力,且其胞外多糖富含糖醛酸,可吸附Cu2+,并缓解Cu2+胁迫对水稻生长的抑制作用。
1.材料与方法
(1)菌株
黏着剑菌(Ensifer adhaerens)CN-02筛选自水稻根际土壤,已于2020年12月保藏至中国普通微生物菌种保藏管理中心(CGMCC,No21357)。
(2)培养基
LB培养基:NaCl 10g,酵母粉5g,蛋白胨10g,溶解于1L去离子水中。
发酵培养基:NaCl 10g,酵母粉5g,蛋白胨10g,蔗糖40g,溶解于1L去离子水中。
固体培养基则额外添加15g/L琼脂,所述培养基菌灭菌后使用。
(3)胞外多糖产量及组分测定
挑取E.adhaerens CN-02至LB液体培养基,37℃,过夜培养。随后将其以4%接种量转接至发酵培养基,30℃,200rpm培养24h,即得发酵液。发酵液高速离心(10000×g,15min)后保留上清,减压蒸馏至原始体积的1/5。浓缩液通过Sevag试剂(异戊醇:氯仿=1:4v/v)去除蛋白后,加入3倍体积95%乙醇,4℃过夜醇沉。将沉淀冷冻干燥后,即得E.adhaerens CN-02胞外多糖。
胞外多糖总糖含量通过苯酚-硫酸法测定[4];糖醛酸含量通过硫酸-咔唑法测定[5];蛋白质含量通过Brad-Ford法测定;灰分含量通过马弗炉测定。
(4)胞外多糖与Cu2+螯合能力测定
准确称量12.6g无水CuSO4(含5g Cu),溶解至95mL去离子水中。随后,加入5mL 5g/L、10g/L、20g/L、40g/L的胞外多糖溶液,以加入5mL去离子水为空白对照,充分混合后常温静置30min。将混合溶液在4000×g离心20min,上清液通过电感耦合等离子体光谱仪测定Cu2+含量。螯合率使用如下公式计算:
螯合率(%)=(对照组Cu2+含量-实验组Cu2+含量)×100/对照组Cu2+含量
(5)红外光谱分析
称取10mg样品与100mg KBr混合后研磨至细粉末,并通过压片机制成薄片,使用傅里叶变换红外光谱仪对其进行扫描。
(6)水稻种植及处理
供试的水稻种子(Oryza sativa ssp.japonica cv.Nipponbare)由江苏省农业科学院提供。将种子用2.5%次氯酸钠表面灭菌20min,然后用无菌水冲洗3次。在22℃催芽后,移栽至灭菌土壤中,培养一周后,挑选长势相似的水稻幼苗,随机分成6组,分别为:T1,空白对照;T2,施加CuSO4溶液,至终浓度为250mg/kg土壤;T3,施加胞外多糖溶液,至终浓度为100mg/kg土壤;T4,施加胞外多糖和CuSO4溶液,至胞外多糖终浓度为100mg/kg土壤,CuSO4终浓度为250mg/kg土壤;T5,施加胞外多糖和CuSO4溶液,至胞外多糖终浓度为200mg/kg土壤,CuSO4终浓度为250mg/kg土壤;T6,施加胞外多糖和CuSO4溶液,至胞外多糖终浓度为400mg/kg土壤,CuSO4终浓度为250mg/kg土壤。培养一周后,收集水稻,测定其根长、茎长、鲜重、叶绿素含量,体内Cu2+含量,丙二醛(MDA)含量[6],脯氨酸含量[7];收集水稻根围土,测定游离Cu2+含量。其中,整个培养期间生长条件为:25℃、相对湿度65%、光强度4000lx、光照16h/d。
2.结果与讨论
(1)胞外多糖产量及组分分析
经发酵、提取后测得E.adhaerens CN-02胞外多糖产量为8.83g/L;E.adhaerens CN-02胞外多糖中,总糖含量为74.20%,糖醛酸含量为26.18%,不含蛋白质。此外,灰分含量为4.79%。
(2)胞外多糖对Cu2+的结合能力分析
为了考察胞外多糖高糖醛酸含量的特性,是否表现出较好的Cu2+螯合能力,我们对其进行了分析。实验结果如图1所示,随着胞外多糖含量(0~30g/L)的升高,其对Cu2+的螯合率逐渐升高,而30g/L与40g/L胞外多糖对Cu2+的螯合率却无明显差异。

图1 胞外多糖对Cu2+的结合能力
(3)胞外多糖红外图谱分析(图2)
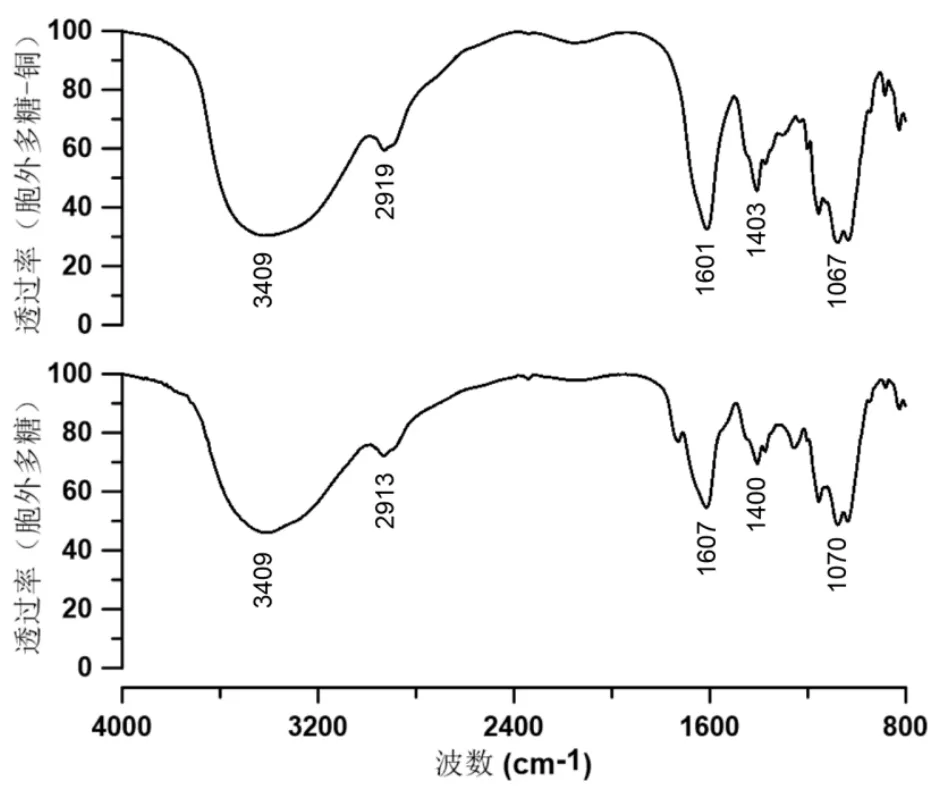
图2 胞外多糖在吸附Cu2+前和后的红外光谱分析
Cu2+处理前后的E.adhaerens CN-02胞外多糖红外光谱图如图2所示。根据文献报道,胞外多糖在3400cm-1附近又宽又大的特征吸收峰为-OH的伸缩振动,在2940cm-1附近的吸收峰为糖亚甲基中C-H的伸缩振动,在1600cm-1和1400cm-1附近的吸收峰为羧酸根离子基团(COO-)和C-H的结合震动,在1070cm-1附近的吸收峰代表了C-O-C和C-O-H的伸缩振动[8]。胞外多糖吸附Cu2+后,其红外光谱吸收峰在3400cm-1处、1600cm-1和1400cm-1处的吸收峰明显变强,说明这些基团与胞外多糖结合Cu2+有关,而在3400cm-1和1600cm-1处的变化最为显著,说明羧基和羟基在吸附Cu2+的过程中发挥着主要作用。
(4)胞外多糖增强水稻对铜离子胁迫的抗性
不同处理下水稻苗茎长、根长、鲜重和叶绿素含量如表1所示。重金属胁迫处理,即T2组,显著抑制了水稻生长,其茎长、根长、鲜重和叶绿素含量均显著低于对照组,即T1。施加胞外多糖处理组(T3),显著促进了水稻生长。施加胞外多糖和重金属胁迫的处理,则显著缓解了重金属胁迫对水稻幼苗的伤害,其中,胞外多糖含量越高,其缓解作用越明显,这一现象与胞外多糖浓度越高对Cu2+吸附能力越强相吻合(图1)。
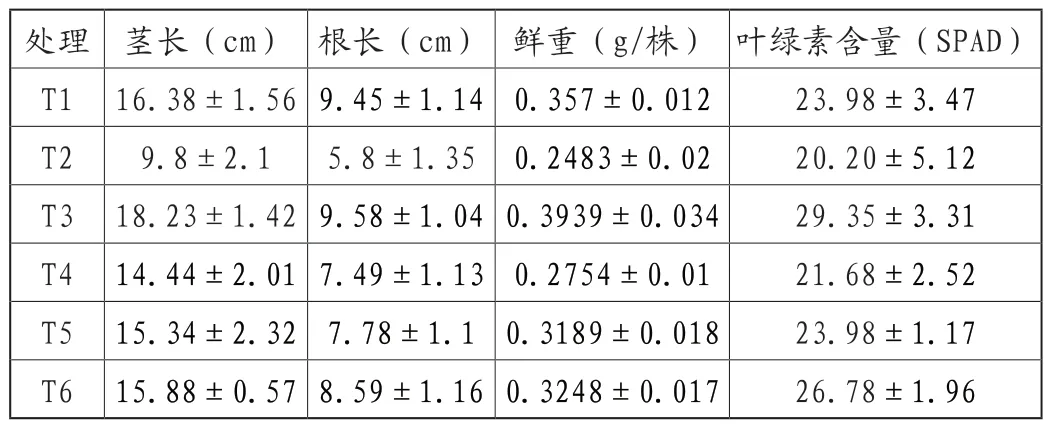
表1 不同处理下水稻苗生长指标差异
重金属胁迫下,植物会细胞失水而进一步受到渗透压胁迫。此时,植物会调整代谢,分泌并积累过量的脯氨酸,用于提高自身抗渗透压胁迫的能力,从而尽量缓解重金属胁迫对植物造成的损伤。因此,水稻在正常环境下生长时(T1和T3组),其体内脯氨酸含量较低,在重金属胁迫下生长时(T2组),其脯氨酸含量显著上升,为T1组的2.5倍。当施加胞外多糖后(T4、T5和T6组),水稻苗内脯氨酸含量有所下降,但仍显著高于T1处理组图3(A),这或许是因为胞外多糖在植物体外絮凝了Cu2+,使水稻收到了更低浓度的重金属离子胁迫,进而其对胁迫缓解需求较小,体内脯氨酸含量也因此降低。
MDA是脂膜氧化后的最终产物。换言之,植物体内MDA含量越高,其受到的胁迫伤害越严重[8]。Cu2+胁迫对植物造成了明显的伤害,使脂膜过氧化,积累了更多的MDA图3(B),T2组的MDA含量为T组的3.1倍,这对植物造成了极大的伤害。胞外多糖处理显著缓解了这一伤害,水稻体内的MDA与T2组相比,从29.6nmol/g降低至18.9nmol/g(T4组)、16.9nmol/g(T5组)、16.2nmol/g(T6组)。
随后,我们考察了水稻根内外的Cu2+含量。实验结果如图3(C)和图3(D)所示,在正常环境下生长的水稻(T1和T3组)根内和根外Cu2+含量低,而T2组,根内、根外Cu2+含量显著提高,分别达到了124mg/kg和133mg/kg。胞外多糖处理后(T4、T5和T6组),水稻根内的Cu2+含量显著降低图3(C),有趣的是,水稻根围土壤中的游离Cu2+含量也同样显著降低图3(D)。因此,我们推测,在Cu2+胁迫下,Cu2+大量内流,显著提高了水稻根内的Cu2+含量,而胞外多糖的加入,由于其对Cu2+较好的吸附能力,限制了Cu2+内流,同时,将Cu2+絮凝在土壤中,从而减少了Cu2+对植物生长的抑制作用。
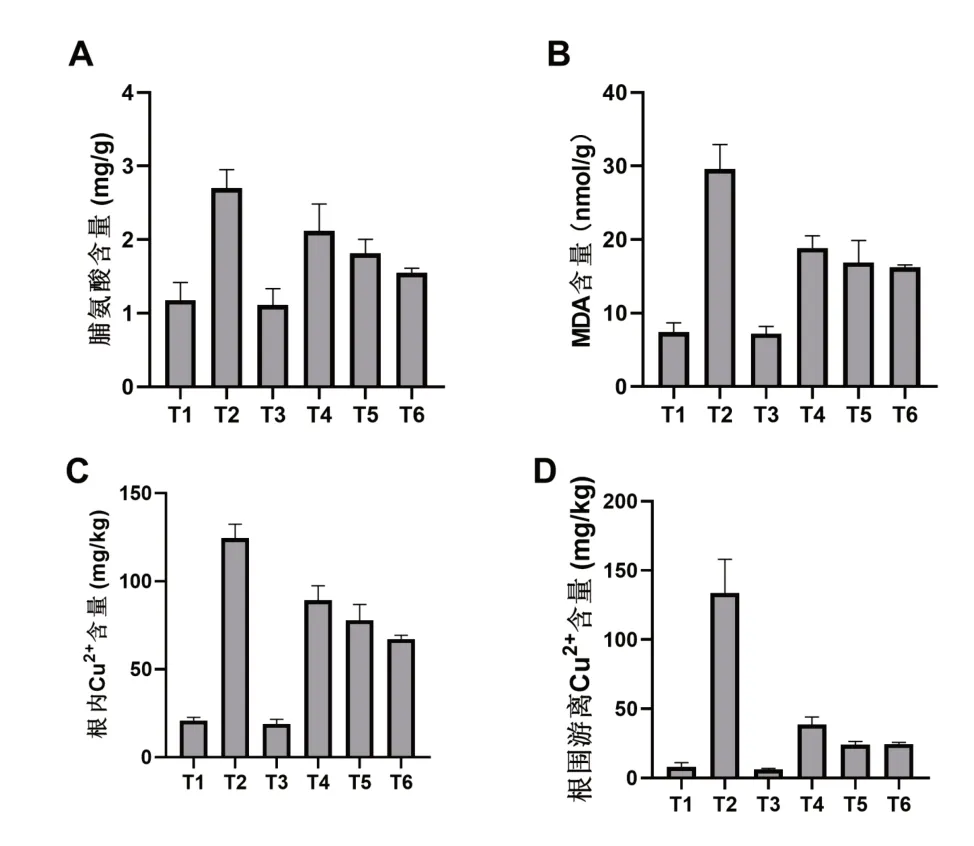
图3 不同处理下水稻幼苗脯氨酸(A)、MDA(B)、根内Cu2+(C)和根围Cu2+(D)含量
3.总结
在本研究中,我们发现来源于E.adhaerens CN-02的胞外多糖中含有较多的糖醛酸含量。同时,该胞外多糖展现出了较强的Cu2+吸附能力,从红外图谱分析,我们推测其吸附能力主要与羧基和羟基有关。将该胞外多糖使用至模拟盐胁迫的土壤中,其通过对Cu2+吸附效应,将Cu2+排除在水稻根际外围,显著增强了水稻对Cu2+胁迫的抗性。

