黄芩素对结肠癌SW480细胞增殖与凋亡的影响
王宁,畅灵丽,程琦,张延新
(漯河医学高等专科学校基础医学部,河南漯河462000)
·论著·
黄芩素对结肠癌SW480细胞增殖与凋亡的影响
王宁,畅灵丽,程琦,张延新
(漯河医学高等专科学校基础医学部,河南漯河462000)
目的探讨黄芩素对人结肠癌SW480细胞增殖与凋亡的影响及可能的机制。方法噻唑蓝(MTT)法检测黄芩素对SW480细胞增殖的影响,Hoechst 33258染色观察黄芩素处理后细胞的形态学改变,流式细胞术检测其对SW480细胞的凋亡诱导作用,比色法检测黄芩素作用后细胞Caspase-3活性的变化。结果黄芩素能够抑制SW480细胞增殖,呈剂量、时间依赖性。150μmol黄芩素作用SW480后,细胞出现明显的凋亡形态学改变。流式细胞术检测表明,150μmol黄芩素作用细胞后引起的凋亡率显著高于对照组(P<0.01)。黄芩素可以提高细胞Caspase-3活性并呈剂量依赖性。结论黄芩素可以抑制SW480细胞增殖,并可能通过Caspase-3依赖性通路诱导凋亡。
黄芩素;结肠肿瘤;SW480细胞;细胞凋亡
结肠癌已成为一种日益严重的健康问题,是世界范围内最常见的恶性肿瘤之一。特别是在欧美等发达国家,其已成为癌症患者高死亡率的主要原因之一[1-3]。在我国恶性肿瘤患者中,结肠癌的发病率仅次于肺癌和胃癌,位居第3位,死亡率位居第5位[4]。
黄芩属唇形科黄芩属植物,为多年生草本植物,以干燥根入药,是常用的传统中药之一,具有抗肿瘤、抗病毒、抗菌及抗炎活性[5-7]。黄芩素是黄芩根中的主要黄酮类化学成分。有研究表明,黄芩素能抑制胶质瘤和骨髓瘤细胞生长及诱导细胞凋亡[8-9]。目前,黄芩素对结直肠肿瘤细胞的影响及作用机制还不十分清楚。本实验以人结肠癌细胞系SW480为研究对象,观察黄芩素对SW480细胞的生长抑制和诱导细胞凋亡的作用,探讨黄芩素在结肠癌中的抗肿瘤活性。
1 材料与方法
1.1 材料
黄芩素、3-(4,5-二甲基噻唑-2)-2,5-二苯基四氮唑溴盐(商品名:噻唑蓝)[3-(4,5-dimethylthi ahiazo-z-y1)-2,5-di-phenytetrazoliumromide,MTT]和Hoechst33258购自美国Sigma公司,Annexin V-FITC kit购自德国Calbiochem公司;无血清细胞冻存(dulbecco modified eagle medium,DMEM)培养基及胎牛血清购自美国Gibco公司,Caspase-3检测试剂盒购自美国BioVision公司。
1.2 方法
1.2.1 细胞培养人结肠癌细胞系SW480购于上海生物研究所,来源为人结肠低分化黏液腺癌。SW480细胞常规培养于含10%小牛血清的DMEM培养基,放置在37℃、5%二氧化碳CO2培养箱中。经胰蛋白酶消化、传代,收集对数生长期细胞进行实验。
1.2.2 MTT法测定细胞增殖抑制率取收集对数生长期的SW480细胞,常规消化制备单细胞悬液,调整细胞浓度为5×104个/ml,将细胞悬液以200μl/孔接种于96孔板,5%CO2、37℃培养24 h。将实验分为4组,前3组分别加入相应的黄芩素溶液并使其最终浓度分别为25、50和100μmol,第4组为空白对照组,继续培养12、24、36、48和72 h后每孔加入浓度为5 mg/ml MTT溶液10μl,孵育4 h后终止,振荡15 min,选择490 nm波长,在酶联免疫检测仪上测定各孔吸光度光密度(optical density,OD)值,并按照以下公式计算细胞生长抑制率(inhibition rate,IR):IR=(1-空白组OD值/实验组OD值)×100%。根据抑制率曲线拟合48 h浓度与抑制率曲线,计算半数抑制浓度IC50。实验重复3次。
1.2.3 Hoechst 33258染色观察细胞形态将单细胞悬液接种于6孔板,5%CO2、37℃培养24 h,加入黄芩素溶液并使其最终浓度为100μmol,设立空白对照组,继续培养48 h后,将细胞固定在4%多聚甲醛中10 min,磷酸盐缓冲溶液(phosphate buffer saline,PBS)清洗2次,加入0.5 ml浓度为10μg/ml Hoechst 33258染色液,5 min后弃去染液并用PBS清洗2次。染色后用荧光倒置显微镜进行观察。
1.2.4 流式细胞术检测细胞凋亡调整SW480细胞浓度为5×104个/ml,2 ml/孔接种于6孔板中。待细胞贴壁后,分别加入相应的黄芩素溶液并使其最终浓度分别为25、50和100μmol,设立空白对照组,继续培养48 h。胰酶消化后,4℃、300×g离心5 min,弃上清液,收集细胞。PBS清洗2次后,加入100μl 1×Binding Buffer重悬细胞,再加入5μl Annexin V-FITC和5μl PI,混匀、避光,室温反应10 min。加入400μl 1×Binding Buffer,混匀。经流式细胞仪检测细胞凋亡。
1.2.5 Caspase-3活性检测收集SW480对数期细胞,调整细胞浓度接种于100 mm培养皿中,培养24 h后分别加入相应的黄芩素溶液并使其最终浓度分别为25、50和100μmol,设立空白对照组,继续培养12、24、48和72 h。收集细胞,100×g离心后弃上清液,加入细胞裂解液,充分混匀,冰上裂解20 min后离心,将上清液移入新的离心管并放置冰上,测定各样品的蛋白浓度。取等量的样品接种于96孔板,每孔加入50μl 2×反应液及5μl浓度为4mmol显色反应底物,混匀后37℃孵育1h。在405nm处测定其OD值。对照组计算值设定为100%,实验组值=实验组OD值/对照组OD值×100%。
1.3统计学方法
采用SPSS 19.0统计软件进行数据分析,计量资料以均数±标准差(±s)表示,用单因素方差分析来进行比较,P<0.05为差异有统计学意义。
2 结果
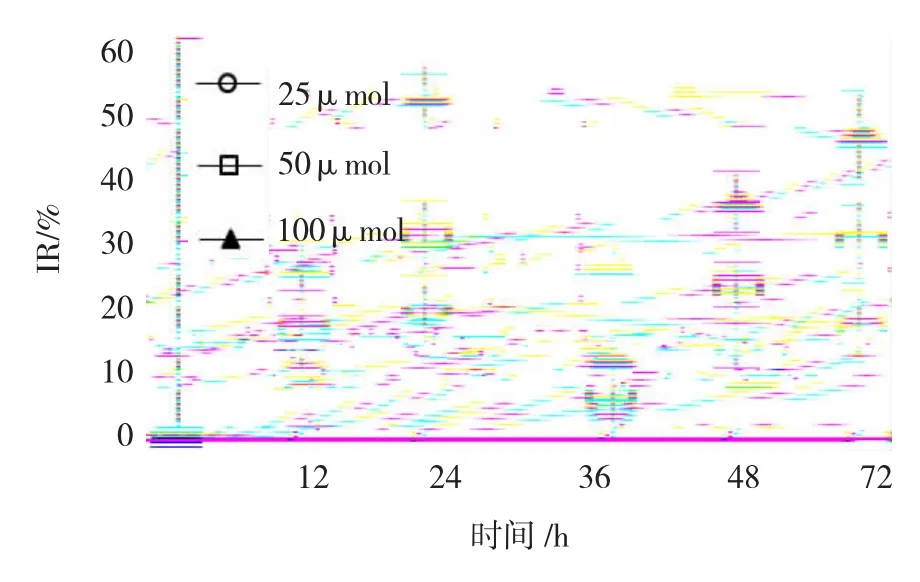
图1 不同浓度黄芩素对SW480细胞的生长抑制作用
2.1MTT比色法分析细胞生长的抑制作用
体外实验表明,黄芩素对SW480细胞有直接抑制作用,并呈现剂量、时间依赖性(见图1)。作用48 h后,100μmol浓度的黄芩素对细胞的抑制作用最明显,达51.32%,与其他处理组比较,差异有统计学意义(P<0.01)(见表1)。72h检测细胞抑制率低于48h,但相同浓度下72 h与48 h抑制率比较,差异无统计学意义(P>0.05)。根据拟合曲线计算其半数抑制浓度IC50=93.51μmol。
2.2 SW480细胞的形态学变化
100μmol黄芩素作用SW480细胞48 h,经10μg/ml Hoechst 33258染色处理5 min后,与对照组细胞比较,荧光显微镜可观察到黄芩素处理组的细胞核中染色质凝集、固缩,形成明显的凋亡小体。见图2。
表1 不同浓度黄芩素对SW480细胞增殖的抑制率(s)
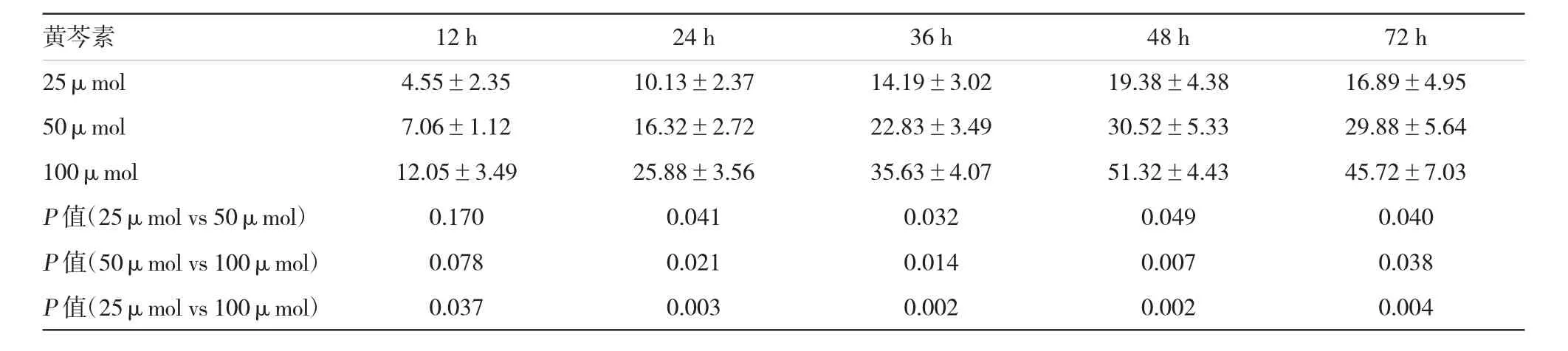
表1 不同浓度黄芩素对SW480细胞增殖的抑制率(s)
黄芩素12 h24 h36 h48 h72 h 25μmol4.55±2.3510.13±2.3714.19±3.0219.38±4.3816.89±4.95 50μmol7.06±1.1216.32±2.7222.83±3.4930.52±5.3329.88±5.64 100μmol12.05±3.4925.88±3.5635.63±4.0751.32±4.4345.72±7.03P值(25μmol vs 50μmol)0.1700.0410.0320.0490.040P值(50μmol vs 100μmol)0.0780.0210.0140.0070.038P值(25μmol vs 100μmol)0.0370.0030.0020.0020.004
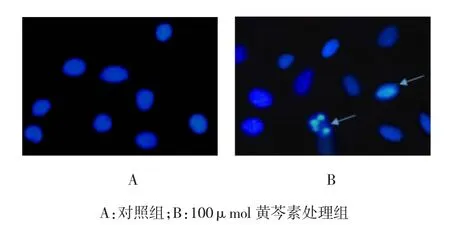
图2 黄芩素作用48 h后SW480细胞的形态学变化(×400)
2.3各组SW480细胞的凋亡
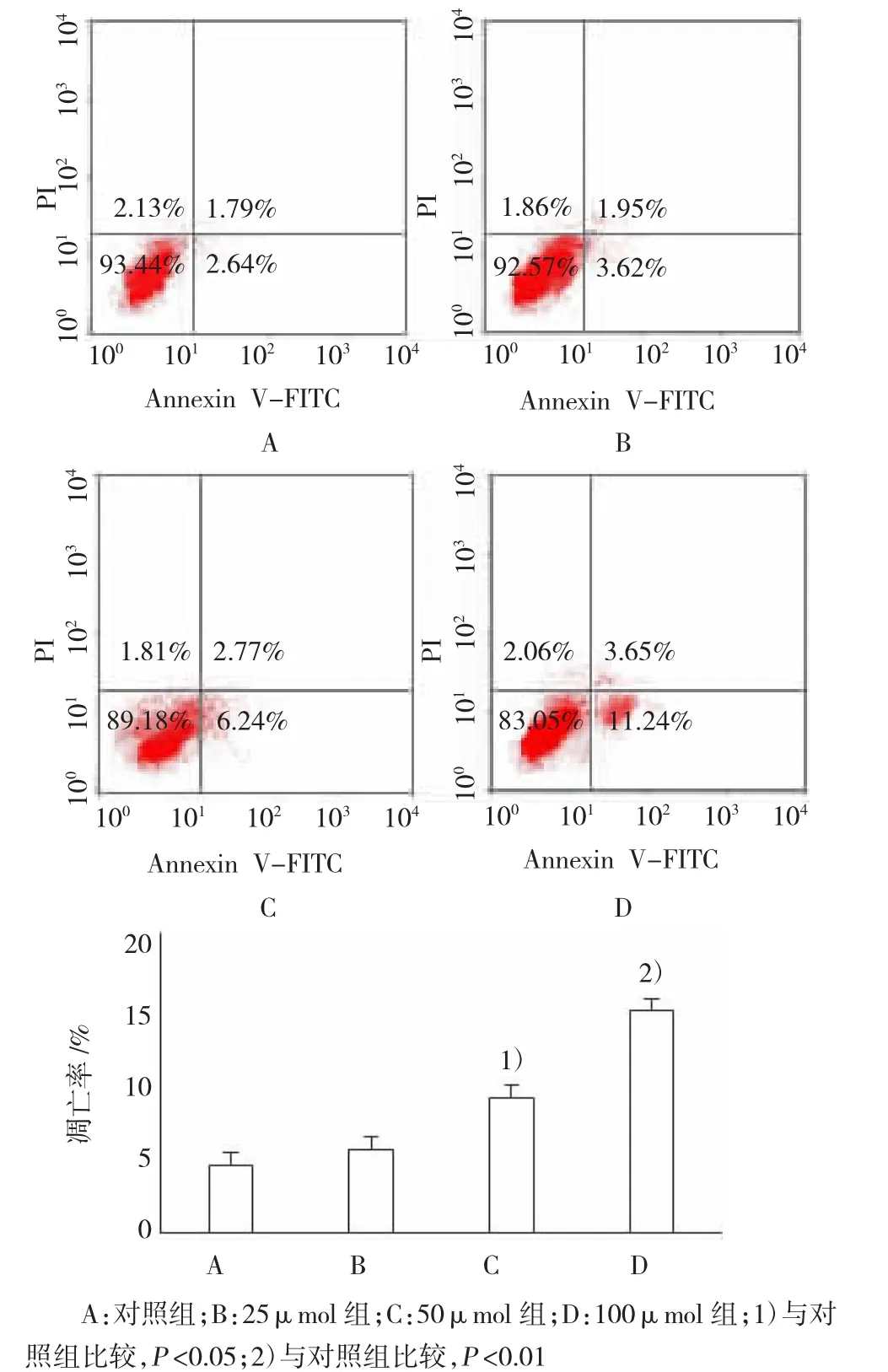
图3 流式细胞术检测黄芩素作用于SW480细胞的凋亡结果
表2 不同浓度黄芩素对SW480细胞Caspase-3活性的影响(±s)
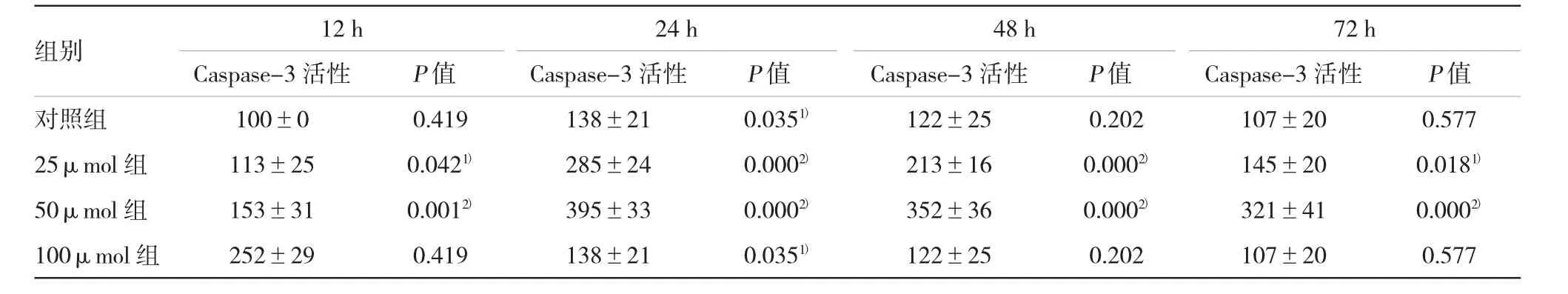
表2 不同浓度黄芩素对SW480细胞Caspase-3活性的影响(±s)
注:1)与对照组比较,P<0.05;2)与对照组比较,P<0.01
组别12 h24 h48 h72 h Caspase-3活性Caspase-3活性Caspase-3活性Caspase-3活性P值对照组100±00.419138±210.0351)122±250.202107±200.577 25μmol组113±250.0421)285±240.0002)213±160.0002)145±200.0181)50μmol组153±310.0012)395±330.0002)352±360.0002)321±410.0002)100μmol组252±290.419138±210.0351)122±250.202107±200.577P值P值P值
不同浓度的黄芩素作用SW480细胞48 h后,经流式细胞仪检测细胞凋亡率。对照组、25、50和100μmol黄芩素处理组的凋亡率分别为(4.43±1.82)%、(5.57±2.19)%、(9.01±1.56)%和(14.89±2.04)%。与对照组比较,50μmol黄芩素处理组凋亡率升高,差异有统计学意义(P=0.029);100μmol黄芩素处理组凋亡率明显升高,差异有统计学意义(P=0.003)。见图3。
2.4凋亡相关Caspase-3活性
黄芩素作用SW480细胞后,Caspase-3活性随着时间延长呈上升趋势,24 h后下降,各组趋势一致。但与对照组比较,25μmol组Caspase-3活性变化不明显;50和100μmol组比较差异有统计学意义(P<0.05)。见表2。
3 讨论
细胞增殖和凋亡调控的紊乱与恶性肿瘤的发生、发展关系密切。抑制肿瘤细胞的过度增殖,选择性诱导肿瘤细胞凋亡是治疗恶性肿瘤的一个方向[10]。治疗上可以通过增加诱导凋亡基因的表达和抑制抗凋亡基因的表达来实现。本研究分析来自于黄芩的一种黄酮类化合物——黄芩素的抗肿瘤作用,将不同浓度的黄芩素作用于人结肠癌SW480细胞并进行培养,通过MTT比色、形态学变化及流式细胞术检测细胞的增殖凋亡。
有研究表明,黄芩素能够通过不同途径抑制各种肿瘤细胞的生长并诱导其发生凋亡。黄芩素能够抑制肝癌细胞的增殖并诱导细胞的凋亡[11]。黄芩素通过抑制胃癌细胞血管内皮生长因子和肝细胞生长因子的表达来抑制胃癌细胞的增殖与凋亡[12]。黄芩素在20~120μmol浓度下能够显著抑制人乳腺癌细胞MCF-7和MDA-MB-231的生长[13]。黄芩素呈剂量、时间依赖性抑制人胰腺癌PANC-1细胞增殖,影响肿瘤细胞伪足的形成,导致细胞的侵袭力下降[14]。黄芩素通过抑制人乳腺癌细胞富含AT序列的特异结合蛋白1基因的表达,发挥其抑制乳腺癌细胞生长的作用[15];黄芩素经Caveolin-1/AKT/mTOR途径抑制人前列腺癌细胞的生长及侵袭[16]。
本研究表明,黄芩素能够明显抑制人结肠癌SW480细胞的增殖,并呈剂量、时间依赖性,而实验中笔者观察到不同浓度黄芩素处理组72 h细胞抑制率相对48 h出现下降,但两者差异无统计学意义。根据对照组肿瘤细胞的生长曲线,发现72 h后细胞生长速度下降,分析出现该现象的原因可能与肿瘤细胞生长以及对药物敏感性下降有关,但具体机制需进一步研究证实。在显微镜下可以观察到黄芩素处理组肿瘤细胞发生细胞核中染色质凝集的形态学改变,提示在体外实验中黄芩素可能诱导结肠腺癌细胞发生凋亡。为进一步验证黄芩素促凋亡作用,本实验通过流式细胞术检测凋亡细胞所占的比例,100μmol浓度黄芩素处理组的细胞凋亡比例显著高于对照组(P<0.01),进一步提示黄芩素能够促进人结肠癌SW480细胞的凋亡。
Caspase蛋白家族和Bcl-2蛋白家族是参与凋亡进程的两个蛋白家族,前者负责凋亡的执行,后者调控线粒体的完整性[17]。目前已确定哺乳动物有14种Caspase酶类。其中Caspase-3属于凋亡调控下游环节的剪切酶,可通过作用于多种底物,参与细胞凋亡的调控[16]。已有研究表明,Caspase-3表达率降低与喉癌、鼻咽癌、食管癌、胃癌、直肠癌等恶性肿瘤的发生、发展有关[18]。
黄芩素可以促进SW480细胞的Caspase-3活性增加,提示黄芩素可能通过Caspase-3依赖性信号通路来发挥促凋亡作用。
黄芩素作为来源于传统中药黄芩的天然化合物,在抗炎、抗肿瘤方面起一定的作用,临床应用潜力大,但黄芩素的抗肿瘤详细机制还不清楚,需要进一步研究。
[1]FERLAY J,STELIAROVA-FOUCHER E,LORTET-TIEULENT J,et al.Cancer incidence and mortality patterns in Europe∶estimates for 40 countries in 2012[J].Eur J Cancer,2013,49(6)∶1374-1403.
[2]MUNRO AJ.Comparative cancer survival in European countries[J].Br Med Bull,2014,110(1)∶5-22.
[3]TARVER T.American cancer society cancer facts and figures 2014[J].Journal of Consumer Health on the Internet,2012,16(3)∶366-367.
[4]陈万青,张思维,郑荣寿,等.中国2009年恶性肿瘤发病和死亡分析[J].中国肿瘤,2013,1∶2-12.
[5]RAZINA TG,UDINTSEV SN,TIUTRIN II,et al.The role of thrombocyte aggregation function in the mechanism of the antimetastatic action of an extract of baikal skullcap[J].Vopr Onkol,1989,35(3)∶331-335.
[6]MAHMOOD N,PIZZA C,AQUINO R,et al.Inhibition of HIV infection by flavanoids[J].Antiviral Res,1993,22(2/3)∶189-199.
[7]KUBO M,KIMURA Y,ODANI T,et al.Studies on scutellariae radix.PartⅡ∶the antibacterial substance[J].Planta Med,1981,43(2)∶194-201.
[8]KYO R,NAKAHATA N,SAKAKIBARA I,et al.Baicalin and baicalein,constituents of an important medicinal plant,inhibit intracellular Ca2+elevation by reducing phospholipase C activity in C6 rat glioma cells[J].J Pharm Pharmacol,1998,50(10)∶1179-1182.
[9]MA Z,OTSUYAMA K,LIU S,et al.Baicalein,a component of scutellaria radix from huang-lian-jie-du-tang(HLJDT),leads to suppression of proliferation and induction of apoptosis in human myeloma cells[J].Blood,2005,105(8)∶3312-3318.
[10]GREENDR,GALLUZZIL,KROEMERG.Cellbiology.Metabolic control of cell death[J].Science,2014,345(6203)∶1446.
[11]向淼,徐细明,邓君健,等.黄芩素诱导人肝癌细胞株SMMC-7721凋亡作用的研究[J].现代肿瘤医学,2012,6∶1098-1103.
[12]张伟,刘宽浩.黄芩素对胃癌细胞VEGF和HGF表达的影响[J].现代预防医学,2011,11∶2135-2137.
[13]徐维恒,肖雷,马宜明.黄芩素对乳腺癌细胞MCF-7和MDA-MB-231增殖的影响[J].中国药师,2011,1∶26-28.
[14]任学群,李宜雄.黄芩素对人胰腺癌PANC-1细胞增殖和运动能力的影响[J].河南大学学报(医学版),2010,3∶180-185.
[15]GAO XY,XUE XH,MA YN,et al.Effect of baicalein on the expression of SATB1 in human breast cancer cells[J].Experimental and Therapeutic Medicine,2015,9(5)∶1665-1669.
[16]GUO Z,HU X,XING Z,et al.Baicalein inhibits prostate cancer cell growth and metastasis via the caveolin-1/Akt/mTOR pathway[J].Mol Cell Biochem,2015,406(1/2)∶111-119.
[17]MCILWAIN D,BERGER T,MAK TW.Caspase functions in cell death anddisease[J].ColdSpring HarbPerspect Biol,2013,DOI∶10.1101/cshperspect.a026716.
[18]MAZUMDER S,PLESCA D,ALMASAN A.Caspase-3 activation is a critical determinant of genotoxic stress-induced apoptosis[J].Methods Mol Biol,2008,414∶13-21.
(申海菊 编辑)
Effect of Baicalein on proliferation and apoptosis of SW480 cell line
Ning WANG,Ling-li CHANG,Qi CHENG,Yan-xin ZHANG
(Department of Basic Medical Science,Luohe Medical College,Luohe,Henan 462000,P.R.China)
【Objective】To study the effects of Baicalein on proliferation and apoptosis in human colon carcinoma cell line SW480,and to explore the apoptosis mechanism.【Methods】The effect of Baicalein on the proliferation of SW480 was detected by MTT analysis.The morphological manifestation of SW480 cells stained by Hoechst 33258 was investigated with fluorescence microscopy after the cells were treated with Baicalein for 48 hours.Apoptosis was also examined by flow cytometry.Variation regularity of the activity of caspase-3 was detected with the test kit.【Results】Baicalein significantly inhibited SW480 proliferation in a dose-and time-dependent manner.The characteristic morphological changes of apoptosis were observed under microscopy in SW480 cells treated with 150 μmol of Baicalein.It showed that the apoptosis rate in the group of 150 μmol Baicalein was significantly higher than that in the control group(P<0.01).Baicalein promoted the activity of caspase-3 in SW480 cells in a dose-dependent manner.【Conclusions】Baicalein can inhibit the proliferation of SW480 cells and induce cell apoptosis through the caspase-3 dependent pathway.
Baicalein;colonic neoplasm;SW480;apoptosis;caspase-3
R735.35
A
1005-8982(2015)35-0022-05
2015-03-19

