孔雀石绿及其代谢物在鲫亲子代间传递的研究
柯江波,胡 鲲,曹海鹏,杨先乐
(上海海洋大学国家水生动物病原库,上海201306)
孔雀石绿(malachite green,MG)于1933年被发现对鱼卵中霉菌、鱼体寄生虫具有良好的杀灭效果,开始广泛被应用于水产养殖[1]。然而,从20世纪90年代开始,国内外大量的研究发现,孔雀石绿降解时间长,及其代谢产物无色孔雀石绿(lecuomalachite green,LMG)在鱼体内和环境中残留时间长[2-3],其化学官能团“三苯甲烷”被确证具有高毒、高残留、“三致”等毒副作用[4],因此,欧美等国家陆续禁止孔雀石绿应用于渔业中,我国也于2002年在水产养殖中禁止使用孔雀石绿。2006年,英国首先在鲑中检测出孔雀石绿残留,为水产品质量安全敲响了警钟。同年,中国的“多宝鱼事件”使得孔雀石绿残留受到广泛关注。我国市售水产品中孔雀石绿检出率高已是不争的事实,自2006年以来,我国陆续报道水产品MG残留的调查,包括广东、浙江、湖北和福建等地区,采用高效液相色谱法或者质谱联用技术,各地孔雀石绿残留的检出率有较大差异,除了广东湛江出口水产品未检出MG外,其余各地均有抽检样品检测出孔雀石绿残留。进一步对批发市场的养殖水以及餐厅暂养用水进行采样检测,未发现有孔雀石绿残留,从而很大程度上排除了运输、贮存等环节用药的可能性,推测市售水产品中孔雀石绿残留的来源主要是养殖环节[5]。
迄今为止,国内外对孔雀石绿的研究主要集中在代谢机制以及残留检测方法等。对于孔雀石绿在鱼类组织中的残留是否会随着繁殖而传递尚无研究。孙言春等[6]建立了生殖组织(精巢/卵巢)中孔雀石绿残留的检测方法,并检测证明多年前使用孔雀石绿的池塘再养殖种鱼,可在精巢/卵巢检测到MG和LMG,然而并未进一步验证生殖组织中的孔雀石绿残留是否会传递到子代中。孔雀石绿禁用前曾被广泛应用于鱼卵中水霉病的防治,对鱼卵中药浴孔雀石绿后的残留消除已有研究[7]。然而亲鱼阶段用药与鱼卵浸泡用药两种条件下受精卵及其鱼苗中残留消除情况是否存在差异,尚没有报道,有待对比验证。本试验观察这两种污染条件下,鱼类子代中孔雀石绿的残留消除规律,以期为水产品中孔雀石绿溯源分析提供科学依据。
1 材料与方法
1.1 材料
1.1.1 试验用鱼 健康且大小相近的鲫亲鱼(Carassius auratus)900条,购于湖北省仙桃市沙湖水产技术推广站,体重358g±10g,已完成人工饲料驯化。选择健康无病害的个体,雌鱼要求含卵率高。雌雄分开,各400条于水泥池(4m×4m)中暂养,24h增氧,每天换水1/3。饲养水温15℃~21℃,每日投饵2次(6:00,18:00),饲料采用空白配合饲料,投喂率为体重的2%~5%,视摄食状况调整,定期捞除残饵。暂养14d后正式试验。
1.1.2 主要试剂与仪器 孔雀石绿(MG)标准品(含量≥99.9%)和无色孔雀石绿(LMG)标准品(含量≥99.6%),Sigma公司产品;浸泡用孔雀石绿(纯度≥90%),上海生工试剂有限公司产品,于浸泡前30min用无菌水配制浓度为5mg/mL的溶液,备用。酸性氧化铝(粒度0.071mm~0.150mm);乙腈、二氯甲烷、冰乙酸均为色谱纯,水为超纯水;Agilent-1100型高效液相色谱仪(四元泵、自动进样器、柱温箱、荧光检测器)、漩涡混合器、旋转蒸发仪、精密电子天平(METTLER AB104-N)、高速冷冻离心机和SUPELCO 12管固相萃取装置,北京成萌伟业科技有限公司产品。
1.2 方法
1.2.1 亲鱼阶段 暂养结束后,停食1d,从雌雄亲鱼养殖塘中各随机选取10条鱼,作为空白对照。再从暂养网箱中分别随机捞取雌雄鲫各150条,于0.5mg/L的孔雀石绿溶液中浸泡4h,清水洗净后,分别放入2个水泥池中饲养,记为药浴组1(雌),药浴组2(雄),捞取同样数量的雌雄亲鱼分开放入另外2个水泥池中饲养,记为空白组1(雌),空白组2(雄);饲养条件与暂养相同,另配合投喂新鲜蔬菜。为保持水质良好,定时加入少量新水,为亲鱼的性腺发育创造良好的水环境。人工催产前30d左右,精饲料投喂量应减少,青饲料量则应增加,并逐步增加冲水次数和冲水量,以加速亲鱼性腺发育。于药浴后 0、0.5、1、2、4、6、12、24、48、72、120、240、480、720h(30d)各个时间点从药浴组1(雌),药浴组2(雄)中分别随机取8尾鱼,取肌肉组织、肝脏组织、精/卵巢组织,每4尾鱼的同一组织绞碎并均匀混合后作为一个分析样品,每个样品上机测定2次。
1.2.2 人工繁殖 药浴试验进行至第30天,将药浴组1、2的亲鱼与空白组1、2的亲鱼进行交叉繁殖。A组:空白雌鱼+空白雄鱼,B组:空白雌鱼+药浴雄鱼,C组:药浴雌鱼+空白雄鱼,D组:药浴雌鱼+药浴雄鱼。经药物催产,人工受精,收集各组受精卵。
1.2.3 受精卵及鱼苗阶段 取A组部分空白受精卵(约80g),于0.15mg/L孔雀石绿溶液中浸泡1h,清水冲洗后放于网片上孵化,标记为E组。于受精后第0(人工受精当天)、1、2、3、4、5、6、7、8、16、32天各个时间点取受精卵或鱼苗样品,每个样品约4g,测定2次。另外,从各组中随机选取100枚受精卵(剔除未受精卵),观察5组受精卵的出膜时间、胚胎死亡率。
1.2.4 样品预处理
1.2.4.1 鱼类肌肉及内脏样品预处理 参照国家标准GB/T20361—2006《水产品中孔雀石绿和结晶紫残留量的测定高效液相色谱荧光检测法》[8],对鱼类肌肉及内脏团进行预处理,上机检测。
1.2.4.2 鱼类精巢、卵巢及受精卵预处理 参照孙言春等[13]对受精卵和卵巢以及精巢样品进行预处理。于40℃旋转蒸干后,加入50μL 0.2mol/L硼氢化钾溶液,用3mL乙腈溶解残渣,充分溶解60s,加入5mL正己烷,涡旋处理30s,4 000r/min离心8min,取下层清液,过0.45μm有机相滤膜后,上机检测。
1.2.5 色谱条件 激发波长265nm;发射波长360nm;流动相,即乙腈∶乙酸铵(pH 4.5)=80∶20(V∶V);流速1.5mL/min;进样量20μL;柱温40℃。
1.2.6 数据分析 样品前处理中,孔雀石绿经硼氢化钾还原后转化为无色孔雀石绿,通过荧光检测器检测出的浓度为样品中无色孔雀石绿与孔雀石绿的总浓度,采用 Microsoft Excel 2013软件对数据进行处理和分析,并制表和绘图。
2 结果
2.1 标准曲线、线性范围以及最低检测限
肌肉、内脏团、生殖组织等空白组织中添加孔雀石绿标准液,浓度梯度为1、10、50、100、200、500、1 000、2 500μg/kg,按照1.2.4进行前处理,根据1.2.5的色谱条件检测,以峰面积(Y)为纵坐标,LMG的浓度(X)为横坐标,绘制标准曲线,其线性关系和最低检测限见表1。结果表明孔雀石绿在1 μg/kg~2 500μg/kg范围内线性关系良好,适用于定量分析,以引起3倍基线噪音的药量为最低检测限,本方法中各组织的最低检测限为1、1、2、2μg/kg。组织中添加适量的孔雀石绿浓度呈3个不同浓度梯度10、50、100μg/kg,经前处理并测定得出肌肉、内脏团、精巢和卵巢中药品回收率分别为82.64%~95.38%、86.18%~97.94%、77.2%~97.62%、81.92%~98.85%。各组织日内(n=4)相对标准差(RSD)在1.56% ~7.48%之间,日间(n=4)相对标准差在3.54%~8.64%之间。该检测方法可靠,重复性良好,准确度和精密度均符合残留分析要求。

表1 不同样品中孔雀石绿的线性参数及检测限Table 1 Linear relation and deteetion limit of MG in different samples
2.2 孔雀石绿在亲鱼体内的残留
亲鱼在0.5mg/L的孔雀石绿药浴1h后,肌肉与内脏组织中在药浴结束后检测到有较多的残留,随时间的推移逐渐减少;生殖组织中初始残留浓度较低,出现先上升,达到平衡后缓慢下降的趋势。雌雄亲鱼各组织中孔雀石绿残留浓度变化规律无显著差异。
由图1可知,亲鱼浸泡孔雀石绿后0h时,精巢、卵巢中均未检测到孔雀石绿及其无色孔雀石绿的残留,0.25h开始检测到MG,之后浓度逐渐增加,均在第4天达到峰值,雌雄亲鱼分别为63.4μg/kg±1.3μg/kg和43.6μg/kg±1.2μg/kg,可能原因是孔雀石绿进入鱼体内主要通过皮肤吸收,口、鳃的吸入作用,所以药浴后在肌肉和内脏中产生较多的残留,而经过一段时间的代谢,鱼体内的MG残留部分转移到其他组织中,部分在生殖组织中产生蓄积。同一时间点的残留浓度大小:内脏团>肌肉>生殖组织,内脏中的残留主要通过鳃的呼吸和摄取水中悬浮颗粒物,因此其在内脏中浓度最高,肌肉中的残留主要来源于水中,浓度次之。孔雀石绿在鱼体内的代谢较慢,在第768小时(32d),卵巢中MG浓度为33.5μg/kg±0.3μg/kg,精巢中 MG 浓度为15.4μg/kg±1.2μg/kg。研究表明,无色孔雀石绿具有很强的亲脂性,在脂肪含量较多的组织残留时间更长[9]。鱼类脂肪呈不均匀分布,主要存在于皮下和脏器周围,肌肉组织中含量甚少,鱼卵和精巢含有丰富的脂肪[10]。因此,精巢、卵巢中 MG的消除速率相对于肌肉及内脏较慢(图1)。
2.3 不同处理条件下鲫子代体内的孔雀石绿残留
结果显示,亲鱼体内残留的孔雀石绿会通过繁殖行为在子代中产生残留,与空白受精卵浸泡孔雀石绿产生的残留浓度相比,前者的残留浓度较低。如表2所示,在第1天除A组未检测到MG外,亲鱼污染传递组B、C、D,均在受精卵中检测出,分别为5.1、23.8、29.5μg/kg。试验结果证明了孔雀石绿残留可以在鱼类亲子代间传递。B组在第5天检测不到药物残留,C组、D组在第32天仍有少量残留。E组受精卵浸泡孔雀石绿,初始残留浓度较高,为1 265.8μg/kg,而在鱼苗完全孵出后(第5天)的取样检测,鱼苗中残留量为163.4μg/kg。

图1 雌雄亲鱼肌肉、内脏、精/卵巢中孔雀石绿的浓度变化Fig.1 Concentration changes trend of MG in muscle,viscera,sperm/ovary of parent fish
在胚胎发育过程中,卵凝结一般导致胚胎发育停止,胚胎趋于死亡或者死亡。在72h时,有些胚胎孵化不出来,发生卵凝结,也作为死亡一起统计。对不同时间内鲫胚胎死亡数量进行统计结果见图2。胚胎在孵化48h后就出现卵凝结现象,且A、B组卵凝结率较C、D、E组明显。同一组别胚胎卵凝结率。随时间的增加而增加。
如图3,残留有孔雀石绿的胚胎出膜要比A组无污染胚胎出膜延迟。A组胚胎在72h完全出膜,B、C组在96h完全出膜,而D组胚胎延迟到96h。受精卵浸泡使用孔雀石绿,其出膜时间要长于亲鱼体内胚胎染毒的时间。
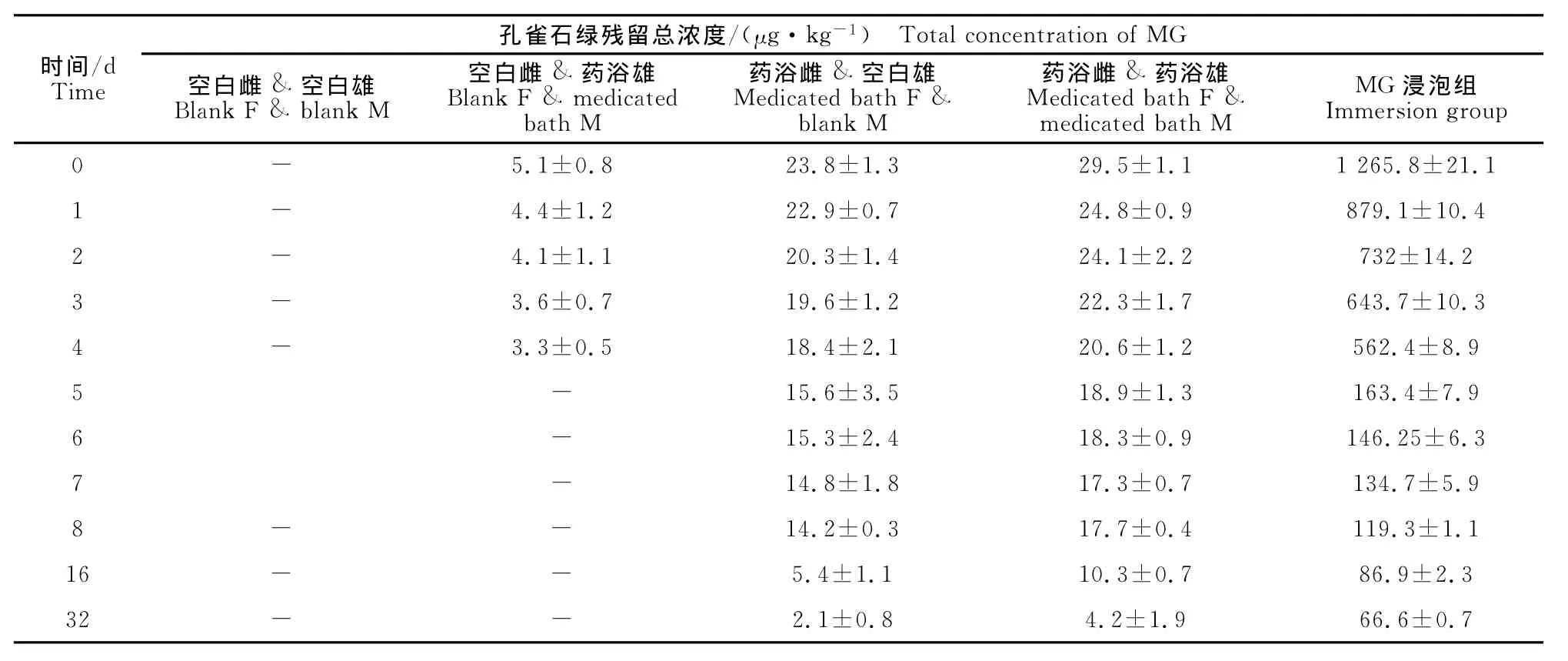
表2 鲫受精卵以及鱼苗中孔雀石绿浓度变化Table 2 Concentration changes of MG in fertilized eggs and fry of crucian carp

图2 受精卵的死亡率Fig.2 The mortality of embryos

图3 受精卵的出膜时间Fig.3 The hatching time of embryos
3 讨论
受孔雀石绿污染的雌雄亲鱼分别与空白雌雄亲鱼交叉繁殖,人工授精产出的受精卵中药物残留浓度存在差异,这可能与繁殖行为中雌雄配子贡献的物质比例不同有关。与精子相比,卵子提供较多的物质,从而导致受污染卵子形成的受精卵中孔雀石绿残留浓度较大。
无污染的受精卵浸泡0.15mg/L的孔雀石绿溶液1h,在受精卵中检测出大量的MG残留,在其出膜前,受精卵中MG残留保持在一个较高的水平。第5天完全出膜后,鱼苗中孔雀石绿的浓度大幅度下降。可能的原因是药浴过程中,水中的孔雀石绿主要在受精卵表面吸附,受精卵个体小,比表面积大,因此吸附了大量的MG。同时,部分MG经渗透作用进入受精卵中,在孵化过程中,卵膜上的药物残留不断释放到水体中,同时卵膜能阻隔大部分的孔雀石绿。大量的孔雀石绿未能进入受精卵的胚胎内,有效保护了胚胎的发育。张明辉等[7]的研究以10.0mg/L浓度的孔雀石绿处理异育银鲫、团头鲂受精卵10min,结果显示,初始浓度分别为20 886.73、25 569.30μg/kg,在出苗第10天的药物浓度远远低于浸泡后初始浓度,这与本试验结果基本一致。
鲤、鲫等产黏性卵,在孵化阶段易感染水霉,导致孵化率低。而孔雀石绿的使用能在此阶段有效地防治水霉,亲脂性无色孔雀石绿入侵细胞能力较强,抑菌效果明显[11]。研究证明,孔雀石绿不仅可以有效地控制卵菌纲真菌在鱼卵和鱼体上的生长繁殖,同时可预防和治疗二次感染[12]。
本试验条件下,受精卵的死亡率主要来源于水霉菌感染,受精卵从亲鱼获得的MG残留,对水霉起到一定的抑制作用,受精卵中MG浓度越高,死亡率越低,空白受精卵约有90%死亡率。经药浴的受精卵未发现有水霉感染,说明吸附在受精卵表面的孔雀石绿起到很好的抑制水霉作用。受精卵中孔雀石绿的含量与其出膜时间呈现一定的反比例关系。Meyer F P等[13]发现,虹蹲鱼卵在高剂量的孔雀石绿溶液(0.20μg/L)中长时间暴露后,胚胎的存活率下降,孵化时间延长,孵化出的鱼苗出现脊椎、头、背鳍等部位的畸变。
由于孔雀石绿的高效以及价格低廉,部分育苗场仍在偷偷使用孔雀石绿用于防治水霉病。在水产执法过程中,部分养殖户以购买的亲鱼残留MG导致鱼卵中检测出为由,否认使用孔雀石绿浸泡鱼卵。根据本试验结果,孔雀石绿从亲代传递到子代,鱼卵中的残留初始浓度一般较低。通过浸泡孔雀石绿的鱼卵,其初始残留浓度则较高,在出苗前一直保持较高的水平,且在出苗后,鱼苗中孔雀石绿的浓度相比于鱼卵,有大幅度的下降。了解这两种不同来源的污染导致鱼类子代中MG残留浓度存在差异,可为鱼卵阶段的药物残留溯源分析提供判别方法。执法部门在对育苗场进行抽查时,抽检鱼卵并进行一定时间的跟踪检测,以明确用药途径,追究相关责任人,从而在源头上杜绝孔雀石绿的使用。
[1]徐向荣,郝 青,彭加喜,等.水产品中残留孔雀石绿研究进展[J].热带海洋学报,2013(4):97-106.
[2]李红霞,那广水,贺 伟,等.孔雀石绿及其代谢物研究概况[J].水产科学,2008(8):430-432.
[3]Bilandzic N,Varenina I,Kolanovic B S,et al.Malachite green residues in farmed fish in Croatia[J].Food Control,2012,26(2)393-396.
[4]Culp S J,Beland F A.Malachite green:a toxicological review[J].Int J Toxicol,1996,15(3):219-238.
[5]傅武胜,郑奎城,邱文倩,等.养殖鱼孔雀石绿及其代谢物残留量的调查与溯源[J].食品安全质量检测学报,2013(1):176-182.
[6]孙言春,吴 松,牟振波.液相色谱串联质谱法测定鲤科鱼受精卵、卵巢及精巢中孔雀石绿及隐色孔雀石绿残留[J].中国渔业质量与标准,2012(1):80-86.
[7]张明辉,肖 雨,何正侃,等.孔雀石绿浸泡几种鱼类受精卵及苗种后的降解规律研究[J].水产科技情报,2012,39(5):238-242.
[8]GB/T 20361—2006,水产品中孔雀石绿和结晶紫残留量的测定高效液相色谱荧光检测法[S].2006.
[9]Bergwerff A A,Kuiper R V,Scherpenisse P.Persistence of residues of malachite green in juvenile eels(Anguillaanguilla)[J].Aquaculture,2004,233(1):55-63.
[10]代忠波,丁卓平,刘承初,等.三种淡水养殖鱼鱼卵的营养价值评价[J].营养学报,2007(1):103-104.
[11]张世奇.抗水霉药物的筛选及其制剂的应用效果研究[D].上海:上海海洋大学,2011.
[12]王 群,宋 怿,马 兵.水产品中孔雀石绿的风险评估(二)[J].中国渔业质量与标准,2012(1):22-26.
[13]Meyer F P,Jorgenson T A.Teratological and other effects of malachite green on development of rainbow trout and rabbits[J].Transact Am Fish Soc,1983,112(6):818-824.

