金黄色葡萄球菌表面蛋白SdrD的原核表达及抗体制备
杜欣军,王学连,李 萍,耿洁洁,张洪娟,王 硕
(天津科技大学食品工程与生物技术学院,食品营养与安全教育部重点实验室,天津 300457)
奶牛乳房炎(Mastitis)在世界各国都是影响牛奶生产的最为重要的疾病之一[1],也是造成经济损失最多的一种疾病,全球每年因乳房炎造成的损失约为350亿美元[2]。近年来,我国奶牛产业发展迅速,但是由于技术水平、养殖条件等方面的限制,我国因乳房炎造成的经济损失约100亿元[3]。金黄色葡萄球菌是引起奶牛乳房炎最常见的致病菌之一,可直接影响奶牛的产奶量、奶品质,最终造成奶品质低下,甚至弃用,并因为投入巨大的医疗费用而造成经济损失[4]。金黄色葡萄球菌已成为阻碍奶牛业发展的一种重要危害因素。
金黄色葡萄球菌含有多种表面蛋白,如凝集因子 A(clumping factor A,ClfA)、凝集因子 B(clumping factor B,ClfB)、胶原结合蛋白(collagen adhesion,Cna)、纤连蛋白结合蛋白 A(fibronectin-binding protein A,FnBPA)、纤连蛋白结合蛋白 B(fibronectin-binding protein B,FnBPB)、铁调节表面决定子 A(iron-regulated surface protein A,IsdA)、铁调节表面决定子B(iron-regulated surface protein B,IsdB)、丝氨酸-天冬氨酸重复蛋白家族(serine-aspartate repeat-containing protein,Sdr)等[5]。Sdr蛋白家族是识别细胞外基质分子的微生物表面组分,其名称的由来是因为其R区基因能够编码包含多个丝氨酸-天冬氨酸的多肽。Sdr基因簇由3部分组成,分别为sdrC(2.8bp)、SdrD(3.9bp)和sdrE(3.5bp)[6]。虽然Sabat A 等[6]研究表明并不是所有的金黄色葡萄球菌菌株都含有sdrC、SdrD和sdrE基因,但是很多研究表明该类蛋白能够起到较好的免疫保护作用。Stranger-Jones Y K 等[7]研究发现,用IsdA、IsdB、SdrD和SdrE蛋白免疫小鼠能够获得很强的免疫应答反应,4种表面蛋白制备的复合疫苗能够产生很高水平的保护作用。Becherelli M 等[8]研究指出,3种 Sdr蛋白 (SdrC、SdrD 和SdrE)的保守结构域 CnaBE3(the third B repeat of SdrE)对于金黄色葡萄球菌的感染具有明显的免疫保护作用。此外,Trad S J等[9]研究指出,SdrD 基因与骨感染有很大的关系。以上研究表明,SdrD是一种重要的金黄色葡萄球菌表面蛋白,该蛋白在基因工程疫苗开发、检测技术建立及金黄色葡萄球菌致病机制的深入研究方面都具有重要的价值。
本研究克隆了SdrD基因,对该基因进行了原核表达,并制备了多克隆抗体,为金黄色葡萄球菌保护性疫苗的开发、免疫检测技术的建立奠定了基础。
1 材料与方法
1.1 材料
金黄色葡萄球菌标准菌株ATCC25923、ATCC49521、ATCC55804、ATCC49525,ATCC 公司产品;金黄色葡萄球菌地方分离菌株由本实验室保存;载体pET26b,Novagen公司产品。
1.2 方法
1.2.1 SdrD的基因克隆 将4株金黄色葡萄球菌标准菌株及地方分离菌株过夜培养,用基因组DNA提取试剂盒(天根)提取其基因组。
根据SdrD基因设计特异性引物,并以提取的基因组为模板扩增其基因片段。
所用引物:SdrD F:TACTCAgaattg-GCAGAAAGTACTAATAAAGAATTG(小写字母为EcoRⅠ酶切位点);SdrD R:TACTCActcgagTTTATAAGTTCCATTTTCTAATCC(小 写字母为XhoⅠ酶切位点)。
PCR反应程序:94℃5min;94℃30s,55℃30s,72℃50s,进行35个循环;72℃10min。
1.2.2 重组质粒pET26b-SdrD的构建 将回收的SdrD片段与载体pET26b用EcoRⅠ和XhoⅠ进行酶切,纯化回收后进行连接。转化大肠埃希菌DH5α后筛选阳性克隆,并对重组质粒进行PCR和双酶切鉴定。
1.2.3 SdrD蛋白的诱导表达 将鉴定正确的重组质粒pET26b-SdrD转入大肠埃希菌表达菌株BL21(DE3)中,加入终浓度为0.1mmol/L的IPTG诱导5h,SDS-PAGE检测蛋白表达情况。
选取终浓度分别为 0.05、0.1、0.5、1.0、2.0mmol/L的IPTG诱导表达蛋白SdrD。并用Image Lab软件进行相对定量分析,确定IPTG的最佳浓度。
1.2.4 SdrD表达形式的检测 将加入IPTG诱导表达后的pET26b-SdrD-BL21(DE3)进行超声破碎,离心分别取上清和沉淀进行SDS-PAGE。
1.2.5 表面蛋白SdrD的纯化 将表达的SdrD蛋白用带有Ni-NTA柱进行纯化,并进行SDS-PAGE检测。
1.2.6 多克隆抗体的制备 将纯化的蛋白SdrD用来免疫注射新西兰白兔,免疫注射5次后取动物全血,分离血清。获得的兔血清用ProteinA柱子进行纯化。
2 结果
2.1 SdrD基因的克隆
根据NCBI数据库中SdrD基因序列,利用Primer5.0设计引物,以金黄色葡萄球菌标准菌株和地方分离菌株基因组为模板,对SdrD基因进行PCR扩增,琼脂糖凝胶电泳检测结果显示,在所有菌株中都能够获得大小约为2 000bp片段,与预期扩增的基因片段大小(2 043bp)一致(图1、图2)。
2.2 重组质粒pET26b-SdrD的构建
将扩增的片段进行EcoRⅠ和XhoⅠ双酶切,并与载体进行连接,转化大肠埃希菌DH5α后进行PCR筛选。将筛选出的阳性克隆过夜培养,提取重组质粒,对重组质粒进行PCR和双酶切验证,结果表明重组质粒构建成功(图3、图4)。

图1 从金黄色葡萄球菌标准菌株中扩增SdrD基因片段Fig.1 Amplification of SdrD gene fragments from S.aureus standard strains

图2 从金黄色葡萄球菌地方分离菌株中扩增SdrD基因片段Fig.2 Amplification of SdrD gene fragments fromS.aureus isolates
2.3 SdrD蛋白的表达
将重组质粒pET26b-SdrD转化到大肠埃希菌BL21(DE3)中,IPTG终浓度为0.1mmol/L进行诱导表达,SDS-PAGE检测结果显示,在116.0ku的下方出现一条电泳条带,与预期的蛋白大小(约99ku)一致(图5)。
2.4 诱导SdrD蛋白表达IPTG浓度的优化
将pET26b-SdrD-BL21(DE3)培养至对数期,37℃ 以IPTG诱导表达5h,IPTG的终浓度分别为0.05、0.1、0.5、1.0、2.0mmol/L,用 SDS-PAGE进行检测,然后用Image Lab软件进行相对定量分析。结果显示IPTG的浓度对蛋白SdrD表达量影响不大(图6)。

图3 重组质粒pET26b-SdrD的PCR验证Fig.3 PCR verification of recombinant plasmid SdrD-pET26
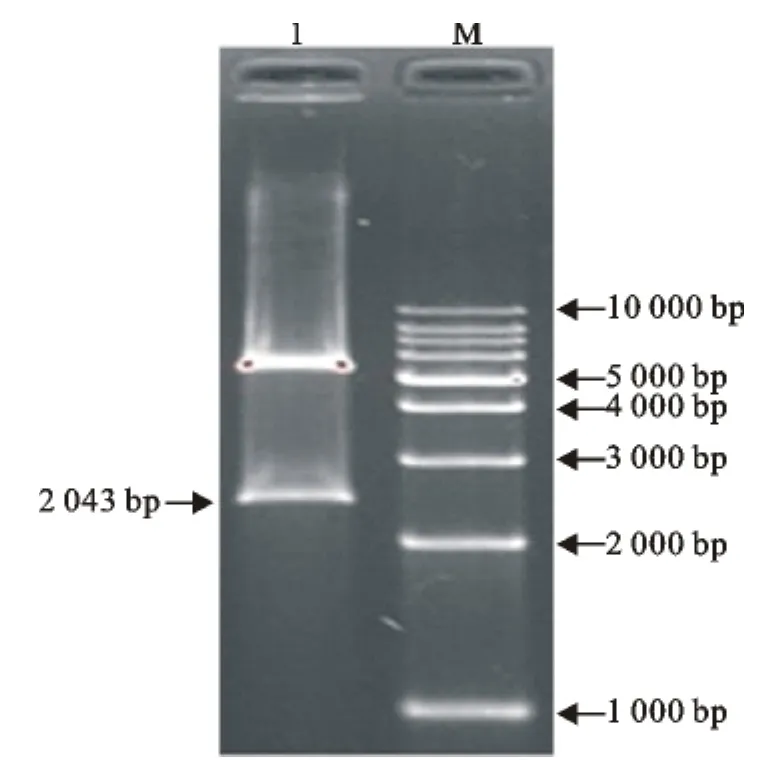
图4 重组质粒pET26b-SdrD的双酶切验证Fig.4 Restrictive digestion of recombinant plasmid pET26b-SdrD
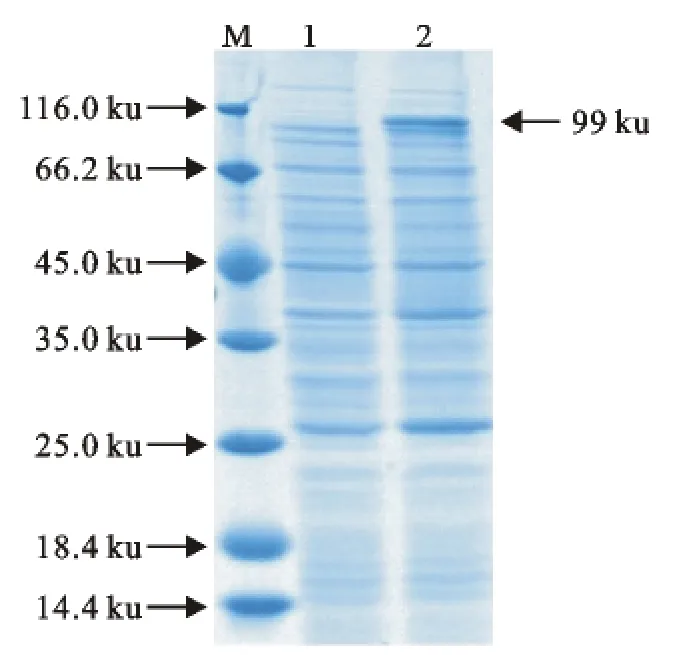
图5 SdrD蛋白的重组表达Fig.5 Recombinant expression of SdrD protein

图6 不同IPTG浓度诱导SdrD蛋白的表达Fig.6 SdrD protein expression induced by different concentrations of IPTG
2.5 SdrD蛋白的表达形式
将BL21(DE3)-pET26b-SdrD用IPTG进行诱导表达,取诱导后的菌液进行超声破碎,然后取上清和沉淀进行SDS-PAGE。结果表明,SdrD蛋白主要在上清中,即重组SdrD蛋白为可溶性表达(图7)。

图7 SdrD蛋白的表达形式分析Fig.7 Analysis of expression of SdrD protein
2.6 SdrD蛋白的纯化
将表达的SdrD蛋白用Ni-NTA His Resins柱子进行纯化,然后取不同管的纯化收集液进行SDSPAGE,结果显示均是单一条带,说明纯化效果良好(图8)。
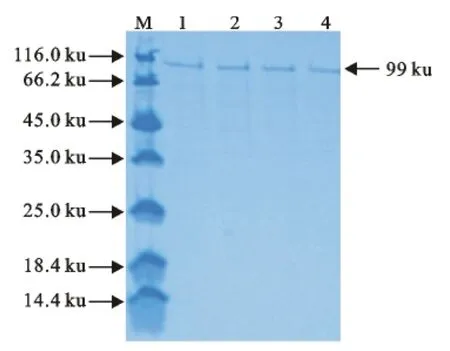
图8 纯化的SdrD蛋白的SDS-PAGE检测Fig.8 SDS-PAGE analysis of purified SdrD protein
2.7 多克隆抗体的制备
用间接ELISA检测免疫注射后新西兰白兔的血清抗体效价,结果如表1所示。
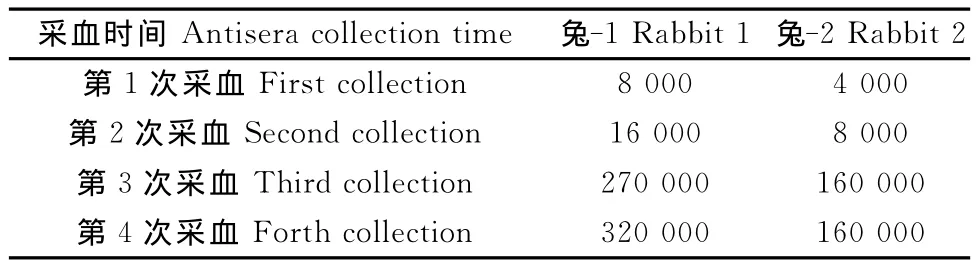
表1 SdrD蛋白免疫兔血清效价测定Table 1 Detection of titers of the antisera after immunization with SdrD protein in rabbit
如表1所示,随着免疫时间的延长,抗体滴度呈现逐渐上升的趋势,而后上升幅度变小。兔-1的效价高于兔-2。
3 讨论
奶牛乳房炎已成为乳品工业发展的最大危害因素之一,目前对于乳房炎的防治主要以抗菌药物为主,但是大量使用抗菌药物导致了致病菌的耐药性,并导致了牛奶中抗生素大量残留,造成严重的食品安全隐患。疫苗在奶牛中的成功应用,为奶牛乳房炎的防治另辟了途径,针对奶牛乳房炎的主要致病菌开发保护性疫苗具有广阔的应用前景。有研究表明,在某些地区19%奶牛乳房炎是由金黄色葡萄球菌引起的,因此,开发金黄色葡萄球菌疫苗将能够在较大程度上预防乳房炎的发生。
表面蛋白暴露于微生物表面,能够被宿主免疫系统较好的识别,因此这类蛋白被认为是理想的候选疫苗。有研究证实,表面蛋白SdrD具有良好的免疫保护作用[7-8],因此这种蛋白在基因工程疫苗研究领域具有重要的潜在应用价值。但是,疫苗的高效、低成本制备是决定其能否得到推广应用的关键因素。在所有重组表达体系中,原核重组表达系统具有操作简便、表达量高、制备成本低、制备周期短的显著优势。本研究选择了成熟、稳定的pET系列表达载体,较好的满足了基因疫苗制备的要求,是一种具有推广应用潜力的制备方式。
在原核表达体系中,目标蛋白往往容易形成包涵体,并且分子质量高的蛋白更易形成包涵体,包涵体的形成对于目标蛋白的分离纯化带来了较大困难,同时由于其结构为非天然状态,将会在较大程度上影响其免疫原性。因此,包涵体的形成对于高活性基因工程疫苗的制备具有较大的负面影响。本研究所选择的pET26b表达载体带有能够形成含有膜间隙定位信号的融合标签,在很大程度上提高了形成可溶性蛋白的几率。本研究结果表明,虽然目标蛋白的分子质量较大(99ku),但是大部分蛋白均以可溶性形式表达。本研究所建立的可溶性表达体系对于SdrD这一候选疫苗的应用提供了更好的技术保障。
一些表面蛋白在细菌表面的暴露程度较高,并且其中有些表面蛋白具有一定的特异性,因此表面蛋白是一类重要的免疫检测靶标。迄今已经有一些研究利用表面蛋白作为靶标建立了针对细菌、支原体、寄生虫的免疫检测方法,这些方法体现出较好的特异性与检测灵敏度[10-12]。本研究表达了金黄色葡萄球菌的表面蛋白SdrD,并制备了效价较高的多克隆抗体,为这一致病菌的快速检测奠定了良好的基础。
[1]王 凤,宋 立,汤德元,等.奶牛乳房炎病原菌的分离鉴定、血清型及耐药性研究[J].动物医学进展,2013,34(6):62-67.
[2]周长卿,王 珂,胡俊杰,等.青海地区奶牛乳房炎金黄色葡萄球菌的基因型分析[J].动物医学进展,2014,35(2):11-16.
[3]叶 倩,王礼伟,屈勇刚,等.奶牛乳房炎防治的研究进展[J].现代畜牧兽医,2014(1):56-61.
[4]Deb R,Kumar A,Chakraborty S,et al.Trends in diagnosis and control of bovine mastitis:a review[J].Pak J Biol Sci,2013,16(23):1653-1661.
[5]Foster T J,Geoghegan J A,Ganesh V K,et al.Adhesion,invasion and evasion:the many functions of the surface proteins ofStaphylococcusaureus[J].Nat Rev Microbiol,2014,12(1):49-62.
[6]Sabat A,Melles D C,Martirosian G,et al.Distribution of the serine-aspartate repeat protein-encoding sdr genes among nasalcarriage and invasiveStaphylococcusaureusstrains[J].J Clin Microbiol,2006,44(3):1135-1138.
[7]Stranger-Jones Y K,Bae T,Schneewind O.Vaccine assembly from surface proteins ofStaphylococcusaureus[J].Proc Natl Acad Sci USA,2006,103(45):16942-16947.
[8]Becherelli M,Prachi P,Viciani E,et al.Protective activity of the CnaBE3domain conserved amongStaphylococcusaureusSdr proteins[J].PLoS One,2013,8(9):e74718.
[9]Trad S J,Allignet L,Frangeul M,et al.DNA microarray for identification and typing ofStaphylococcusaureusisolates[J].J Clin Microbiol,2004,42(5):2054-2064.
[10]Amrouche T,Boutin Y,Moroni O,et al.Production and characterization of anti-bifidobacteria monoclonal antibodies and their application in the development of an immuno-culture detection method[J].J Microbiol Meth,2006,65(1):159-170.
[11]Neiman M,Hamsten C,Schwenk J M,et al.Multiplex screening of surface proteins from Mycoplasma mycoides subsp.mycoides small colony for an antigen cocktail enzyme-linked immunosorbent assay[J].Clin Vac Immunol,2009,16(11):1665-1674.
[12]Reyna-Bello A,Cloeckaert A,Vizcaíno N,et al.Evaluation of an enzyme-linked immunosorbent assay using recombinant major surface protein 5for serological diagnosis of bovine anaplasmosis in Venezuela[J].Clin Diagn Lab Immunol,1998,5(2):259-262.

