猪胆囊中沙门菌L型的分离培养与invA基因检测
佘晓玲,王 涛,丁文静,吴文娟,潘耀振,汤可立,王丹霓,王 和*
(1.贵阳医学院微生物学教研室,贵州贵阳 550004;2.贵阳医学院附属医院外科,贵州贵阳 550004;3.贵州省人民医院外科,贵州贵阳 550002;4.上海交通大学基础医学院病原生物学教研室,上海 200025)
沙门菌(Salmonella)是肠杆菌科细菌中的常见病原菌,其不仅能够感染猪、禽等多种动物和引起动物的疾病,而且也可通过畜禽肉制品及排泄物经消化道感染人体和引起人类的多种疾病[1-2]。有文献报道[3],沙门菌感染动物后可进入宿主胆囊并且在胆囊内长期携带,使动物成为沙门菌的重要储存宿主与传染源。然而用常规细菌学方法,在正常动物的胆囊标本内却很少分离到沙门菌[4]。细菌L型是细菌的细胞壁缺陷变异型,细菌在胆汁、抗生素等因素的作用下可发生细胞壁缺陷变异。细菌形成L型后不但形态和培养特性发生改变,而且其代谢活性、抗原性、致病性、药物敏感性等多种特性均可发生改变,成为常规细菌学方法不能检出的潜在病原体[5]。为了解猪胆囊中沙门菌的携带情况,本文采用非高渗分离培养法对贵阳市区采集的健康生猪胆囊标本进行了沙门菌及其L型的分离和基因检测,现将结果报告如下。
1 材料与方法
1.1 材料
1.1.1 标本采集与处理 2011年-2012年期间,在贵阳市区3所屠宰场采集970份健康生猪的胆囊组织和胆汁标本。按文献[6]方法剪碎胆囊组织块。
1.1.2 主要试剂与仪器 10×buffer、dNTPs、MgCl2、TaqDNA 聚合酶、DNA Marker DL 2 000,TaKaRa公司产品;琼脂糖,ICN公司产品;DNA提取试剂盒,Tiangen公司产品;PCR仪,SensoQuest公司产品;Gel Doc XR凝胶成像系统,Bio-Rad公司产品;PG 液(protein-glucose broth)、SS琼脂平板、沙保弱琼脂平板,均按文献[5]方法配制。
1.1.3 沙门菌L型基因检测引物 沙门菌属invA基因的特异性引物 (F:5′-GTGAAATTATCGCCACGTTCGGGCAA-3′,R:5′-TCATCGCACCGTCAAAGGAACC-3′)序列参照文献[7]由上海生工生物工程技术服务有限公司合成,预期扩增产物的长度为284bp。
1.2 方法
1.2.1 沙门菌分离培养 按文献[6]方法分别取胆汁和胆囊组织块涂布法接种SS琼脂平板,置37℃培养18h~24h,按文献[8]以常规细菌学方法鉴定可疑菌。
1.2.2 细菌L型非高渗分离培养 按文献[6]方法取胆汁和胆囊组织块分别接种于4mL PG液,37℃温箱培养3d~5d,取1mL培养物经0.22μm孔径滤菌器过滤后接种PG液培养。每天在倒置显微镜下观察细菌L型生长情况。细菌L型生长后,传代培养3次以上获得稳定L型纯培养物。
1.2.3 细菌L型生物学鉴定 按文献[5]方法鉴定L型,包括形态与培养特性、革兰染色与细胞壁染色性、滤过性。
1.2.4 沙门菌L型的基因检测 按试剂盒方法提取L型传代培养物的DNA模板,同样方法提取伤寒沙门菌(Salmonellatyphi)H901、甲型副伤寒沙门菌(SalmonellaparatyphiA)、乙型副伤寒沙门菌(SalmonellaparatyphiB)及大肠埃希菌(Escherichiacoli)ATCC25922的染色体 DNA,分别进行invA的PCR扩增和15g/L琼脂糖凝胶电泳,阳性扩增产物送上海生工生物工程技术服务有限公司进行双向序列测定和分析结果。
2 结果
2.1 沙门菌及其L型
970例胆囊标本的常规细菌学方法分离培养均未检出沙门菌细菌型,非高渗分离培养可检出细菌L型80例,检出率为8.25%。
2.2 稳定细菌L型的生物学鉴定
胆囊L型菌培养3d~5d后,液体培养基仍澄清,在光学显微镜下可见圆球、卵圆形或不规则形态,半透明,单个、成双、短链或成堆排列,可通过0.22μm孔径滤菌器,接种常规细菌学培养基及沙保诺琼脂培养基未见细菌生长,革兰染色及细胞壁染色均阴性(图1)。
2.3 沙门菌L型基因检测
沙门菌质控株及50例猪胆囊分离细菌L型DNA的PCR扩增产物电泳结果可见阳性目标条带,大肠埃希菌未见阳性目标条带(图2)。L型扩增产物序列分析结果与 GenBank(http://www.ncbi.nlm.nih.gov/)中核苷酸数据库基因序列比对,L型菌株的核苷酸序列与GenBank中注册的沙门菌invA基因序列的同源性最高,为100%(图3)。invA基因鉴定法检出沙门菌L型的阳性率为5.15%,占胆囊分离细菌L型的62.50%。

图1 猪胆囊分离的细菌稳定L型细胞纯培养物(400×)Fig.1 The pure cultures of bacterial stable L-form isolated from pig gallbladder(400×)
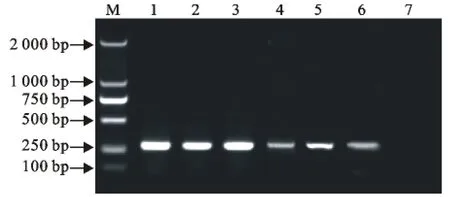
图2 猪胆囊分离的细菌L型沙门菌invA基因PCR产物电泳结果Fig.2 The electrophoresis results of PCR products of Salmonella invA gene of L-forms isolated from pig gallbladder
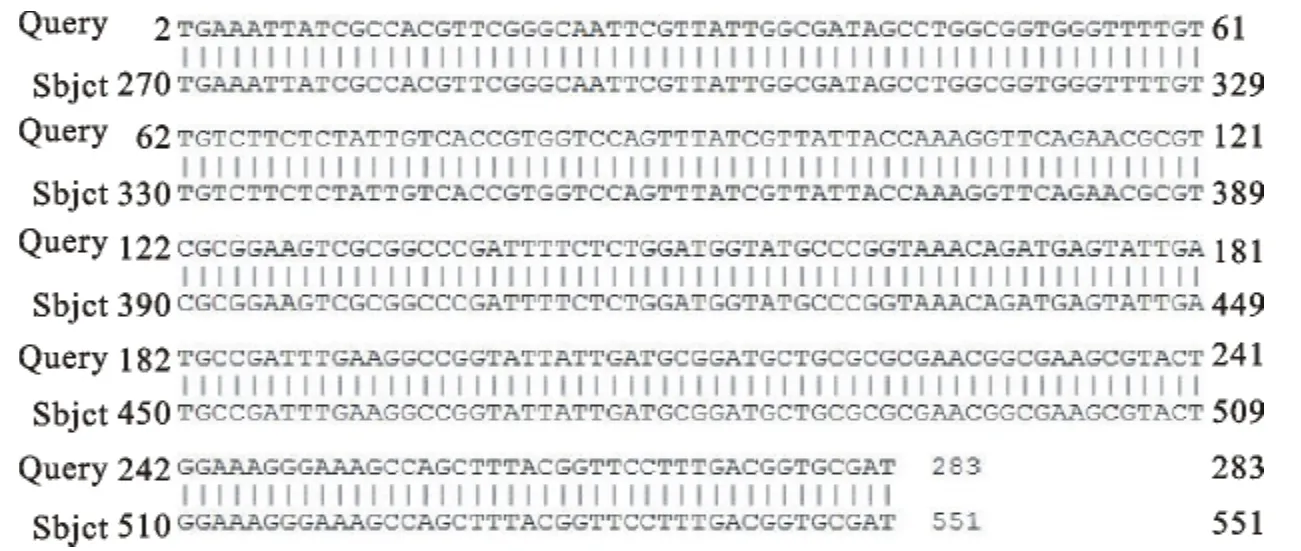
图3 猪胆囊分离的沙门菌L型与沙门菌的invA基因序列同源性比较Fig.3 The homology comparison for invA gene between the L-forms isolated from pig gallbladder and Salmonellain GenBank
3 讨论
沙门菌是引起人兽共患病的重要病原菌之一,其广泛分布于自然界并且可寄生于人或动物肠道与胆囊内,主要通过污染的食物、饮水经粪-口途径传播[1-2]。沙门菌感染动物不但可成为引起沙门菌病重要的传染源,而且也可对食品安全、动物检疫、动物试验结果产生重要的影响。因此,沙门菌感染的防控备受各国公共卫生、畜牧兽医和食品安全等部门的普遍关注。目前国内外对动物沙门菌感染的检查方法主要为常规细菌学分离培养及特异性抗原与抗体检测,通过细菌生化反应和血清学试验进行菌种鉴定[9]。然而由于沙门菌分离培养较为困难及其抗原性变异等因素,造成动物沙门菌感染的检出率较低[10]。研究结果显示,在贵阳市区采集的970份健康生猪胆囊标本内,采用常规细菌学方法在其绝大多数标本内均不能检出细菌以及沙门菌的细菌型,但采用细菌L型的非高渗分离培养法却可在这些常规细菌学方法检查“无菌”和沙门菌分离培养阴性的猪胆囊标本内检出较高阳性率的细菌L型。通过沙门菌特异性基因invA检测,证实这些生猪胆囊可携带沙门菌L型。提示许多细菌和沙门菌感染猪的胆囊后,可发生细胞壁缺陷变异和成为稳定L型,造成这些生猪成为常规细菌型方法分离培养阴性的健康带菌动物,但却成为胆囊携带沙门菌L型以及其他某些细菌L型的健康带菌动物。
细菌L型是细菌的细胞壁缺陷变异型,已知许多抗生素、抗体、补体、胆汁等因素均可诱导各种细菌形成L型[5]。文献报道[11],大肠埃希菌、阴沟肠杆菌等细菌在体外可被胆汁诱导成L型。王和[5]报道,细菌形成L型后不但形态和培养特性发生改变,而且其代谢活性、抗原性、致病性、药物敏感性等多种特性均可发生改变。文献报道[12],用伤寒沙门菌感染实验动物,可在常规细菌型方法分离培养无菌的动物胆囊内检出伤寒沙门菌稳定L型。因此认为细菌L型不但可引起宿主组织的慢性损害,而且其保留了重新合成细胞壁和返祖成为细菌型的性质,以致其成为重要的潜在病原体和引起疾病发生与流行的主要传染源[5-6,12]。研究结果显示,沙门菌感染猪胆囊后也可成为稳定L型,成为常规细菌学分离培养法不能检出的潜在病原体。本文用非高渗分离培养方法从健康生猪的胆囊标本内分离培养细菌稳定L型的阳性率达到8.25%,其中沙门菌稳定L型检出率达到5.15% ,占胆囊分离细菌L型的62.50%。提示市售健康生猪的胆囊可存在多种细菌L型感染,其中沙门菌稳定L型具有较高的感染率。这些细菌L型不但可引起猪胆囊的慢性损害,而且其中的沙门菌或其他某些病原菌的L型一旦重新合成细胞壁返祖,则可成为引起传染病发生或流行的重要传染源。
细菌稳定L型由于丧失了其亲代细菌型具有的形态、代谢、表面抗原等特性,因此不能用常规细菌学方法鉴定[5-6,12]。但细菌稳定L型可保留其亲代细菌型的特异性核苷酸碱基序列,从而有助于稳定L型的基因检测与鉴定[5]。文献报道[13-16],沙门菌invA基因序列编码与菌细胞吸附和侵袭上皮细胞表面蛋白,它是一段只存在于致病性沙门菌属特异性的保守基因序列。用此基因的引物检测和鉴定沙门菌,其阳性率可达94.2%以上,因此国内外通常选用invA基因检测对沙门菌感染及其菌种进行诊断与鉴定[15、17-19]。研究结果显示,常规细菌型方法不能鉴定的沙门菌稳定L型仍然保留了与其亲代沙门菌细菌型一致的invA基因及其核苷酸序列,表明invA基因PCR扩增及其核苷酸测序分析方法,有助于了解猪胆囊中沙门菌L型的携带情况。
[1]李丹丹,徐义刚,王绥家,等.动物性食品中沙门菌实时荧光定量PCR快速检测方法的建立[J].动物医学进展,2014,35(5):24-30.
[2]刘 杰,张秀丽,陈 磊,等.肉猪养殖和屠宰环节沙门菌污染状况监测分析[J].中国食品卫生杂志,2013,25(1):61-64.
[3]张 琦,付明哲,陈晓霖.猪鼠伤寒沙门氏菌的分离与鉴定[J].中国畜牧兽医文摘,2011,27(4):34-35.
[4]李 毅.食品中沙门菌检测方法进展[J].中国卫生检验杂志,2006,16(2):251-253.
[5]王 和.男科感染病学[M].北京:科学出版社,2011:173-199.
[6]王 和,余秀专,徐 英.用非高渗透压培养基从慢性胆囊炎胆囊分离细菌L型[J].中华医学检验杂志,1994,17(5):263-265.
[7]Soria M C,Soria M A,Bueno D J.Comparison of 2culture methods and PCR assays forSalmonelladetection in poultry feces[J].Poult Sci,2012,91(3):616-626.
[8]叶应妩,王毓三,申子瑜,等.全国临床检验操作规程[M].3版.江苏南京:东南大学出版社,2010:825-827.
[9]郭 润,霞鲁波,张 伟,等.沙门菌检测技术现况[J].中国卫生检验杂志,2007,17(10):1917-1920.
[10]陈 玲,张菊梅,杨小鹃,等.南方食品中沙门氏菌污染调查及分型[J].微生物学报,2013,53(12):1326-1333.
[11]傅晓琰.从25例胆囊疾病患者胆汁中分离出5株细菌L型的报道[J].齐齐哈尔医学院学报,2010,31(9):1430-1431.
[12]王 和,陈峥宏,余秀专.慢性胆囊炎与胆囊结石的细菌L型病因学研究[J].医学研究通讯,2004,33(4):32-33.
[13]张 冰,张焕容,汤 承,等.藏系绵羊源沙门菌和产志贺毒素大肠埃希菌的分离与PCR鉴定[J].动物医学进展,2013,34(4):13-18.
[14]陈金顶,索青利,廖 明,等.沙门氏菌的invA基因序列分析与分子检测[J].中国人兽共患病杂志,2004,20(10):868-871.
[15]李业鹏,钟 凯,杨宝兰,等.食品中沙门菌PCR检测方法的建立[J].中国食品卫生杂志.2006,18(1):17-22.
[16]Zhao S,Qaiyumi S,Friedman S,et al.Characterization ofSalmonellaentericaserotype newport isolated from humans and food animals[J].J Clin Microbiol,2003,41(12):5366-53711.
[17]Galan J E,Curtiss R.Distribution of the invA ,-B,-C,and-D genes ofSalmonellatyphimuriumamong otherSalmonellaserovars:invA mutants ofSalmonellatyphiare deficient for entry into mammalian cells[J].Infect Immun,1991,59(9):2901-2908.
[18]Nolan L K,Giddings C W,Brown J.The distribution of invA,pagC and spvC gene amongSalmonellaisolates from animals[J].Vet Res Commun,1995,19(3):167-177.
[19]Bulte M,Jakob P.The use of a PCR-generated invA probe for the detection ofSalmonellaspp.in artificially and naturally contaminated foods[J].Int J Food Microbiol,1995,26(3):335-344.

