禽流感病毒H5、H7和H9亚型一步法多重RT-PCR检测方法的建立
屈素洁,莫胜兰,邹联斌,胡 杰,张步娴,梁 媛,粟艳琼,施开创,李 军
(广西壮族自治区动物疫病预防控制中心,广西南宁 530001)
禽流感(Avian influenza,AI)是由正黏病毒科 (Orthomyxoviridae)A 型流感病毒属中不同亚型病毒引起的禽类感染和疾病的总称。禽流感病毒(AIV)为单股负链RNA病毒,基因组有8个独立的RNA节段组成,根据其表面血凝素(HA)和神经氨酸酶(NA)的抗原性差异,可分为16个HA亚型和9个NA亚型[1-2],AIV抗原变异性强,宿主范围广泛,且亚型之间无交叉保护性,使得禽流感频繁暴发。高致病性禽流感主要是由H5或H7亚型AIV引起的,潜伏期极短,突然暴发,多不见任何临床症状而突然死亡,发病率和病死率高达100%[3],另外还可感染人,甚至导致死亡[4-5]。目前,我国部分地区以H9亚型为主的中低致病性禽流感的流行,给养禽业造成很大的经济损失,已引起国内各界学者的广泛关注[6]。早期快速检测无疑是预防、控制禽流感的关键。
禽流感的诊断,包括病原的分离鉴定、琼脂扩散试验、血凝和血凝抑制试验、免疫荧光法和ELISA等常规方法发挥了重要作用,但这些方法操作比较繁琐,费时、费力。聚合酶链反应(PCR)方法不仅特异、敏感,而且简易、快速。多重PCR是一种特殊PCR形式,其最突出特点是可同时检测、鉴别出多种病原体[7-9],极大地缩短禽流感病毒的检出时间,为AIV早期快速诊断提供了敏感、快速、实用的方法。本试验采用了多重RT-PCR技术,建立了能同时检测H5、H7和H9亚型AIV的一步法多重RT-PCR方法。
1 材料与方法
1.1 材料
1.1.1 毒株和质粒 禽流感病毒(AIV-H1毒株、AIV-H3毒株、AIV-H5毒株、AIV-H6毒株、AIVH9毒株)、鸡新城疫病毒(NDV)、鸡传染性支气管炎病毒(IBV)、传染性喉气管炎病毒(ILTV)、鸡毒支原体(MG)及鸡传染性法氏囊病病毒(IBDV)均由广西壮族自治区动物疫病预防控制中心保存;AIV-H7亚型质粒由哈尔滨兽医研究所提供。
1.1.2 试剂 RNA提取试剂盒、RT-PCR试剂盒、胶回收试剂盒、pMD18-T载体,宝生物工程(大连)有限公司产品;DH5α感受态细胞,Tiangen公司产品;其他试剂均为国产分析纯。
1.2 方法
1.2.1 引物设计 参照GenBank中公布的 H5、H7和H9亚型AIV的HA基因序列,通过MegAligen软件进行比对,应用Primer 5.0软件设计3对引物(表1),引物由宝生物工程(大连)有限公司合成。
1.2.2 病毒RNA的提取 参照RNA提取试剂盒操作说明书进行。

表1 多重RT-PCR引物Table 1 Multiplex RT-PCR primers
1.2.3 一步法多重RT-PCR反应 参照一步法RT-PCR试剂盒操作说明,RT-PCR反应体系,即PrimeScript 1step Enzyme Mix 2μL,2×step buffer 25μL,上、下游引物各1μL(10μmol/L),RNA模板10μL,加ddH2O至50μL。反应条件,即50℃30min;95℃2min;94℃45s,55℃45s,72℃1min,共35个循环。反应结束后取产物5μL~10μL用12g/L琼脂糖凝胶进行电泳,观察扩增结果。
1.2.4 PCR产物测序 用胶回收试剂盒,从琼脂糖凝胶中回收PCR产物,将回收产物与pMD18-T载体连接,转化DH 5α感受态细胞后,送宝生物工程(大连)有限公司进行序列测定。
1.2.5 特异性试验 用上述方法对禽流感病毒(AIV-H1毒株、AIV-H3毒株、AIV-H6毒株)、鸡新城疫病毒(NDV)、鸡传染性支气管炎病毒(IBV)、传染性喉气管炎病毒(ILTV)、鸡毒支原体(MG)及鸡传染性法氏囊病病毒(IBDV)的病毒材料进行进行特异性检测试验。
1.2.6 敏感性测定 将 H5、H7和 H9亚型AIV的RNA做10倍系列稀释后进行多重RT-PCR,测定该一步法多重RT-PCR对RNA的最低检测量。
2 结果
2.1 RT-PCR扩增结果
禽流感病毒H5、H7和H9型扩增后获得的片段与预期大小完全一致,分别为380、501、732bp(图1)。
2.2 测序鉴定
分别将测得的H5亚型序列同GenBank登录号为HM172455、JX534549等5株,H7亚型序列同GenBank登录号为KJ415825、KF420296等5株,H9亚型序列同GenBank登录号为DQ064366、DQ064366等5株亚型序列同源性比较,结果都大于80% ,证明PCR所扩出的片段分别为H5、H7和H9亚型的特异性片段。
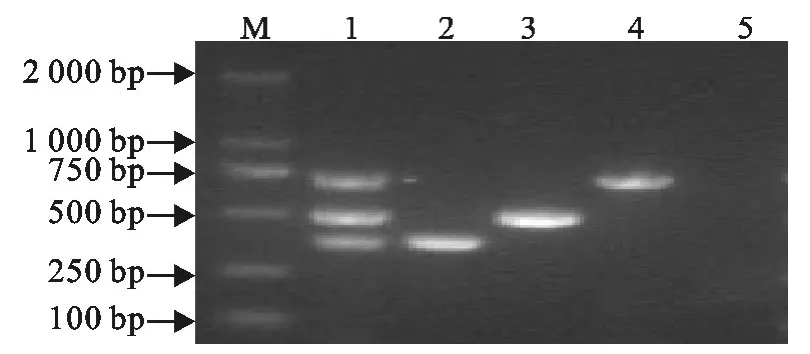
图1 一步法多重RT-PCR扩增结果Fig.1 The results of one step-multiplex RT-PCR
2.3 特异性试验
H5、H7、H9亚型 AIV RNA经一步法多重RT-PCR扩增,在380、501、732bp分别出现了扩增条带,而 H1、H3、H6亚型 AIV,NDV、MG、IBV和ILTV均无扩增条带出现,即为阴性(图2),表明H5、H7和H9亚型AIV与其他亚型AIV和禽呼吸道病原体的核酸不存在交叉反应,特异性强。
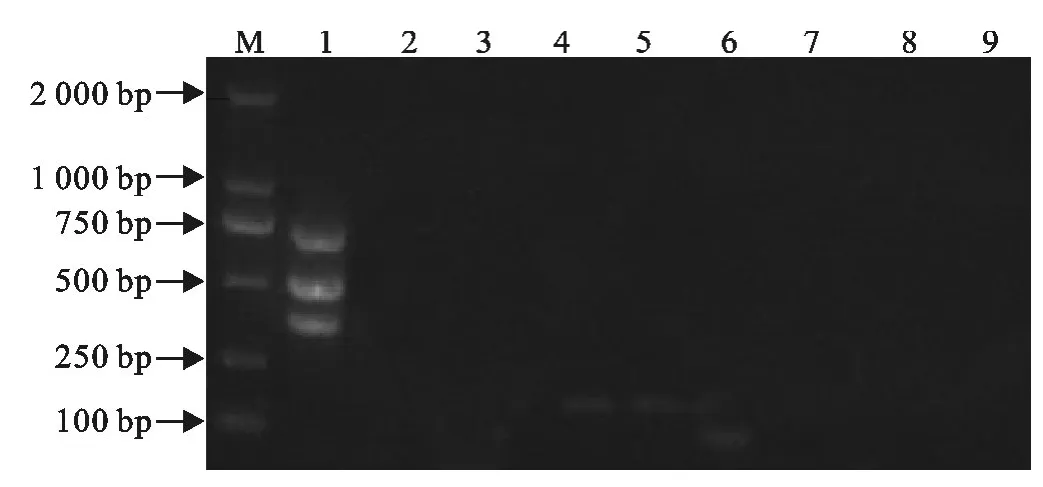
图2 一步法多重RT-PCR的特异性试验Fig.2 Specificity test of the one step-multiplex RT-PCR
2.4 敏感性试验
经测定,该一步法多重RT-PCR对H5、H7和H9亚型AIV RNA的最低检测量分别为10-4、10-4、10-2拷贝/μL(图3)。
3 讨论

图3 一步法多重RT-PCR敏感性试验Fig.3 Sensitivity test of the one step-multiplex RT-PCR
传统禽流感诊断方法主要有病毒分离培养和血清学试验,这些方法操作繁琐,时间长,重复性不好[10]。AIV血清型众多,且新的变异株不断出现,而制备血清型特异性单克隆抗体相对困难。近几年研究发现,接种鸡胚进行A型流感病毒增毒过程中,发生了介导变异[11],所有这些限制了传统方法在实际中的应用。RT-PCR作为一种灵敏、快速简便而且经济实用的检测方法已经在许多领域得到广泛应用,尤其是多重RT-PCR倍受青睐,当样品数量大、病原亚型多时,多重RT-PCR显示出独特的优势,能够高通量、低成本进行批量快速检测多个亚型[12-13]。
本研究引物是根据禽流感病毒亚型决定片段HA片段进行的引物设计,建立了H5、H7和H9亚型禽流感病毒一步法多重RT-PCR检测方法。可对H5、H7和H9亚型进行一次性区分,避免了二次检验,省时、省力,而且节约了资源。建立多重RTPCR对引物的要求相当高。在同一体系中同时加入多对引物,同时扩增多个基因,引物对之间的匹配与否对多重RT-PCR的扩增结果影响很大,尤其是体系的特异性。因此,在设计PCR引物时要考虑多个因素,如引物的退火温度应大致相近,基因片段大小有一定梯度,以便于电泳分辨等。
以H5、H7和H9亚型流感病毒RNA作为模板进行一步法多重RT-PCR扩增,能够扩增出大小为380、501、732bp的3个条带,而以 AIV H1亚型、AIV H3亚型、AIV H6亚型、NDV、MG、IBV、IBDV和ILTV总RNA作为模板,却不能扩增出任何条带,表明该检测方法特异性强。将抽提并测定含量的病毒RNA进行10倍稀释,分别作为模板进行一步法多重RT-PCR扩增。结果表明,该多重RT-PCR对H5、H7和H9亚型AIV RNA的最低检出量分别为10-4、10-4、10-2拷贝/μL,表明该检测方法敏感度高。
本研究建立的一步法多重RT-PCR同时鉴别H5、H7和H9亚型AIV的方法,为禽流感的防控提供了有效的早期快速检测手段奠定了基础,因此在维护公共卫生安全方面具有十分重要的意义。
[1]甘孟侯.禽流感[M].北京:中国农业出版社,2002:12-10.
[2]Fouchier R A,Munster V,Wallensten A,et al.Characterieation of a novel influenza A virus hemagglutinin subtype(H16)obtained from Black-headed gulls[J].J Virol,2005,79:2814-2822.
[3]付朝阳,邢大昌,唐秀英,等.高致病力禽流感的流行与防制研究进展[J].中国预防兽医学报,2001,23(5):393-395.
[4]Hien T T,Liem N T,Dung N T,et al.Avian influenza A(H5N1)in 10patients in Vietnam[J].N Engl J Med,2004,350:1179-1188.
[5]卢体康,秦智锋,陈 兵,等.H7亚型禽流感病毒实时荧光定量RT-PCR检测方法的建立[J].动物医学进展,2012,33(3):9-13.
[6]包红梅,王秀荣.H9亚型禽流感病毒RT-PCR检测方法的建立[J].中国兽医科学,2010,40(4):384-389.
[7]Elfathm E,Ahmed M A,Robert J C,et al.Multiplex PCR:optimization and application in diagnostic virology[J].Clin Microbiol Rev,2000,13:559-570.
[8]郭 捷,谢芝勋,彭 宜,等.H1和H3亚型禽流感病毒二重PCR检测方法的建立[J].动物医学进展,2012,33(12):31-34.
[9]Tanga Q D,Wang J L,Baoa J N,et al.A multiplex RT-PCR assay for detection and differentiation of avian H3H5and H9 subtype influenza viruses and Newcastle disease viruses[J].J Virol Meth,2012,181(2):164-169.
[10]Zambon M,Hays J,Webster A,et al.Diagnosis of influenza in the community relationship of clinical diagnosis to confirmed virological serologic ormolecular detection of influenza[J].Arch Intern Med,2001,161(17):2116-2122.
[11]Steinhauer D A.Role of hemagglutinin for the pathogenicity of influenza virus[J].Virology,1999,258:1-20.
[12]Nguyen T T,Kwon H J,Kim H H,et al.Multiplex nested RT-PCR for detecting avian influenza virus,infectious bronchitis virus and Newcastle disease virus[J].J Virol Meth,2013,188(1-2):41-46.
[13]Chaharaein B,Omar A R,Aini I,et al.Detection of H5H7 and H9subtypes of avian influenza viruses by multiplex reverse transcription-polymerase chain reaction[J].Microbiol.Res,2009,164(2):174-179.

