草地贪夜蛾种群性诱测报方法研究
和伟 赵胜园 葛世帅 姜玉英 赵新成 吴孔明
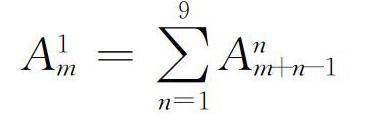
摘要 草地贪夜蛾已经成为中国农业生产的重大害虫,准确地预测预报是指导防治的基础。本研究采用国产草地贪夜蛾性诱剂诱陷多测试了3种不同类型诱捕器对草地贪夜蛾的田间诱捕效果。结果表明,诱陷多有效期可达60 d以上,3种诱捕器中以桶型诱捕器诱捕量最高。实验室研究显示,不同日龄草地贪夜蛾雄虫精巢长轴长度有显著性差异,精巢长轴长度随日龄增加不断减小。据此规律,制定了按照精巢长轴大小判断雄蛾日龄的指标,并反演重构了田间雌、雄虫种群羽化的动态曲线。本研究表明,可以利用性诱到的雄虫的精巢发育状况推算田间种群的年龄结构,进而达到通过预测雌虫产卵与幼虫孵化动态指导防治的目的。
关键词 草地贪夜蛾; 精巢; 性诱剂; 种群预测
中图分类号: S 435.132
文献标识码: A
DOI: 10.16688/j.zwbh.2019317
草地贪夜蛾Spodoptera frugiperda(J.E.Smith)是美洲热带和亚热带地区周年发生的重要农业害虫[1],其寄主数量高达353种,包括玉米、水稻、小麦和高粱等多种经济作物[2]。根据幼虫取食的偏好性,草地贪夜蛾可分为玉米型和水稻型两种基因型[35]。草地贪夜蛾具有极强的繁殖能力和迁飞能力,并且无滞育现象[4,67]。较强的繁殖和迁飞能力使其异地频繁暴发成灾,2016年1月入侵非洲后造成玉米20%~50%的产量损失[8]。目前,草地贪夜蛾已入侵我国多地[9],对玉米等作物生产构成了严重的威胁[10]。
病虫测报是植物保护工作的基础,在防控工作中起着信息支撑和决策支持的作用[11]。为了及时有效地监测草地贪夜蛾的发生,国内外学者先后采用了雷达监测、灯诱测报、卵巢解剖等方法[1214]。Wolf等利用昆虫雷达监测美国德克萨斯州和墨西哥的草地贪夜蛾向美国高纬度平原地区和其他北部地区迁飞[12],Sparks利用黑光灯诱集草地贪夜蛾并监测其跨海迁飞[13]。相比雷达监测需要大区域进行[15]、灯诱监测受环境影响较大且昆虫种类难以鉴定[1617]、卵巢解剖需要诱捕大量的雌虫[18],性诱测报具有灵敏度高、专一性强、精确度高、使用方便等优点[19]。国内外对棉铃虫Helicoverpa armigera (Hübner)、黏虫Mythimna separata (Walker)、小地老虎Agrotis ipsilon (Rottemberg)等常见农业害虫的性诱监测均具有良好的效果[1923]。早在20世纪60年代,Sekul和Spark已经初步鉴定出草地贪夜蛾的信息素成分[24],随后Tumlinson等进一步对草地贪夜蛾性信息素成分进行了分析和田间试验,确定了7种化合物[25],研发的性诱剂已被广泛应用于北美洲和非洲国家的测报工作[2629]。
由于性诱剂只对雄蛾有吸引作用,通过性诱只能诱捕到雄蛾,而雄蛾生殖系统的发育状态目前主要根据其单射精管、贮精囊和输精管的颜色来判断,如黏虫[30]、凤凰木夜蛾Pericyma cruegeri (Butler)[31]、斜纹夜蛾Spodoptera litura等均采用此种方法[32],但颜色变化区分困难,难以形成标准化的指标准确判断生殖系统的发育进程。因此,我们在明确国产性诱剂诱捕效果的基础上,研究了雄虫生殖系统的发育规律,旨在发展基于性诱剂的草地贪夜蛾种群产卵和幼虫种群动态的测报新方法。
1 材料与方法
1.1 国产性诱剂田间诱捕有效性的测试
1.1.1 试验材料
试验用草地贪夜蛾性诱剂(诱陷多)、诱捕器以及26号细铁丝(直径0.5 mm)、粘虫板等材料均由深圳百乐宝生物农业科技有限公司生产提供。
1.1.2 试验方法
试验于2019年2月24日至4月27日在云南省德宏州瑞丽市勐卯镇(23°58′35″N,97°48′51″E)玉米田进行。设置船型诱捕器、夜蛾通用诱捕器和桶型诱捕器3个处理,每处理重复3次,随机区组设计。每个诱捕器配置1枚性诱芯,间距50 m,置于距地面120 cm高度。每日8:00调查记录各诱捕器诱虫数量。
1.2 草地贪夜蛾精巢发育与分级观测
1.2.1 供试虫源
草地贪夜蛾幼虫于2019年3月采自云南省德宏州瑞丽市勐卯镇玉米田,采后在室内养虫盒(长22 cm,宽15 cm,高8 cm)中用新鲜玉米叶饲养。饲养条件:温度(26±2)℃,相对湿度75%±10%,光周期L∥D=13 h∥11 h。成虫羽化后,放置于养虫笼(长40 cm,宽40 cm,高40 cm)内,每天饲喂10%蜂蜜水。
1.2.2 试验方法
成虫精巢解剖:参照徐博[32]对斜纹夜蛾的解剖方法,挑选体型大小一致的草地贪夜蛾成虫放入75%乙醇内浸泡30 s后取出,用解剖镊子夹住其胸部固定,再用眼科剪刀剪去翅膀,并从胸腹部连接处剪断,取腹部置于盛有生理盐水的培养皿内,在三目体视显微镜(TS45-A)下使其背面朝上,用解剖镊子从断口处夹住两侧体壁,向尾部方向逐步撕开腹部体壁,然后清除腹腔内多余脂肪粒和腹腔内其他组织器官,找到精巢并分离其周围多余支气管,将精巢置于生理盐水中漂洗2次,放置于测微尺上拍照,用Image J软件测量其长轴与短轴。
幼虫精巢解剖:取饲养盒内特定日龄幼虫,剪去第二腹足以上虫体,将其余虫体背面朝上放入盛有生理盐水的培养皿中,用医用眼科剪刀从断口处沿背部中线剪开体壁,用解剖镊子拉开体壁,清除腹腔内多余脂肪粒和腹腔内其他组织器官,将分离出的精巢用生理盐水漂洗2次并拍照测量。
蛹解剖:将特定日龄雄蛹置于培养皿内,用医用眼科剪刀剪去头胸部弃去,并從腹部中间剪开蛹壳,用解剖镊子清除腹腔内多余脂肪粒和其他组织器官,将分离出的精巢用生理盐水漂洗2次并拍照测量。
1.3 田间性诱雄虫种群日龄结构分析
1.3.1 试验方法
试验于2019年5月15日至5月25日在广西河池市都安县(23°57′23″N,108°4′38″E)玉米种植区进行。选用桶型诱捕器配合“诱陷多”性诱芯诱捕,共设置9个重复,各诱捕器之间间距50 m,诱捕器距离地面120 cm。每天8:00调查各诱捕器诱集草地贪夜蛾数量,收集全部样本带回实验室解剖测量精巢大小。
1.3.2 日龄划分标准
参照陈庆华等[33]关于稻纵卷叶螟Cnaphalocrocis medinalis的日龄划分标准,以两相邻日龄成虫精巢长轴长度的平均值作为划分两相邻日龄的分界点,以此计算不同日龄雄蛾精巢长轴长度范围。
1.4 数据统计与分析
参照陈庆华等的稻纵卷叶螟日龄反演算法[33]:根据每日性诱到的不同日龄雄蛾所占比例,将不同日龄雄蛾量分别倒推到其羽化日期(1日龄日期),当日羽化雄蛾量等于本日1 日龄雄蛾量,次 1 日的 2日龄雄蛾量、次2日的3日龄雄蛾量直至次8日的9日龄雄蛾量之和,根据每日羽化雄蛾量反演构建其羽化动态曲线。计算公式为:
式中,A为雄蛾数量,其下標为日期,其上标为日龄。
采用R语言3.4.3计算相关数据,所有数据均采用平均值±标准误来表示,对各日龄精巢长轴长度采用Tukey法进行统计分析和函数拟合(P<0.05)。
2 结果与分析
2.1 国产性诱剂对草地贪夜蛾的田间诱捕效果
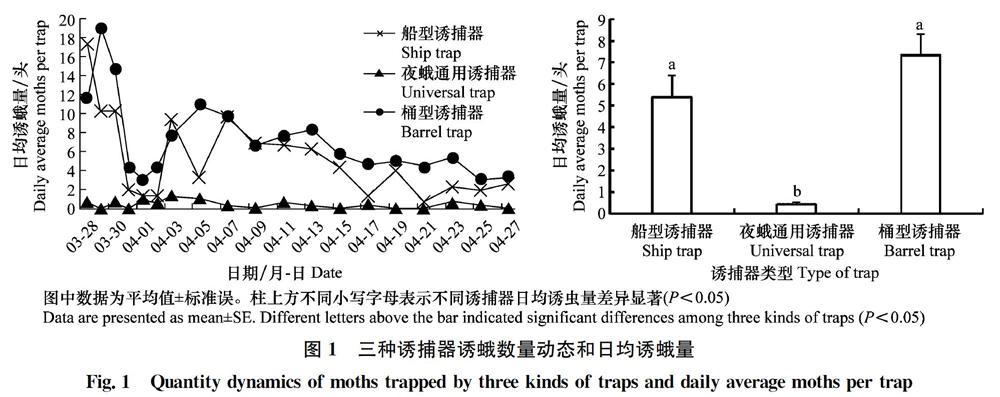
从图1可见,船型诱捕器、夜蛾通用诱捕器和桶型诱捕器试验期间日均诱蛾量分别为(5.38±4.40)、(0.42±0.41)和(7.33±4.28)头/诱捕器,方差分析表明三者之间存在显著差异(F=59.724,df=2,P<0.05)。其中船型诱捕器和桶型诱捕器诱捕效果没有显著差异,但二者显著优于夜蛾通用诱捕器。船型诱捕器和桶型诱捕器诱蛾动态基本一致,诱蛾高峰均出现在3月28日到3月30日之间,而夜蛾通用诱捕器则没有出现诱蛾高峰。综合比较,草地贪夜蛾性诱监测应选择桶型诱捕器为佳。
2.2 草地贪夜蛾雄性生殖系统形态结构
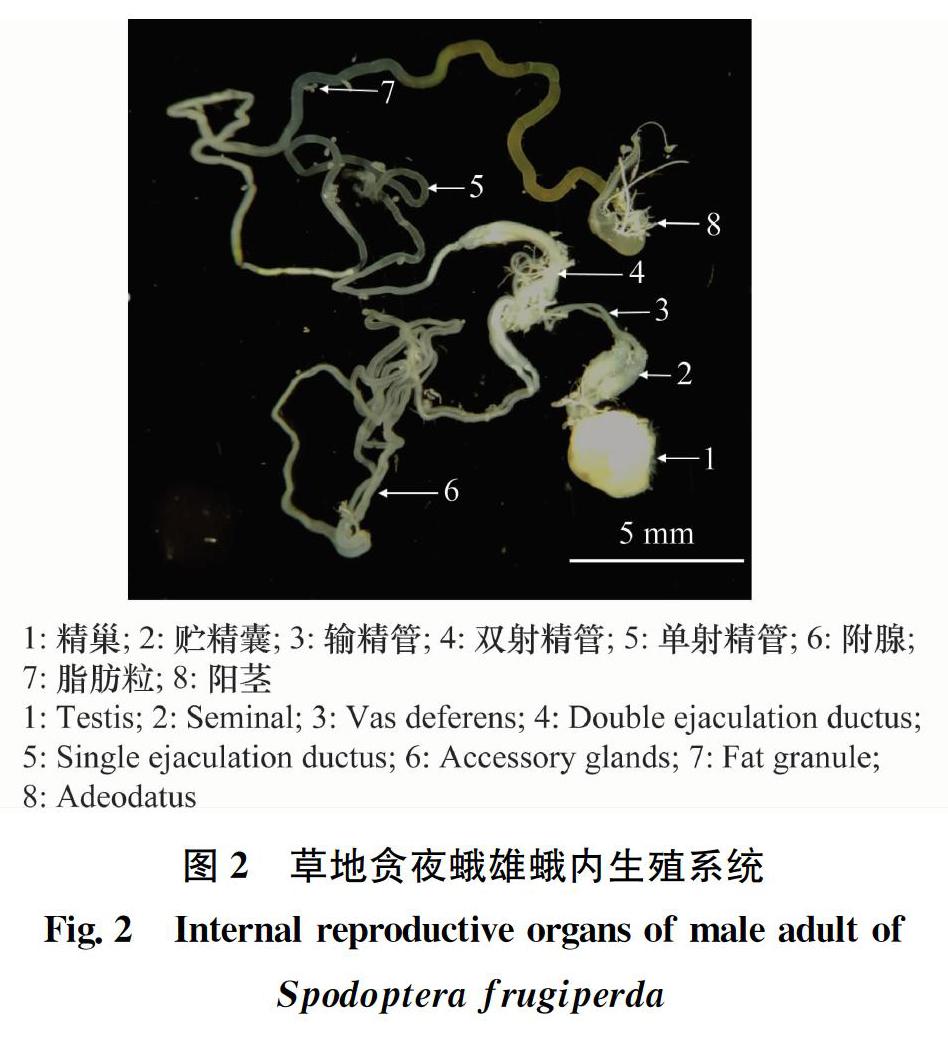
草地贪夜蛾的雄蛾内生殖系统包括精巢、输精管、贮精囊、附腺和射精管。精巢与贮精囊相连,贮精囊再连接输精管,再依次连接射精管和附腺,组成一套完整的生殖系统(图2)。雄性成虫精巢位于雄虫腹中部近背面,为一黄色近球形结构。贮精囊:两根相互交叉、中部膨大的管状结构与精巢相连,末端延伸成输精管;输精管:两根细小、柔软的管道,上端连接贮精囊,下端与双射精管相接,成熟精子由此进入双射精管;双射精管:前端连接单射精管,末端连接附腺,中部通过输精管与一对残月形管状囊相连,管状囊内含成熟精子和附腺分泌物;单射精管:一条细长透明管道,折叠于腹腔内,上、下端分别连接双射精管和阳茎,管内有成熟精子和附腺分泌物,交配时可注入雌虫交配囊。
2.3 草地贪夜蛾精巢发育规律与分级
草地贪夜蛾同其他夜蛾科害虫精巢发育过程相似(图3),在幼虫期具有一对乳白色肾形精巢,随着虫体发育其颜色逐渐变黄,其精巢融合发生在前蛹期,蛹期第5天精巢融合已经完成,两个肾形精巢融合成一个不可分离的近球形黄色精巢,此后至成虫期其精巢保持单一融合精巢状态。
从室内实验种群中选取体型相近的雄蛾进行逐日解剖,共解剖150头。解剖测量后发现,草地贪夜蛾羽化后精巢长轴长度随日龄增加呈下降趋势(图4)。羽化第1天精巢长轴长度为(2 458.94±33.92) μm,羽化第3天降至(1 956.46±39.45)μm,羽化第9天为(1 327.44±20.18)μm,相比第1天衰减了46%,各日龄精巢长轴长度存在显著差异(F=184.210,P<0.05)。对成虫精巢长轴长度和日龄进行函数拟合,得到拟合方程Y=2 752e-0.085X(R2=0.952,P<0.01,Y:精巢长轴长度,X:羽化日龄)。根据各日龄精巢长轴长度的差异显著性,可划分草地贪夜蛾不同日龄精巢长轴的长度范围(表1)。
2.4 田间性诱雄虫日龄组成以及羽化动态反演
对广西河池市都安县性诱雄蛾精巢解剖得到185个精巢长轴长度有效数据。根据精巢长轴长度范围划分日龄,结果表明,3~ 4日龄雄虫占比10.81%,1~2日龄、5~6日龄、7~ 8日龄、9日龄以上占比相对均衡,分别为20.00%、17.84%,25.95%、25.41%。从(图5)可以看出,都安县5月20日、21日为草地贪夜蛾发生的高峰期,诱捕器诱集虫量突增。反演重构草地贪夜蛾雄蛾羽化动态曲线高峰期为5月15日。根据室内(26±2)℃饲养羽化规律,雌虫羽化时间要比雄虫提前大约2 d,据此我们推测了雌蛾的羽化动态曲线,其高峰期在5月13号左右。
3 结论与讨论
精巢发育进度对昆虫种群繁衍有着重要的作用。前人已对夜蛾科害虫的精巢发育规律做了许多研究,夜蛾科昆虫通常在幼虫期具有左右对称的两个精巢,在预蛹期或蛹前期两个精巢融合成为一个近球形精巢,此后保持单一融合精巢直到成虫死亡[34]。国内学者对黏虫[30]、棉铃虫[35]和斜纹夜蛾[32]等夜蛾科害虫精巢发育的研究结果表明,在预蛹期或蛹前期都存在精巢融合的过程,并观察到成虫期的融合精巢会随日龄增加而减小的规律。Milonas等对欧洲玉米螟Ostrinia nubilalis精巢发育规律进行研究,结果表明,其精巢大小随日龄增加而缩减,9日龄相比1日龄雄虫精巢尺寸减小70%以上[36]。陈庆华等根据稻纵卷叶螟精巢随日龄缩减的现象,划分了不同日龄精巢大小的范围标准,进而推测野外雄虫的日龄分布[33]。
本文通过对室内不同发育时期的草地贪夜蛾进行解剖,发现其幼虫期具有一对黄色半透明肾形精巢,蛹前期发生融合,蛹后期至成虫期精巢保持为单一融合精巢状态,这与棉铃虫等夜蛾科害虫精巢发育进程相似。并且其精巢大小随着羽化天数的增加而减小,9日龄精巢长轴长度相比1日龄减小了46%,这与前人对其他昆虫的研究结果相似。我们通过曲线拟合发现草地贪夜蛾精巢大小缩减具有规律性,且不同日龄精巢大小具有显著差异,因此确定了不同日龄精巢长轴的长度范围。影响精巢大小的因素有很多,包括成虫的营养、体长、温度以及交配次数等[32,3738],但这些因素影响相对较小。例如达氏曲突眼蝇Cyrtodiopsis dalmanni的交配次数对精巢大小影响不大[39],黄粪蝇Scathophaga stercoraria的精巢大小与体长无相关性[40];稻纵卷叶螟的体长对精巢大小有一定影响,但日龄仍是主要的影响因子[33];因此利用精巢大小范围的标准,去判别同类或近似环境草地贪夜蛾雄蛾的日龄是可行的。在测报工作中,可以建立不同代别、不同地区的分级标准,通过控制误差而实现对野外雄虫日龄精准划分的目的。通过反演雄蛾羽化动态曲线,我们有效消除了老年失去性能力的雄蛾对测报的影响,根据雌虫的羽化动态和雄虫有密切的同步性,我们基于雄虫种群动态预测雌虫种群动态,并进一步预测雌虫产卵动态和幼虫孵化动态。除了精巢发育,我们还观察了草地贪夜蛾雄性内生殖系统结构,其内生殖系统由精巢、输精管、贮精囊、附腺和射精管组成,结构与小地老虎[41]、黏虫[30]、斜纹夜蛾[32]等常见害虫十分相似。
前人关于草地贪夜蛾性诱剂诱捕试验已经做了很多。Mitchell等测试了诱捕器颜色对诱捕效果的影响,结果表明多颜色的桶型诱捕器诱虫量显著高于纯色的桶型诱捕器[42]。我们的研究表明,国产性诱剂诱陷多对草地贪夜蛾有高效稳定的诱集作用,持效期长于60 d。同时,对船型诱捕器、桶型诱捕器和夜蛾通用诱捕器诱捕效应的比较显示,桶型诱捕器对草地贪夜蛾的诱捕效果最好。因此,测报工作中可利用性诱技术结合精巢解剖分析成虫年龄结构的方法,预测下一代种群发生动态。
参考文献
[1] LUGINBILL P. The fall armyworm[M]. Washington D C: US Department of Agriculture, 1928: 27.
[2] MONTEZANO D G, SPECHTA, SOSA-GMEZ, et al. Host plants of Spodoptera frugiperda (Lepidoptera: Noctuidae) in the Americas [J]. African Entomology, 2018, 26(2): 286301.
[3] PASHLEY D P. Host-associated genetic differentiation in fall armyworm (Lepidoptera: Noctuidae): a sibling species complex?[J]. Annals of the Entomological Society of America, 1986, 79(6): 898904.
[4] PASHLEY D P, JOHNSON S J, SPARKS A N. Genetic population structure of migratory moths: the fall armyworm (Lepidoptera: Noctuidae)[J]. Annals of the Entomological Society of America, 1985, 78(6): 756762.
[5] NAGOSHI R N, MEAGHER R L. Review of fall armyworm (Lepidoptera: Noctuidae) genetic complexity and migration[J]. Florida Entomologist, 2008, 91(4): 546554.
[6] ROSE A H, SILVERSIDES R H, LINDQUIST O H. Migration flight by an aphid, Rhopalosiphum maidis (Hemiptera: Aphididae), and a noctuid, Spodoptera frugiperda (Lepidoptera: Noctuidae)[J]. The Canadian Entomologist, 1975, 107(6): 567576.
[7] SPARKS A N. A review of the biology of the fall armyworm[J]. The Florida Entomologist, 1979, 62(2): 8286.
[8] DAY R, ABRAHAMS P, BATEMAN M L, et al. Fall armyworm: impacts and implications for Africa[J]. Outlooks on Pest Management, 2017, 28(5): 196201.
[9] 劉刚.全国农技中心通报我国及周边国家草地贪夜蛾发生为害情况[J].农药市场信息,2019(9):59.
[10]姜玉英,刘杰,朱晓明.草地贪夜蛾侵入我国的发生动态和未来趋势分析[J].中国植保导刊,2019,39(2):3335.
[11]刘万才,黄冲.我国农作物现代病虫测报建设进展[J].植物保护,2018,44(5):159167.
[12]WOLF W W, WESTBROOK J K, RAULSTON J, et al. Recent airborne radar observations of migrant pests in the United States [and Discussion][J]. Philosophical Transactions of the Royal Society B: Biological Sciences, 1990, 328(1251): 619630.
[13]SPARKS A N, JACKSON R D, CARPENTER J E, et al. Insects captured in light traps in the Gulf of Mexico [J]. Annals of the Entomological Society of America, 1986, 79: 132139.
[14]刘杰,姜玉英,刘万才,等.草地贪夜蛾测报调查技术初探[J].中国植保导刊,2019,39(4):4447.
[15]张鹿平,张智,季荣,等.昆虫雷达建制技术的发展方向[J].应用昆虫学报,2018,55(2):153159.
[16]李育静.麦穗夜蛾田间黑光灯诱集监测效果研究[J].农业科技通讯,2018(7):177179.
[17]秦雪红.虫情测报灯在林业有害生物测报中的应用[J].农村科技,2015(8):3839.
[18]张春辉.卵巢解剖在害虫测报和防治上的应用[J].中国农学通报,1994,10(1):53.
[19]王爱娥.昆虫性诱剂:小产品有大功用[J].农家之友,2014(1):59.
[20]刘莉,卫雅斌,张小龙,等.性诱剂在河北省玉米主要害虫测报上的应用研究[J].河北农业科学,2018,22(1):5458.
[21]昭伟,隆准,黄海涛,等.性诱剂监测邵阳烟区斜纹夜蛾发生动态研究[J].现代农业科技,2019(8):9091.
[22]BARTELS D W, HUTCHISON W D, BACH D J, et al. Evaluation of commercial pheromone lures and comparative blacklight trap catches for monitoring Z-strain European corn borer (Lepidoptera)[J]. Journal of Agricultural & Urban Entomology, 1999, 16(1): 8594.
[23]EVENDEN M L, GRIES R. Assessment of commercially available pheromone lures for monitoring diamondback moth (Lepidoptera: Plutellidae) in Canola [J]. Journal of Economic Entomology, 2010, 103(3): 654661.
[24]SEKUL A A, SPARKS A N. Sex pheromone of the fall armyworm moth: isolation, identification, and synthesis [J]. Journal of Economic Entomology, 1967, 60(5): 12701272.
[25]TUMLINSON J H, MITCHELL E R, TEAL P E A, et al. Sex pheromone of fall armyworm, Spodoptera frugiperda (J. E. Smith)[J]. Journal of Chemical Ecology, 1986, 12(9): 19091926.
[26]CRUZ I, FIGUEIREDO M L C, SILVA R B, et al. Using sex pheromone traps in the decision-making process for pesticide application against fall armyworm (Spodoptera frugiperda[Smith][Lepidoptera: Noctuidae]) larvae in maize [J].International Journal of Pest Management, 2012, 58(1): 8390.
[27]STARRATT A N, MCLEOD D G R. Monitoring fall armyworm, Spodoptera frugiperda (Lepidoptera: Noctuidae), moth populations in southwestern Ontario with sex pheromone traps [J].The Canadian Entomologist,1982,114(7):545549.
[28]GUERRERO A, MALO E A, COLL J, et al. Semiochemical and natural product-based approaches to control Spodoptera spp. (Lepidoptera: Noctuidae)[J]. Journal of Pest Science, 2014, 87(2): 231247.
[29]MALO E A , CRUZLOPEZ L , VALLEMORA J , et al. Evaluation of commercial pheromone lures and traps for monitoring male fall armyworm (Lepidoptera: Noctuidae) in the coastal region of Chiapas, Mexico [J]. Florida Entomologist, 2001, 84(4): 659664.
[30]吳秋雁,郭郛.粘虫生殖的研究Ⅲ.生殖系统的发育[J].昆虫学报,1964,13(6):795802.
[31]朱诚棋,王博,陆雪雷,等.凤凰木夜蛾雌雄生殖系统的解剖[J].中国森林病虫,2017,36(2):3234.
[32]徐博.斜纹夜蛾前胸腺与性腺的形态结构和发育研究[D].广州:中山大学,2012.
[33]陈庆华,曾娟,曾伟,等.稻纵卷叶螟雄蛾内生殖系统形态指标在性诱测报中的应用[J].昆虫学报,2017,60(8):927935.
[34]刘琳,冯启理.鳞翅目昆虫精巢融合的研究[J].华南师范大学学报(自然科学版),2014,46(5):17.
[35]陈大福,牛宝龙,翁宏飚,等.棉铃虫(Helicoverpa armigera)幼虫性特征和精子的发生[J].浙江农业学报,2004(6):69.
[36]MILONAS P G, ANDOW D A. Virgin male age and mating success in Ostrinia nubilalis (Lepidoptera: Crambidae)[J]. Animal Behaviour, 2010, 79(2): 509514.
[37]KLEMME I, SOULSBURY C D, HENTTONEN H. Data from: Contrasting effects of large density changes on relative testes size in fluctuating populations of sympatric vole species[J]. Proceedings of the Royal Society B: Biological Sciences, 2014, 281(1792): 4651.
[38]叶恭银,胡萃,龚和.高温对珍贵绢丝昆虫——天蚕睾丸生长发育的影响[J].应用生态学报,2000,11(6):851855.
[39]ROGERS D W, CHAPMAN T, FOWLER K, et al. Mating-induced reduction in accessory reproductive organ size in the stalk-eyed fly Cyrtodiopsis dalmanni[J]. BMC Evolutionary Biology, 2005, 5(1): 37.
[40]WARD P I, SIMMONS L W. Copula duration and testes size in the yellow dung fly, Scathophaga stercoraria (L.): the effects of diet, body size, and mating history [J]. Behavioral Ecology and Sociobiology, 1991, 29(2): 7785.
[41]盧筝.小地老虎生殖系统的研究[J].昆虫学报,1982,25(3):268274.
[42]MITCHELL E R, AGEE H R, HEATH R R. Influence of pheromone trap color and design on capture of male velvet bean caterpillar and fall armyworm moths (Lepidoptera: Noctuidae)[J]. Journal of Chemical Ecology, 1989, 15(6): 17751784.
(责任编辑:杨明丽)

